El retinoblastoma es el tumor maligno intraocular más frecuente en niños y constituye el 3% de todos los cánceres en pediatría. Su incidencia varía entre 1/14.000 y 1/35.000 de nacidos vivos. Fue descrito por primera vez en 1597. No tiene predilección por sexo o raza y ocurre bilateralmente en 30% de los casos.
Cuadro Clínico del Retinoblastoma
En los casos unilaterales, la edad promedio en el momento del diagnóstico es 24 meses, mientras los casos bilaterales son diagnosticados en edades más tempranas, a los 12 meses, en promedio.
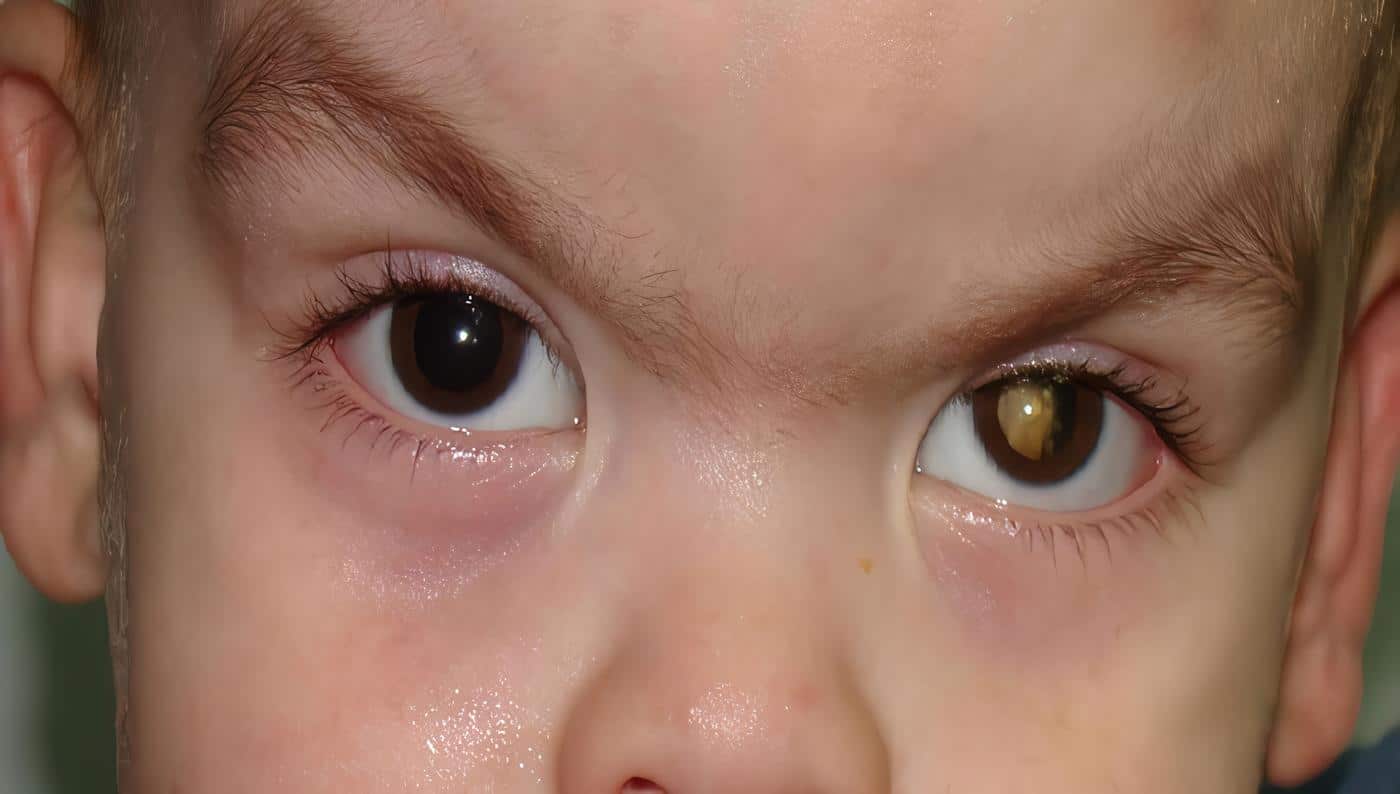
En forma característica, el ojo del niño con retinoblastoma es de tamaño normal, con cristalino transparente. La manifestación clínica varía de acuerdo al estado; en la mayoría de los casos se presenta leucocoria (pupila con reflejo blanco). Las lesiones pequeñas sólo pueden diagnosticarse por oftalmoscopia y pueden ser únicas o múltiples.
Los tumores grandes (mayores de 4 diámetros papilares) son, en general, menos transparentes, blancos, sólidos. Cuando se inician en el área macular, suelen desarrollar exotropia o endotropia, por inhabilidad para fijar o desviar el ojo involucrado. (Ver también: Sarcomas de Tejidos Blandos)
El examen del fondo de ojo debe realizarse en todo niño recién nacido.
Cuando hay historia familiar de retinoblastoma, debe continuarse trimestralmente.
En la oftalmoscopia se aprecia como una masa blanca, con dilatación de arterias y venas, que al crecer adquieren un patrón endofítico
Generalmente invade la cavidad vítrea y puede invadir la cámara anterior, produciendo múltiples nódulos en el margen pupilar. La presencia de células tumorales en la cámara anterior es signo de mal pronóstico y usualmente demanda enucleación o tratamiento radical.
El patrón exofítico se extiende al espacio subretinal y los vasos retinales aparecen sobre la superficie del tumor, produciendo un progresivo desprendimiento de la retina. En la mayoría de los casos el tumor puede verse en forma de masas blancas multilobuladas, por detrás de la retina desprendida.
Una forma poco frecuente de presentación es la del tipo infiltrativo difuso, que se caracteriza por infiltración plana de la retina; estos tumores generalmente se presentan en niños entre 5 a 12 años y son de tipo unilateral, con historia familiar negativa.
Aproximadamente en 17% de los casos suele ocurrir rubeosis, la cual es secundaria a isquemia posterior y puede producir glaucoma, dolor y edema corneal. En algunos tumores con necrosis, puede presentarse inflamación periocular, la cual se manifiesta clínicamente como celulitis preseptal o endoftalmitis.
La vía más frecuente de diseminación del tumor es la extensión extraocular a lo largo del nervio óptico, desde donde el tumor puede invadir el espacio subaracnoideo y la cavidad intracraneana.
La invasión de la coroides da acceso a los vasos sanguíneos, que es una vía potencial de metástasis a distancia. En los casos avanzados, la lesión penetra a la órbita a través de la esclera.
Genética del Retinoblastoma
El retinoblastoma es un tumor secundario a la mutación de un gen localizado en el cromosoma 13q14, denominado Rb. En las células tumorales los dos alelos del Rb han perdido su funcionalidad, es decir existe una doble mutación. Esta mutación no aparece simultáneamente, y se llama primera y segunda mutación.
En el caso del retinoblastoma hereditario, la primera mutación es heredada de uno de los padres, por lo cual se encuentra presente en todas las células del cuerpo, incluyendo los retinoblastos. La segunda mutación se produce exclusivamente en el retinoblasto.
En el caso del retinoblastoma no hereditario o esporádico, las dos mutaciones ocurren sólo a nivel somático en los retinoblastos, así las células germinales estén libres del defecto.
Cuando el tumor es unilateral:
El riesgo de desarrollar retinoblastoma en el ojo contralateral es del 10%; cuando es unilateral multifocal se debe considerar como de origen hereditario.
Un porcentaje muy bajo (1-5%) de los pacientes exhibe alteraciones en el cariotipo, y cuando el retinoblastoma está acompañado de otras anomalías como colobomo del iris o retardo mental, el análisis cromosómico puede demostrar alteraciones 13q14.
Recientemente, se están utilizando análisis moleculares en la consejería genética, y con la definición de la primera mutación en la célula del tumor, es posible establecer si el paciente es portador de la mutación o si la heredó de alguno de sus padres. Sin embargo, aproximadamente 10% de los casos son debidos al mosaicismo celular, un estado que no siempre es fácil de determinar y que debe considerarse en el momento de la consejería genética.
En el consejo genético sin el beneficio del análisis cromosómico se debe considerar que el riesgo de aparición de retinoblastoma en la descendencia de un sobreviviente de la forma hereditaria es del 45%, mientras que en la descendencia de sobrevivientes de la forma unilateral no hereditaria es de 2,5%.
Patología del Retinoblastoma
Es muy importante la evaluación por patología, porque permite establecer y definir lo siguiente:
1. Diagnóstico.
2. Definición de la extensión de la enfermedad.
3. Proponer pautas para manejo terapéutico posterior.
4. Identificar metástasis o segundos tumores primarios.
El estudio por patología incluye, luego de la clínica previa, la evaluación macroscópica y la descripción microscópica.
Procedimientos macroscópicos
1. Fijación del ojo intacto en formol al 10% o mezcla de glutaraldehido-formol, por 24 horas.
2. Medición en mm del globo ocular: anteroposterior, horizontal y vertical
3. Medición de la longitud y el diámetro del nervio óptico.
4. Medición de la córnea, horizontal y verticalmente.
5. Corte del globo con cuchilla, de atrás hacia delante, en cercanía del nervio óptico, hasta la periferia de la córnea (depende de la localización del tumor).
6. Corte horizontal entre la inserción de los músculos oblicuos superiores e inferiores y la vena pos-ciliar.
7. Examen de tejidos blandos perioculares.
8. Descripción del segmento anterior, opacidad y grosor de la córnea, anormalidad del iris y del cuerpo ciliar, localización y anormalidades del cristalino.
9. Examen de cámara anterior y ángulo, coroides, retina, cuerpo vítreo y disco óptico.
10. Localización del tumor, tipo de crecimiento (endofítico, exofítico, mixto, difuso y regresión espontánea), tamaño, color, consistencia, zonas de hemorragia, necrosis, estructuras oculares comprometidas, extensión al nervio óptico y compromiso del borde de sección.
Procedimiento microscópico
Por tipo celular
1. Diferenciado: evidencia de formación de rosetas de tipo Flexner-Wintersteiner, menos frecuentes rosetas de tipo Home-Wright, ocasionales «fleuretes», raro encontrar elementos celulares bipolares retinales, ocasional diferenciación glial y pocas mitosis (Retinocitoma)
2. Indiferenciado: densas masas de células pequeñas, redondas u ovales, de núcleo hipercromático y escaso citoplasma, dispuestas en nidos o en trabéculas predominantemente perivasculares, frecuentes mitosis, depósitos hematoxinofílicos y cálcicos distróficos; en la pared de vasos venosos vecinos a zonas de necrosis e isquemia tumoral, pueden verse agregados esferoidales tumorales libres en el vítreo o en el espacio subretiniano (Retinoblastoma).
Por grado de diferenciación
Porcentaje de células diferenciadas (Rosetas de Flexner-Wintersteiner) sobre el total de células tumorales.
1. Bien diferenciado: rosetas en el 80% o más.
2. Intermedio: menos de 80% de rosetas.
3. Pobremente diferenciado: no se observan rosetas.
Compromiso del nervio óptico
1. Sin compromiso.
2. Compromiso prelaminar (anterior a la lámina cribosa).
3. Compromiso poslaminar (dentro o atravesando la lámina cribosa), sin invasión de la línea de sección del nervio o del espacio subaracnoideo.
4. Invasión del borde de sección o del espacio subaracnoideo.
Compromiso de coroide y esclera
1. Sin invasión de coroides.
2. Mínimo compromiso (las células tumorales han destruido la membrana de Bruch, sin invadir profundamente coroides, máximo tres focos microscópicos (invasión focal).
3. Invasión masiva de la coroides (cualquiera que no encaje en el grupo anterior).
4. Compromiso intraescleral.
5. Compromiso extraescleral.
Inmunohistoquímica
Es inespecífica, evidencia fotodiferenciación y confirma la naturaleza pluripotencial neuroectodérmica, glial y neuronal de las células tumorales.
Puede dar reactividad positiva con Leu 7, antígeno retiniano S, synaptafisina, proteína de unión retiniana, proteína S-100, proteínas interfotoreceptoras, proteína ácida glial fibrilar, proteína básica de la mielina y enolasa neuronal específica.
Clasificación Clínica
Cada ojo deber ser evaluado por separado. La clasificación en la enfermedad bilateral se hace con base en el ojo más severamente afectado.
Debido a que cada país o grupo adopta diferentes sistemas de clasificación, y hasta que exista un sistema estándar, se acepta, con el propósito de evaluar los programas terapéuticos, la clasificación de Reese-Ellsworth para tumores intraoculares y la clasificación del Children Cancer Group (CCG), para los tumores extraoculares.
Clasificación de Reese- Ellsworth (Reese-Ellsworth, 1963)
Grupo I Muy favorable para la conservación de la visión.
a. Tumor solitario, menor de 4 diámetros de disco (DD), localizado en o detrás del ecuador.
b. Tumores múltiples, ninguno mayor de 4 DD, localizados en o detrás del ecuador.
Grupo II Favorable para la conservación de la visión.
a. Tumor solitario, de 4 a 10 DD, localizado en o detrás del ecuador Tumores múltiples de 4 a 10 DD, todos en o detrás del ecuador.
Grupo III Posible conservación de la visión.
a. Cualquier lesión anterior al ecuador.
b. Tumor solitario mayor de 10 DD detrás del ecuador.
Grupo IV Desfavorable para la conservación de la visión.
a. Tumores múltiples, algunos mayores de 10 DD.
b. Cualquier lesión que se extiende anteriormente a la ora serrata.
Grupo V Muy desfavorable para la conservación de la visión.
a. Tumores masivos que afectan más de la mitad de la retina.
b. Siembras vítreas.
Clasificación del CCG (Children Cancer Group)
Estado I: Compromiso microscópico por células tumorales en los canales emisarios esclerales o células tumorales dispersas en los tejidos epiesclerales en el momento de enucleación.
Estado II: Evidencia microscópica de tumor en el borde de sección del nervio óptico. En el momento de enucleación.
Estado III: Enfermedad orbitaria, diagnosticada por biopsia.
Estado IV: Masa tumoral presente en el sistema nervioso central o células tumorales presentes en el liquido cefaloraquídeo.
Y Estado V: Metástasis hematógenas a médula ósea, hueso u otras localizaciones, o diseminación a ganglios linfáticos.
Diagnóstico
La mayoría de los niños con retinoblastoma son menores de seis años y presentan un examen físico normal. Para el diagnóstico, debe realizarse una historia clínica completa, iniciando con el tiempo de evolución de signos tales como leucocoria, estrabismo, disminución o pérdida de la agudeza visual, dolor, proptosis.
Al examen externo del globo ocular, usualmente el segmento anterior se encuentra normal.
A la biomicroscopia se puede ocasionalmente presentar pseudohipopión y el cristalino usualmente es transparente. Puede observarse el tumor invadiendo el vítreo, como una masa endofítica o exofítica, con o sin siembras vítreas.
La oftalmoscopia indirecta debe realizarse bajo anestesia general, con pupila dilatada. Se debe explicar la importancia de este examen a los padres y se debe realizar cada tres meses, hasta los seis años de edad.
La angioflouresceinografía puede ser un examen de ayuda para el diagnóstico y para evaluar la respuesta al tratamiento en casos seleccionados de niños con retinoblastoma localizado, variando el patrón con el tamaño y espesor del tumor.
Los tumores pequeños intraretinales muestran solamente mínimas dilataciones vasculares en la fase arterial, mediana hipervascularidad en la fase venosa y mediana tinción de la masa. En cambio, los tumores grandes muestran hipervascularidad y tinción más intensa.
La ecografía es un examen de mucha importancia para el diagnóstico del retinoblastoma, especialmente para descartar los pseudoretinoblastomas. En el modo A se observan en una forma muy típica cuando hay calcificación, ecos de alta reflectividad. El modo B ayuda localizando el sector de la retina comprometido. Su forma, redonda o irregular, puede ser usada para determinar la regresión del tumor como respuesta al tratamiento.
La TAC determina
Las zonas calcificadas del tumor, así como la extensión intra y extraocular.
La RM puede ser usada en el diagnóstico de retinoblastoma. En T1 es moderadamente hiperintenso e hipointenso en T2.
En todos los pacientes sometidos a anestesia general debe realizarse una punción lumbar, para estudio de citología del líquido cefalorraquídeo.
Los pacientes con enfermedad extraocular se debe solicitar gammagrafia ósea, y en aquellos en quienes se sospeche compromiso de médula ósea por alteraciones, del cuadro hemático, se realizará aspirado y biopsia de médula ósea.
Tratamiento
El manejo del retinoblastoma es extremadamente complejo y deber ser interdisciplinario. Cada caso puede ser individualizado de acuerdo a la situación clínica, tamaño y localización del tumor, si es unilateral o bilateral y si existe enfermedad extraocular.
Las modalidades de tratamientos utilizadas son: enucleación, radioterapia externa, placas esclerales de irradiación (braquiterapia), fotocoagulación, críoterapia, quimioterapia y termofotocoagulación transpupilar. En algunos casos es necesario combinar los tratamientos para tratar de controlar la enfermedad.
Enucleación
Cada día se trata de realizar menos enucleaciones, pero está indicada en aquellos casos en los cuales no existe posibilidades de preservación de la visión.
Indicaciones de la enucleación:
Retinoblastoma unilateral con ojo ciego.
Retinoblastoma bilateral con ambos ojos ciegos.
Y Retinoblastoma uni o bilateral, con glaucoma secundario o rubeosis del iris. Recurrencia local, no controlada con otras terapias conservadoras.
Exenteración
Cada vez es menos frecuente la realización de esta cirugía. Consiste en la remoción del globo ocular, músculos extraoculares, párpado, nervios y grasa orbitaria. Está indicada cuando hay extensión del tumor hacia la órbita a través del globo ocular y en caso de recurrencia orbitaria post-enucleación.
Crioterapia
Es un método efectivo en el manejo de casos muy seleccionados de pequeños retinoblastomas. Está indicada en tumores localizados cerca de la ora serrata, menores de 3,5 mm de diámetro y de 2 mm de espesor. Se aplica bajo anestesia, general con pupila dilatada y se controla con oftalmoscopia indirecta. Se aplica por tres ocasiones y se puede repetir a la tercera o cuarta semana.
Fotocoagulación
También está indicada en casos de tumores pequeños, y puede realizarse como tratamiento primario o complementario de la radioterapia o crioterapia. Se realiza bajo anestesia general y con pupila dilatada, utilizando láser argón; se rodea el tumor con dos hileras, para ocluir los vasos nutricios.
Puede ser necesario repetirla a las 4 o 6 semanas, completando dos o tres sesiones. Se sugiere utilizar láser cuando el tumor es menor de 4 diámetros papilares (6 mm) y con 2 mm de espesor. No se puede aplicar en los tumores que estén cerca de la ora serrata o cuando estén en el área foveolar, porque producen marcada disminución de visión.
Terapia subconjuntival
Se han llevado a cabo estudios fase I/II para evaluar la eficacia y la toxicidad de derivados de platino usados en inyección subconjuntival, para tratamiento de retinoblastoma intraocular. Sin embargo, se necesitan estudios adicionales y un período de seguimiento más largo, especialmente para determinar el riesgo de atrofia óptica.
Radioterapia
Placa Radioactiva (Co60, Ir192, Ru109, I125)
Está indicada en:
Tumores solitarios de 6 a 15 mm de diámetro, con menos de 10 mm de espesor, ubicados a más de 3 mm del disco óptico o la fóvea.
En dos lesiones pequeñas cubiertas por una placa.
Recaída local después de otra terapia conservadora.
Siembras vítreas pequeñas sobre el ápex.
Técnicas
Las placas de Co60 son de tamaños estándar y su relativa vida media de 5 años permite su utilización por varios años. La alta energía y la amplitud de su curva de isodosis garantiza que todo el espesor del tumor infiltrante pueda ser tratado. Sin embargo, la protección de los tejidos normales adyacentes es imposible.
Las placas de I125 pueden ser elaboradas para cada caso, con efectiva protección de las estructuras normales y mínima exposición del personal. Dosis 40 50 Gas base.
100 120 Gas ápex.
Nota: El INC no cuenta con estas placas y, por lo tanto, carece de experiencia con su uso.
Radioterapia externa
Objetivo
Tratar toda la retina
Evitar el ojo contralateral
Limitar la dosis a tejido normal
Dosis homogéneas y tumoricidas a retina y vítreo
Células retinianas con potencial neoplásico
Siembras vítreas
Indicaciones
Retinoblastoma multifocal
Compromiso de mácula o nervio óptico
Tumores grandes
Compromiso vítreo
Técnica
Campo lateral directo
Campo anterior directo
Hemibloqueo lateral
Campo anterior y lateral
Dosis 1,8 – 2,0 Gy, 5 días por semana, dosis total 45 Gy. En tumores grandes con compromiso vítreo, la dosis se aumenta a 50 Gy.
Radioterapia postoperatoria
Compromiso del nervio óptico.
Extensión estraescleral.
Procedimiento quirúrgico intraocular.
Dosis 45 – 60 Gy.
Quimioterapia
La quimioterapia, que incluye ciclofosfamida, vincristina, doxorubicina, derivados del platino y epipodofilotoxinas, ha demostrado su utilidad en la enfermedad extraocular. Sin embargo, se está utilizando cada vez más en niños con retinoblastomas intraoculares, en un intento por preservar la visión y eliminar el uso de la radioterapia externa.
La quimioterapia está indicada en los siguientes casos:
1. Como tratamiento citorreductor, en tumores intraoculares con visión potencial.
2. En enfermedad extraocular.
3. En recurrencia local.
4. En enfermedad metastásica.
Tratamiento de enfermedad Intraocular sin visión potencial
Los pacientes con enfermedad intraocular sometidos a enucleación que tengan tumor más allá de la lámina cribosa o una longitud del nervio óptico menor o igual a 5 mm, podrán dejarse en vigilancia postenucleación sin recibir quimioterapia o recibir 10 ciclos de quimioterapia con intervalos de 21 días, según la recuperación hematológica así:
Ciclofosfamida: 1 g/m2/día o 30 mg/kg en menores de 10 kg de peso, el día uno de tratamiento, IV
Mesna: 1 g/m2 después de aplicada la ciclofosfamida
VCR: 0,05 mg/kg/día 1 de tratamiento, IV
Administrar líquidos IV con DAD 5% 2:1 con solución salina normal 10 ml/kg hora dos una hora antes de la quimioterapia y cinco horas después.
Tratamiento de enfermedad intraocular con visión potencial
Bajo riesgo
Tumores unilaterales Resse-Ellsworth V, recibirán 2 ciclos de quimioterapia con intervalos de 21 días o según recuperación hematológica, con carboplatino 540 mg/m2 (en menores de 10 Kg de peso, 18 mg/kg) el día uno de tratamiento. Posteriormente, se realiza examen oftalmológico bajo anestesia general, para evaluar respuesta a quimioterapia.
En caso de respuesta parcial (más de 50% de reducción tumoral) que permita tratamiento local (crioterapia o fotocoagulación), se aplica de inmediato, continuando con la quimioterapia hasta completar 6 ciclos.
Si la respuesta parcial no es satisfactoria para iniciar tratamiento local (menos del 50% de reducción tumoral), se continúa con el esquema de alto riesgo con carboplatino 540 mg/m2 (en menores de 10 kg de peso, 18 mg/kg.) el día uno de tratamiento y Etopósido 100 mg/m2 los días 1, 2 y 3 de tratamiento (en menores de 10 kg de peso 3.3 mg/kg día) hasta un máximo de 6 ciclos, con valoración oftalmológica bajo anestesia general cada 2 ciclos, para definir la administración de tratamiento local en el momento que, a criterio del oftalmólogo, sea conveniente.
La enfermedad progresiva
Se maneja como en recaída.
En caso de llegar a enucleación, se congelará material para estudio de biología molecular y genética.
Alto riesgo
Tumores intraoculares bilaterales Resse-Ellesworth IV, V o tumores en pacientes con ojo único, deben recibir 2 ciclos de quimioterapia con intervalo de 21 días o según recuperación hematológica así:
Carboplatino: 540 mg/m2, día 1 (en menores de 10 kg de peso, 18 mg/kg)
Etoposido: 100 mg/m2, días 1, 2 y 3 (en menores de 10 kg de peso, 3,3 mg/kg día)
El etopósido debe ser diluido en solución salina normal, a razón de 0.5 mg/ml y administrado en infusión de una a dos horas.
Posteriormente, valoración oftalmológica para determinar aplicación de tratamiento local.
En caso de respuesta parcial que permita tratamiento local (crioterapia o fotocoagulación), aplicar de inmediato, continuando con la quimioterapia hasta completar 6 ciclos.
En casos de respuesta parcial, pero insuficiente para iniciar tratamiento local se continúa la misma quimioterapia hasta completar 6 ciclos, máximo, con valoración oftalmológica bajo anestesia general cada 2 ciclos para definir la administración de tratamiento local, en el momento que, a criterio del oftalmólogo, sea conveniente.
La enfermedad progresiva se trata como recaída.
Tratamiento de tumores extraoculares
Se clasifican de acuerdo a estadificación de CCG.
Enfermedad en Estado I: Se aplican 6 ciclos de quimioterapia con intervalos de 21 días o según recuperación hematológica, sin radioterapia.
Carboplatino 540 mg/m2 día1 (en menores de 10 kg de peso, 18 mg/kg)
Etoposido 100 mg/m2 días 1, 2 y 3 (en menores de 10 kg de peso, 3,3 mg/kg día)
Enfermedad estado II y III: Deben recibir 6 ciclos de quimioterapia con carboplatino y etopósido, en las mismas dosis que para el Estado I, con intervalos de 21 días o según recuperación hematológica, con radioterapia externa a órbita y trayecto del nervio, incluyendo el quiasma óptico, 4500 cGy inmediatamente después de la enucleación.
Enfermedad estado IV y V: Los tumores metastásicos deben recibir después de la enucleación carbopaltino más etopósido, alternando cada 21 días con vincristina, ciclofosfamida y doxorubicina.
Carboplatino 540 mg/m2, día1 (en menores de 10 kg de peso, 18 mg/kg) IV
Etopósido 100 mg/m2, días 1, 2 y 3 (en menores de 10 kg de peso 3,3 mg/kg día) IV
Vincristina 0.05 mg/kg, día 1,IV de tratamiento Ciclofosfamida 40 mg x kg día, 1, IV de tratamiento Doxoubicina 0,67 mg x kg, días 1, 2 y 3, IV de tratamiento. Si después del cuarto ciclo se encuentra respuesta parcial o completa, los pacientes son candidatos a trasplante de médula ósea. Los pacientes en Estado IV deben recibir radioterapia craneoespinal.
Lecturas Recomendadas
- 1. ABRAMSON DH , FRANK CM, DANKER IJ. A phase I/II study of subconjuntival carboplatin for intraocualr retinoblastoma. Ophthalmology 106:1947-9, 1999.
- 2. BERNAL JF, ZAPATA J, LÓPEZ VILLEGAS A, GARCÍA C. Retinoblastoma. Estudio epidemiológico y clínicopatológico de 40 casos (1956-1970) Acta Med Valle 2:148, 1972.
- 3. BISHOP JO, MADSON EC. Retinoblastoma. Review of the current status. Surv Ophthalmol 19:342, 1975.
- 4. BLANQUET V, TURLEAU C, GROSS-MORAND MS, ET AL. Spectrum of germline mutations in de RB1 gene: a study of 232 patients with hereditary and non hereditary retinoblastoma. Human Molec Genet 4:383,1995.
- 5. DONOSO LA, SHIELDS JA: Intracranial malignancy in patients with bilateral retinoblastoma. Retina 1:67- 74, 1981.
- 6. DONALDSON SS, EGBERT PR, Newshan I and Cavenee WK. Retinoblastomy. In: Pizzo PA and Poplack DG (eds) Principles and practice of pediatric oncologye. Philadelphia, JB Lippincott company 6999- 715, 1997.
- 7. FOLBERG R, CLEASBY G, FLANAGAN JA, ET AL. Orbital leiomyosarcoma after radiation therapy for bilateral retinoblastoma. Arch Ophthalmol 101:1562, 1083.
- 8. GALLIE LB. Predictive testing for retinoblastoma comes of age. Am J Human Genet 61:279, 1997.
- 9. JAKOBIEC FA, TSO MOM, ZIMMERMAN LE, DANIS P. Retinoblastoma and intracranial malignancy. Cancer 39:2048, 1997.
- 10. LOHMAN DR, GENECK M, BRANDT B, ET AL. Constitutional RB1-gene mutation in patients with isolated unilateral retinoblastoma. Am J Human Genet 61:282, 1997.
Referencias
- 11. SHIELDS CL, SHIELDS JA, NEEDLE M, ET AL. Combined chemoreduction and adjuvant treatment for intraocular retinoblastoma. Ophthalmology 104:2101, 1997.
- 12. SHIELDS CL; SHIELDS JA. Recent developments in the management of retinoblastoma. J Pediatr Ophthalmol Strabismus 36:8, 1999.
- 13. SIPPEL KC, FRAIOLI RE, SMITH GD, ET AL. Frequency of somatic and germ-line mosaicism in retinoblastoma: implications for genetic counseling. Am J Hum Genet 62:610, 1998.
- 14. VOGEL F. Genetics of retinoblastoma Human Genet. 52:1, 1979.
- 15. YUNIS JJ, RAMSAY N. Retinoblastoma and subband deletion of chromosome 13. Am J Dis Child 132:161, 1978.
- 16. ZIMMERMAN LE, BURNS RP, WANKUM G, ET AL. Trilateral retinoblastoma: ectopic intracranial retinoblastoma associated with bilateral retinoblastoma. J Pediatr Ophthalmol Strabismus 19:310, 1982.