6.3. Enfermedad metabólica ósea en pacientes con ERC que incluye anormalidades en laboratorio
Los cambios en el metabolismo del mineral óseo y la alteración de la homeostasis del calcio y del fosfato ocurren muy al inicio de la ERC y evolucionan a medida que la función renal decae.
Estos cambios se agrupan bajo el concepto trastorno mineral y óseo asociado a la ERC (Chronic Kidney Disease-Mineral and Bone Disorder) que incluye la osteodistrofia renal y la calcificación extraesquelética (vascular) relacionada como anomalías del metabolismo mineral óseo.
La osteodistrofia renal es el componente del trastorno mineral y óseo asociado a la ERC que se identifica y cuantifica a través de la histomorfometría de la biopsia ósea (hiperparatiroidismo), osteomalacia, y enfermedad ósea adinámica.
La evidencia sobre la cual las guías existentes recomendaron metas de tratamiento para concentraciones séricas de calcio, fosfato y de hormona paratiroidea (PTH). Y las estrategias para lograr esas metas, son exclusivamente observacionales y problemáticas por esa razón.
Además, muy poca de la evidencia se deriva de pacientes con ERC sin diálisis.
No obstante, el grupo de trabajo de la guía KDIGO considera que es importante incluir aquí algunas de las recomendaciones clave relacionadas con anomalías del metabolismo mineral en pacientes con ERC sin diálisis del documento KDIGO Clinical Practice Guideline for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MDB) publicado en 2009(318).
6.3.1. Evaluación de calcio, fosfato, hormona paratiroidea y fosfatasa alcalina
37. Se recomienda medir los niveles séricos de calcio, fosfato, hormona paratiroidea y actividad de fosfatasa alcalina por lo menos una vez en adultos con una tasa de filtración glomerular inferior a 45 ml/min/1,73 m2 (Categorías TFG: G3b a G5). Con el fin de determinar los valores en línea de base e informar las ecuaciones predictivas en caso de utilizarlas.
(Recomendación débil a favor, calidad de la evidencia baja)
6.3.1.1. Resumen de la evidencia
Existen estudios observacionales que describen las anomalías de cada uno de estos parámetros en valores relativamente altos de la TFGe en general y en cohortes de poblaciones de alto riesgo(319-321).
De manera importante, las anomalías de calcio y de fosfato parecen ocurrir relativamente más tarde en el curso de la ERC que las anomalías en valores de 1,25(OH)2D, 25(OH)D, y PTH. Así, la recomendación es evaluar estos parámetros relativamente pronto en la trayectoria de la ERC, como evaluación de la carga de la enfermedad.
En pacientes con diálisis, los mayores riesgos para la mortalidad se han reportado con combinaciones altas de fosfato sérico y calcio en conjunto ya sea con PTH alta (RR: 3,71; IC 95 %: 1,53-9,03; P = 0,004) o PTH baja (RR: 4,30; IC 95%, 2,01-9,22; P = 0,001) en comparación con la combinación de PTH alta con calcio sérico y fosfato normal que tuvieron la mortalidad más baja y se usó como categoría índice(322).
Es probable que la importancia de examinar las combinaciones de parámetros de metabolismo mineral. No sea diferente en pacientes con ERC menos grave pero esto no ha sido probado en poblaciones sin diálisis.
También existen diferencias raciales en los parámetros del metabolismo mineral.
En una cohorte de múltiples instituciones de 227 personas de raza negra y 1633 pacientes que no lo eran y que tenían ERC en etapa inicial, las personas de raza negra tenían niveles similares de 1,25(OH)2D en comparación con los que no eran de raza negra, y niveles significativamente menores de 25(OH)D con mayores niveles de calcio, fosfato y PTH, y tenían mayor probabilidad de tener hiperfosfatemia que las personas de otras razas(323).
En el análisis multivariable, ajustando por edad, género, TFGe, IMC, y diabetes. Las personas de raza negra tenían niveles significativamente más bajos de 25(OH)D y mayores niveles de PTH que quienes no eran de raza negra.
Al examinar las relaciones entre 25(OH)D y PTH en 8415 participantes adultos (25 % e raza negra negros y 24 % mexicanoamericanos) en la encuesta National Health and Nutrition Examination Survey (NHANES) 2003-2004 y 2005-2006, y la relación entre 25 (OH)D y la densidad mineral ósea en 4206 participantes (24 % negros y 24 % mexicano-americanos) en la muestra del NHANES 2003- 2004, Gutiérrez et al. encontraron diferencias raciales significativas(324).
Las personas de raza negra y los mexicano-americanos tenían concentraciones significativamente más bajas de 25 (OH)D y más altas de PTH que los blancos (P<0.01 para ambos). La densidad mineral ósea disminuyó de manera significativa (P<0.01) ya que el consumo de plasma 25(OH)D y de calcio disminuyó entre las personas de raza blanca y los mexicanoamericanos, pero no entre los de raza negra (P = 0.2).
6.3.1.2. Razones para la recomendación
A medida que disminuye la función renal, progresan las anomalías del calcio sérico, fosfato, y hormonas circulantes relacionadas con la ERC relacionada con enfermedad metabólica ósea. Estas incluyen PTH, 1,25-dihidroxivitamina D (1,25(OH)2D), y otros metabolitos de la vitamina D, factor de crecimiento fibroblástico 23 (FGF-23); y hormona del crecimiento. A nivel de los tejidos, existe una regulación por disminución de receptores de la vitamina D y resistencia a las acciones de la PTH.
Las anomalías inmunohistoquímicas en los huesos también ocurren de manera temprana y en general preceden cambios en la homeostasis mineral.
La calcificación extraesquelética puede surgir de metabolismo mineral y óseo alterado, y de terapias utilizadas en un intento de corregir estas anomalías.
y las asociaciones entre los trastornos del metabolismo mineral y la CVD han ampliado el punto focal de la ERC relacionada con densidad mineral ósea para incluir el metabolismo mineral anormal, hueso anormal, y calcificación extraesquelética. Una vez que los valores iniciales se han obtenido, la frecuencia posterior de las pruebas se determinará individualmente según el valor real y cualquier intervención que pueda introducirse.
Implicaciones para la práctica clínica y la política pública.
Dado que no hay una recomendación clara con respecto a los valores ‘esperados’ en la ERC ni consenso sobre los umbrales relacionados con el tratamiento. La prueba de la PTH y los parámetros de vitamina D podrían llevar a costos sustanciales para el sistema de salud. Los valores anormales llevan a repetir las pruebas. No existen datos que sugieran qué tan efectivo o útil es la monitorización repetida de los valores anormales. Ni cuál es el intervalo aceptable de monitorización que deba informar la atención. Las pruebas de laboratorio para el fosfato y el calcio son relativamente baratas, pero el tratamiento y el monitoreo continuado pueden ser costosos. En la actualidad, las recomendaciones sobre la frecuencia de las pruebas puede ser problemática para la práctica clínica.
Áreas de controversia, confusión o no consenso.
La interrelación de calcio, fosfato, y PTH, y el impacto potencial de estos metabolitos minerales y la calcificación extraesquelética siguen siendo un área de investigación y debate entre los médicos clínicos. La investigación más reciente sobre el rol del FGF-23, una molécula importante en el fosfato, PTH, y la homeostasis de la vitamina D. Han llevado a que muchos cuestionen el anterior punto focal sobre los valores de la PTH que consideran fueran de lugar. Quedan por responder las preguntas acerca de si las terapias de vitamina D son tóxicas en algunos o en todos los pacientes, y qué valores del fosfato son patológicos.
6.3.1.3. Ajustes para la implementación en el contexto colombiano
El grupo de trabajo para la adopción de la guía no realizó ajustes a la recomendación para su implementación en el contexto colombiano.
6.3.1.4. Brechas en la investigación
El GDG de la guía KDIGO no redactó recomendaciones de investigación sobre evaluación de enfermedad metabólica ósea en ERC. El grupo de trabajo para la adopción de la guía tampoco identificó brechas de investigación relacionadas con este tema.
6.3.2. Evaluación de densidad mineral ósea
38. No se sugiere realizar pruebas de densidad mineral ósea de manera rutinaria en aquellos con tasa de filtración glomerular estimada inferior a 45 ml/min/1,73 m2 (Categorías TFG: G3b a G5). Ya que la información puede ser confusa o inútil.
(Recomendación débil a favor, calidad de la evidencia baja)
6.3.2.1. Resumen de la evidencia
La masa ósea disminuida y los cambios en la microarquitectura ósea ocurren muy pronto en la ERC y empeoran con la progresión de la enfermedad de modo que los pacientes con ERC están en mayor riesgo de fractura ósea(325).
La fortaleza ósea se determina por la densidad y calidad del hueso. La absorciometría de rayos X con doble energía (DXA) mide la densidad del hueso pero no puede determinar la calidad del mismo (microarquitectura cortical y trabecular).
Los estudios que utilizan tomografía computarizada cuantitativa periférica de alta resolución (HR-pQCT). Demuestran anomalías en la microarquitectura cortical y trabecular de los pacientes con ERC temprana en comparación con pacientes sanos de control(326).
Aunque las anomalías de la DXA y de la HR-pQCT se asocian a fracturas en pacientes con ERC. El análisis de la curva característica receptor-operador sugiere que ninguna de las dos técnicas predice la fractura (área bajo la curva < 0,75), aunque esto mejoró para los pacientes con ERC de mayor duración(327).
En un estudio transversal, la combinación de estas dos técnicas de imágenes con marcadores de volumen óseo mejoró la predicción de fractura(328).
6.3.2.2. Razones para la recomendación
Mientras que no existe una apreciación en el sentido de que la densidad mineral ósea se mida en muchos ancianos. La intención de esta recomendación es resaltar para el clínico el hecho de que la información obtenida a partir de la densidad mineral ósea en aquellos con una TFG reducida pueda ser falsa. Llevando ya sea a un subtratamiento o sobretratamiento.
Aunque los índices de fracturas y mortalidad relacionada con las fracturas sean elevados en la ERC. La densitometría ósea no predice de manera confiable el riesgo de fractura en pacientes con una TFG < 45 ml/min/1,73 m2 y tampoco predice el tipo de osteodistrofia renal. Así, las mediciones de la densidad mineral ósea no proveen la información que se busca usualmente a partir de dichas pruebas que es usualmente la base de las intervenciones.
Implicaciones para la práctica clínica y política pública.
Un gran componente del riesgo de fractura está relacionado con el riesgo de caídas. Así que la reducción en el riesgo de caídas puede lograrse estableciendo programas para su prevención.
Dichos programas incluyen la revisión de la medicación, la prevención de hipotensión postural; el ritmo cardíaco. Donde sea apropiado; la evaluación de peligros en el hogar y modificaciones. El fortalecimiento y el reentrenamiento de los músculos; y el tratamiento de la deficiencia de vitamina D.
Áreas de controversia, confusión y no consenso.
La combinación de mediciones del grosor óseo, la densidad mineral ósea del cuello femoral, y una historia de fractura pueden ser útiles para identificar pacientes con ERC que podrían beneficiarse de estrategias para la prevención de fracturas. Se requieren estudios prospectivos para evaluar la utilidad de estos parámetros para la predicción de fracturas en la población con ERC.
Las alteraciones del calcio, fosfato, vitamina D y PTH se desarrollan pronto durante el curso de la ERC y están asociados a resultados adversos. Los estudios de estos y otros marcadores de metabolismo mineral óseo han mejorado el conocimiento acerca de los mecanismos de la enfermedad que gobiernan los resultados adversos de la ERC relacionada con enfermedad metabólica ósea. Pero los estudios clínicos aún tienen que indicar si la manipulación de estos marcadores mejora o no los resultados a nivel del paciente.
Al hacer las recomendaciones para los objetivos terapéuticos de las anomalías minerales metabólicas. KDIGO ha sido cuidadoso en no ir más allá de la evidencia.
6.3.2.3. Ajustes para la implementación en el contexto colombiano
El grupo de trabajo para la adopción de la guía no realizó ajustes a la recomendación para su implementación en el contexto colombiano.
6.3.2.4. Brechas en la investigación
El GDG de la guía KDIGO no redactó recomendaciones de investigación sobre evaluación de densidad mineral ósea en ERC. El grupo de trabajo para la adopción de la guía tampoco identificó brechas de investigación relacionadas con este tema.
6.3.3. Manejo de niveles de fosfato sérico y hormona paratiroidea.
39. En personas con una tasa de filtración glomerular inferior a 45 ml/min/1,73 m2 (Categorías TFG: G3b a G5). Se sugiere mantener las concentraciones de fosfato sérico en el rango normal de acuerdo con los valores locales de referencia de laboratorio.
(Recomendación débil a favor, calidad de la evidencia baja)
40. No se conoce el nivel óptimo de hormona paratiroidea en personas con una tasa de filtración glomerular inferior a 45 ml/min/1,73 m2 (Categorías TFG: G3b a G5). Se sugiere que las personas con niveles de hormona paratiroidea intacta por encima del límite superior de la prueba se evalúen en primer lugar para hiperfosfatemia, hipocalcemia y deficiencia de vitamina D.
(Recomendación débil a favor, calidad de la evidencia baja)
6.3.3.1. Resumen de la evidencia
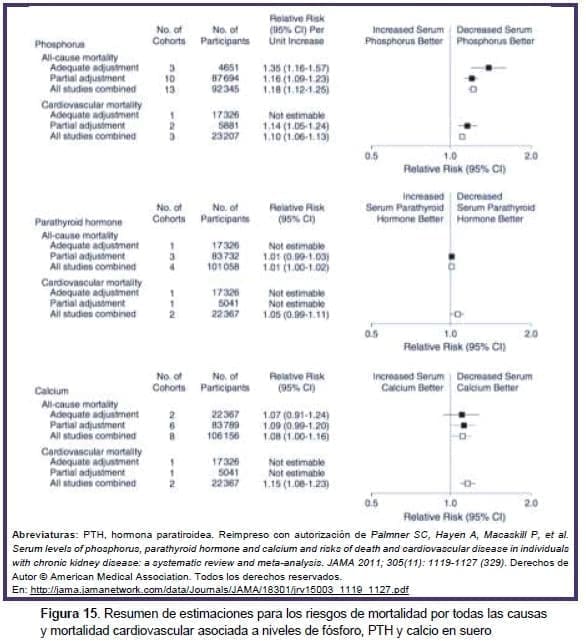
Una revisión sistemática de las concentraciones séricas de calcio, fosfato y PTH y el riesgo de muerte y CVD en personas con ERC mostró que el riesgo de muerte aumentaba 18 % por cada incremento de 1 mg/dl (0.33 mmol/l) en la concentración de fosfato sérico (RR 1,18; IC 95 %, 1,12-1,25)(329).
No se vio asociación alguna de la PTH o del calcio sérico con la mortalidad por todas las causas (Figura 15). De los 327 644 sujetos incluidos en la revisión, solamente 16 247 no recibieron diálisis. Y de ellos solamente 8990 personas con una TFG < 60 ml/min/1,73 m2 no recibieron terapia de reemplazo renal.
En estos sujetos, el riesgo de mortalidad por todas las causas por cada incremento de 1 mg/dl (0,33 mmol/l) en la concentración de fosfato sérico fue muy similar (RR 1,290; IC 95%, 1,12-1,48).
Así como con los sujetos incluidos no había evidencia de una asociación entre la concentración de calcio sérico y la mortalidad por todas las causas en personas con ERC que no recibían terapia de reemplazo renal (RR 1,02; IC 95%, 0,81-1,29). Los datos para las asociaciones de calcio, fosfatos y PTH con la muerte cardiovascular estuvieron disponibles solamente en uno de los estudios incluidos.
En el estudio Multi-Ethnic Study of Atherosclerosis (MESA):
Las asociaciones de las concentraciones de fosfato sérico con la calcificación vascular y valvular se examinaron en 439 personas con una TFG < 60 ml/min/ 1,73 m2. Cada incremento de 1 mg/dl (0,33 mmol/l) en la concentración de fosfato sérico se asoció a una mayor prevalencia del 21% (P = 0,002), 33 % (P = 0,001), 25 % (P = 0-16), y 62 % (P = 0.007) de calcificación de la arteria coronaria, torácica, válvula aórtica, y válvula mitral, respectivamente(330). La fortaleza de las asociaciones no difirió por edad, raza o diabetes. El ajuste para las concentraciones séricas de PTH y 1,25(OH)2D no alteró la fortaleza de las asociaciones.
Los factores que afectan la absorción gastrointestinal del fosfato incluyen 1,25(OH)2D, contenido de alimentos, biodisponibilidad de fosfato, y aglutinantes del fosfato (naturales y recetados).
Las fuentes del fosfato dietético son alimentos ricos en proteínas, incluyendo productos lácteos, carne y pescado, así como legumbres, nueces, chocolates y aditivos inorgánicos de fosfato tales como aquellos que se encuentran en las bebidas carbonatadas.
En una dieta occidental no vegetariana, cerca de la mitad del consumo dietético de fosfato proviene de la proteína animal.
Aunque el contenido del fosfato derivado de las plantas es más alto que aquél derivado de los animales, su biodisponibilidad en términos de absorción gastrointestinal es más bajo(331).
Los aditivos de fosfato inorgánico tienen la biodisponibilidad más alta. Un número de estudios clínicos detallan el beneficio del fosfato dietético y del control de proteínas en términos de hiperparatiroidismo secundario y progresión de la ERC en personas con una ERC moderada(332).
Pocos estudios han evaluado el impacto de la restricción del fosfato dietético en la enfermedad ósea o la calcificación vascular, y solamente uno ha abordado la supervivencia. En personas en hemodiálisis, un análisis post hoc sugirió que el fosfato dietético prescrito con más rigurosidad estaba asociado a índices más pobres de estatus nutricional y a una mayor necesidad de suplementos nutricionales(333).
Hubo una tendencia gradual hacia mayor supervivencia con una prescripción más liberal de fosfato. Que alcanzó significación estadística entre sujetos a los que se les prescribieron de 1001 a 2000 mg/d y aquellos que no tenían una restricción específica del fosfato. Lo que llevó al surgimiento de preguntas acerca de desnutrición energético-proteínica con la restricción del fosfato dietético. Por lo tanto, el medio utilizado para lograr la restricción del fosfato puede ser importante.
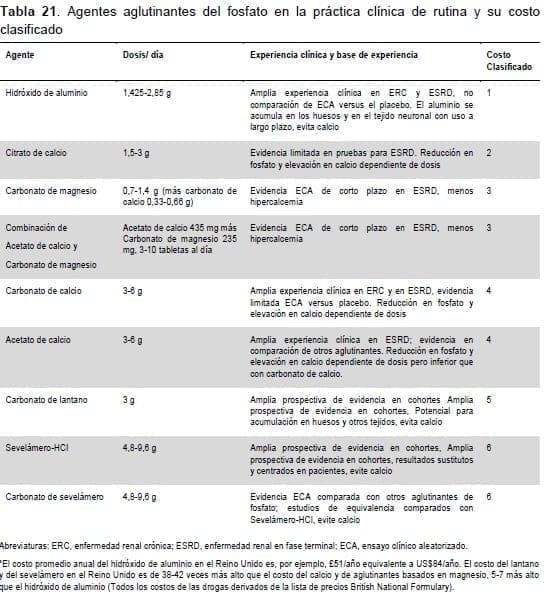
La Tabla 21 detalla las comparaciones de costo relativo de los aglutinantes del fosfato que se utilizan a nivel clínico en la actualidad para los cuales existen datos observacionales o de pruebas de estudio que demuestran su eficacia.
No están disponibles los datos relacionados con los resultados a nivel de los pacientes (tales como la mortalidad). Existe un número de agentes disponibles para aglutinar el fosfato que se enumeran en la tabla en orden de costo relativo.
Un metanálisis de Navaneethan et al. consideró 60 ensayos clínicos aleatorizados o estudios cuasi experimentales (7631 participantes) que evaluaron los efectos de diferentes aglutinantes del fosfato en adultos con ERC(334). Los autores concluyeron que todos los aglutinantes del fosfato reducían las concentraciones del fosfato sérico en comparación con el placebo. Pero los datos a la fecha no sustentan la superioridad de los nuevos agentes aglutinantes que no son de calcio. Para resultados a nivel de pacientes tales como la mortalidad por todas las causas y los resultados cardiovasculares en la ERC.
6.3.3.2. Razones para la recomendación
Más altas concentraciones de fosfato sérico están asociadas con mortalidad y los datos experimentales sugieren que la concentración de fosfato sérico está directamente relacionada con la enfermedad ósea, la calcificación vascular y la CVD.
Las concentraciones de fosfato sérico, calcio y PTH están todas interrelacionadas en los pacientes con ERC. Hacen falta estudios aleatorizados que relacionen la modificación manipulación de estos parámetros y los resultados clínicos, pero la revisión sistemática indica que el control del fosfato más temprano puede ayudar a reducir las consecuencias clínicas iniciales de la ERC realacionada con la enfermedad metabólica ósea.
De manera similar, no hay evidencia suficiente en el sentido de que algún aglutinante impacte de manera significativa los resultados a nivel de los pacientes.
Implicaciones para la práctica clínica y para la política pública.
Los datos existentes sustentan la prevención de la hiperfosfatemia y del hiperparatiroidismo secundario en la ERC. En ausencia de hipercalcemia, no hay indicación para recetar aglutinantes de fosfato que son menos costo-efectivos que los agentes basados en calcio.
Los datos actuales son insuficientes para hacer recomendaciones acerca de metas de niveles de calcio en sangre o de concentraciones de PTH que deben lograrse con el fin de reducir la mortalidad o la morbidez cardiovascular en personas con ERC que no requieren diálisis.
La variabilidad del ensayo de PTH y de la vitamina D sigue siendo problemática y este asunto supera el alcance de este documento. Se recomienda al médico y a los administradores que aprecien este problema en el desarrollo de metas para la atención o umbrales para el tratamiento.
Áreas de controversia, confusión no consenso.
Con respecto a los anteriores comentarios, los datos para sustentar los niveles de valores en laboratorio para la intervenciones, tipos de intervenciones, y valores objetivo sieguen siendo problemáticos. Por lo tanto, las recomendaciones para la terapia siguen siendo igualmente problemáticas y la práctica varía dependiendo de la localización y disponibilidad de los recursos.
La probable correlación de síntomas con valores en sangre y el abordaje de las anomalías en laboratorio en ese contexto es un enfoque pragmático en la actualidad. Se solicita al no especialista que busque asesoría de expertos locales en busca de la mejor opinión para individuos específicos.
6.3.3.3. Ajustes para la implementación en el contexto colombiano
El grupo de trabajo para la adopción de la guía no consideró que se requirieran ajustes a las recomendaciones para su implementación en el contexto colombiano.
6.3.3.4. Brechas en la investigación
El GDG de la guía KDIGO considera que se necesitan ensayos clínicos que comparen las estrategias tales como el reemplazo de la vitamina D, la restricción del fosfato dietético, los aglutinantes del fosfato, comparados entre ellos o contra placebo para abordar los desenlaces a nivel del paciente tales como la mortalidad y la morbilidad cardiovascular en personas con ERC.
6.3.4. Suplementación de vitamina D y bifosfonatos en personas con ERC
41. No se sugiere prescribir de manera rutinaria suplementos de vitamina D o análogos de vitamina D, en ausencia de deficiencia sospechada o documentada, para suprimir concentraciones elevadas de hormona paratiroidea en personas con enfermedad renal crónica que no están en diálisis.
(Recomendación débil en contra, calidad de la evidencia moderada)
42. No se sugiere prescribir tratamiento con bifosfonatos en personas con una tasa de filtración glomerular inferior a 30 ml/min/1,73 m2 (Categorías TFG: G4 a G5) sin una fundamentación clínica sólida.
(Recomendación débil en contra, calidad de la evidencia moderada)
(Lea También: Acidosis en Guía para Tratamiento de la Enfermedad Renal Crónica)
6.3.4.1. Resumen de la evidencia
Existe una cantidad sustancial de datos para sustentar la deficiencia de 25(OH)D en la población general y en las poblaciones con ERC(319, 335) que es probablemente multifactorial. Además de la deficiencia de 25(OH)D, se ha notado que existe un incremento progresivo en la prevalencia de la deficiencia de 1,25(OH)2D con menor categoría de TFG, que ocurre antes de la deficiencia de 25(OH)D (Figura 16).
No se evidenció ninguna relación entre los niveles de 25(OH)D y 1,25(OH)2D, pero había una asociación fuerte entre la deficiencia de 1,25(OH)2D y la concentración de PTH. Es importante mencionar que una ACR en orina más alta se asoció a niveles más bajos de 1,25(OH)2D en valores TFG de < 60 ml/min/1,73 m2 .

La importancia potencial de estas deficiencias se ha ilustrado en un número de estudios que examinan la relación entre los niveles bajos de 25(OH)D y 1,25(OH)2D y la mortalidad por todas las causas y cardiovascular en diferentes cohortes(335, 336).
A pesar de las asociaciones con la mortalidad, la revisión sistemática de los datos publicados a la fecha que evalúa los suplementos de vitamina D en pacientes con ERC, que no están en diálisis, ha mostrado solamente una mejoría en los desenlaces bioquímicos.
Una serie de publicaciones(337, 338) han intentado resumir la eficacia de la terapia con vitamina D sobre los desenlaces bioquímicos, óseos, cardiovasculares y la mortalidad en personas con ERC que no requieren diálisis.
No se encontró alguna formulación, ruta o esquema de vitamina D compuesta que altere el riesgo de mortalidad o la necesidad de diálisis aunque la vitamina D compuesta disminuyó de manera significativa las concentraciones de PTH en sangre. Ninguno de los estudios evaluó los resultados reportados en relación con la CVD, la enfermedad ósea, o la mortalidad.
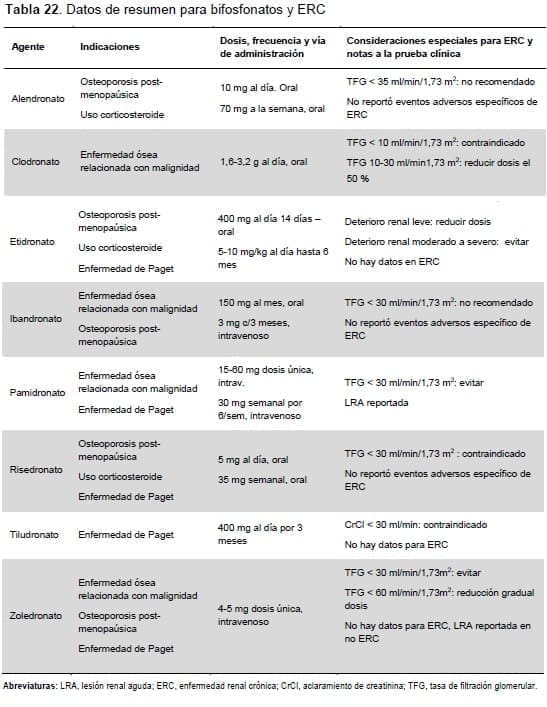
Los bifosfonatos incrementan la densidad mineral ósea, reducen la pérdida ósea y reducen el riesgo de fracturas por fragilidad. La biodisponibilidad de las formulaciones intravenosas de bifosfonatos es del 100 % pero la biodisponibilidad de la formulación oral es apenas del 1-5 %. Cerca del 50-80 % del bifosfonato disponible es tomado por el hueso y el 20-50 % restante se excreta en la orina sin haberse metabolizado.
Aunque los bifosfonatos orales no han mostrado que afectan la función renal de manera adversa en personas con una TFG tan baja como de 15 ml/min/1,73 m2 , en el análisis post hoc de datos clínicos de pruebas no se ha validado evaluado bien su seguridad y eficacia en TFG inferiores a 30 ml/min/1,73 m2 y los bifosfonatos intravenosos se han visto implicados en nefrotoxicidad, especialmente cuando se inyectan rápidamente (Tabla 24)(318, 339, 340).
Así, desde la perspectiva de la seguridad del paciente, la recomendación sirve para limitar la exposición a este tipo de agentes en aquellas personas con de aquellos con función renal anormal.
6.3.4.2. Razones para la recomendación
Estas recomendaciones tienen la intención de resaltar la falta de datos robustos para sustentar ya sea la medición o el tratamiento de la deficiencia de vitamina D en poblaciones con ERC que no estén en diálisis. Por lo anterior la recomendación le pide al clínico que evalúe la situación individual más a fondo. La definición internacionalmente aceptada de deficiencia de vitamina D es una concentración en sangre de < 20 ng/ml (< 50 nmol/l).
Los niveles bajos de 25(OH)D son comunes en pacientes con ERC no dependiente de diálisis; las concentraciones de < 15 ng/ml (< 37 nmol/l) ocurren en por lo menos 12-15 % de los pacientes con ERC y son más prevalentes en niveles más bajos de la TFG, en individuos institucionalizados, en extremos etarios, y en ciertos grupos raciales.
La deficiencia de 25(OH)D incrementa el riesgo de fractura y está asociado a una mayor mortalidad. A medida que la ERC evoluciona, los niveles de 1,25(OH)2D caen progresivamente y están estrechamente asociados a concentraciones mayores de PTH.
En personas con deficiencia de vitamina D, la suplementación con vitamina D incrementa la enfermedad mineral ósea y la fortaleza muscular, reduce los riesgos de fractura y caídas, y reduce la PTH. En ausencia de deficiencia, el tratamiento con vitamina D y compuestos relacionados no ha mostrado mejorar ni la mortalidad ni los resultados cardiovasculares.
El balance riesgo-beneficio de los bifosfonatos no se ha estudiado bien en las poblaciones con ERC. Las indicaciones para la terapia con bifosfonatos incluyen osteoporosis, terapia con corticosteroides, enfermedad maligna y enfermedad de Paget.
En personas con ERC y categorías TFG > 60 ml/min/1,73 m2 con osteoporosis y/o riesgo alto de fracturas, y en personas con una TFG entre 30-60 ml/min/1,73 m2 con PTH normal, la osteoporosis y/o alto riesgo de fractura, el tratamiento debe ser el mismo que para la población general (aunque la modificación de la dosis puede ser necesaria, ver Tabla 22).
En personas con ERC en categorías más bajas de la TFG (< 30 ml/min/1,73 m2 ), el diagnóstico correcto de osteoporosis se hace más complejo y otras formas de osteodistrofia renal requieren estrategias alternativas de tratamiento diferentes a la de la osteoporosis, deben excluirse antes de considerar el tratamiento con bifosfonatos.
Y en personas con enfermedad ósea renal adinámica, con mayor probabilidad en categorías TFG más bajas, falta evidencia sobre beneficio o daño de los bifosfonatos en la fortaleza ósea o en la calcificación vascular.
Implicaciones para la práctica clínica y la política pública.
Los suplementos de vitamina D mejoran los desenlaces bioquímicos de forma similar a los análogos de la vitamina D activa, con una carga menor de costos y efectos secundarios.
La medición de la 25(OH)D es costosa y en la población con ERC y con deficiencia de vitamina D, la reposición de la vitamina D simple es la intervenció indicada hasta que haya nueva evidencia. Excepto para fines educativos o investigativos, no es necesario medir los niveles de vitamina D en la práctica general.
Dado el uso difundido de los bifosfonatos en los países desarrollados, especialmente en mujeres mayores que también tienen probabilidad de tener algún tipo de disfunción renal, la cesación de los bifosfonatos en ese grupo puede ser problemática. Es necesario monitorear la práctica clínica y entender las implicaciones de esta recomendación para poblaciones grandes que pueden estar beneficiándose o no de estos agentes.
Áreas de controversia, confusión o no consenso.
Queda por determinar la dosis y la formulación apropiada de vitamina D, el rango objetivo del tratamiento, la frecuencia, vía de administración y la seguridad en diferentes niveles de gravedad de la ERC.
A pesar de estas preocupaciones, los datos de la atención primaria en los EEUU sugieren que la prescripción de bifosfonatos es común en las personas con ERC.
Incluso en el subgrupo de personas con una TFG < 30 ml/min/1,73 m2 ; el uso de los bifosfonatos fue similar al de la población sin ERC(341). Las personas con ERC en este estudio tuvieron siete veces más de probabilidad de recibir un bifosfonato que vitamina D activa.
Se demostró incertidumbre similar acerca de la eficacia y seguridad de dicho tratamiento para personas con ERC en un estudio de personas bajo el cuidado de una unidad renal del Reino Unido(342).
La mitad de todas las personas a quienes se les recetaron bifosfonatos tenían una TFG < 30 ml/min/1,73 m2 y, sin embargo, al 50 % de las personas con una TFG más alta y osteoporosis documentada no se les recetaron bifosfonatos.
6.3.4.3. Ajustes para la implementación en el contexto colombiano
El grupo de trabajo para la adopción de la guía no consideró que se requirieran ajustes a las recomendaciones para su implementación en el contexto colombiano.
6.3.4.4. Brechas en la investigación
El GDG de la guía KDIGO considera que se requieren estudios adicionales para dilucidar si los bifosfonatos, a través de la reducción de la pérdida ósea en personas con estados pre-existentes bajos de pérdida ósea, se verían beneficiados o no con respecto a la calcificación ósea y vascular.