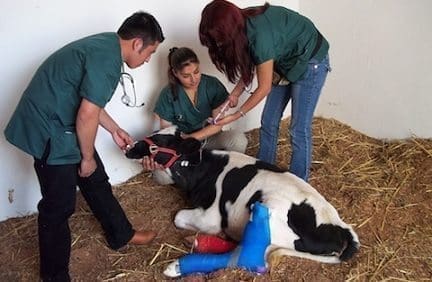
De cada uno de los bovinos y con un intervalo de 15 días durante 5 meses fueron conectadas muestras de líquido esofagofaríngeo de cada uno de los bovinos. Para ello, a los bovinos se les suspendió el consumo de alimento 18 horas antes de la toma de la muestra, se introdujo por la boca de cada bovino un recolector de probang del tamaño adecuado a la talla de cada individuo y se realizó un raspado al individuo y se realizó un raspado al nivel de la porción anterior del esófago. Cada muestra fue depositada en un tubo de vidrio con Earle, fue congelada y mantenida a -70º C hasta su procesamiento. (5, 15).
Técnica de inmunodifución en gel agar
Se realizó esta prueba con fin de determinar el momento de aparición en suero de los anticuerpos contra el antígeno VIA. Para ello, se prepararon cajas de Petri colocando 16 ml de agar noble el cual una vez solidificado se perforó formando ocho rosetas cada una con un pozo central y 6 alrededor (1,2).
En cada uno de los pozos centrales se colocaron 25 ml del antígeno VIA a la dilución de uso previamente preparado en el laboratorio de enfermedades vesiculares, en los pozos superiores e inferior se colocaron en cada uno, 25 ml del suero control positivo y en los pozos restantes los sueros correspondientes a cada día experimental. Una vez realizado en montaje, las cajas se incubaron en cámara húmeda durante 48 horas, tiempo al cabo del cual se leyó la reacción por la presencia o ausencia de una banda de precipitación entre el antígeno y cada suero.
Técnica de probang
Se realizó con el fin de detectar portadores de la enfermedad. En el procesamiento de la prueba se utilizaron cultivos celulares de la línea BHK-21 clon 13 con 48 horas de crecimiento con 1 ml de inóculo por botella de cultivo celular. Luego de inoculados los cultivos fueron incubados a 37oC por 24 horas, y tras la observación al microscopio para evidenciar efecto citopático fueron congelados para posterior realización de la prueba de fijación del complemento. (3,9, 15)
Técnica de electroinmuntransferencia
Se realizó con el fin de detectar actividad viral. Para su realización se partió de tiras de nitrocelulosa con las proteínas 3ABC, 3D, 2C, 3B antígenos no estructurales del virus de la FA, las cuales fueron suministradas por el Centro Panamericano de Fiebre Aftosa (CPFA). Las cifras fueron incubados con solución de saturación durante 30 minutos a temperatura ambiente. Posteriormente se adicionaron los sueros y se incubaron con agitación constante durante 60 minutos, se adicionó el sustrato y luego de una incubación de 15 minutos, se lavaron, se les retiró el exceso de humedad y se leyó la reacción.
Resultados
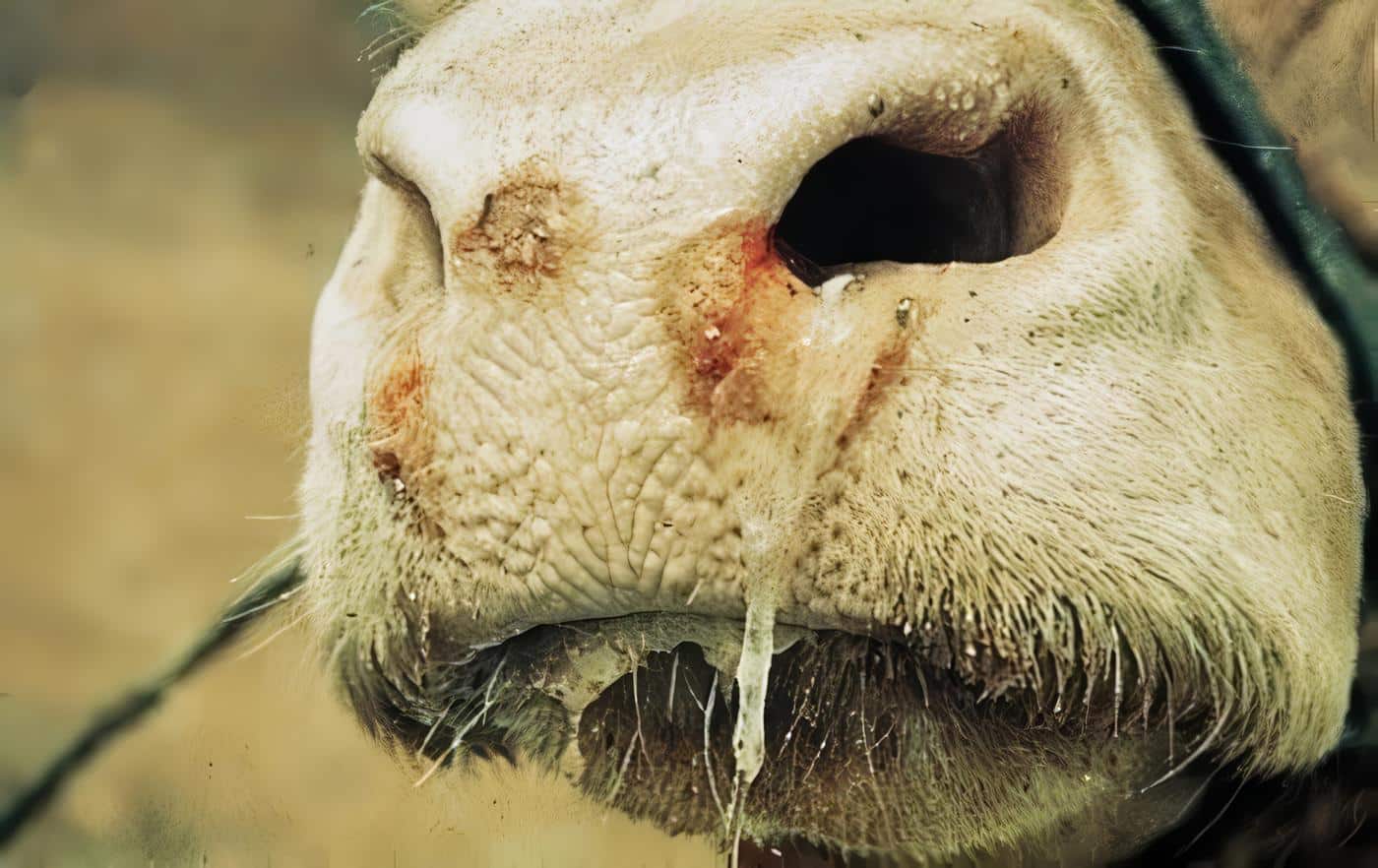
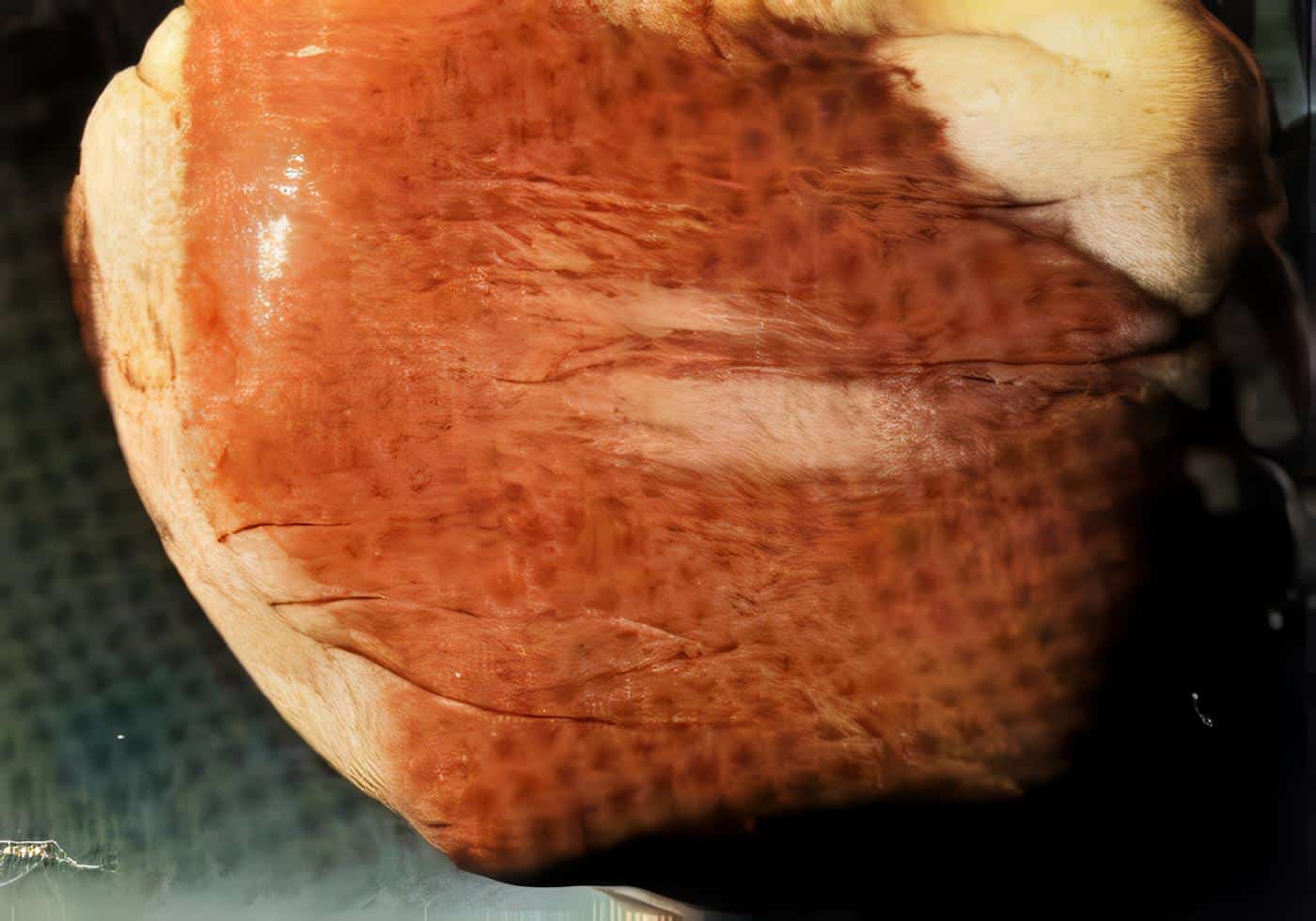
Los dos bovinos presentaron lesiones vesiculares en la cavidad oral a las 24 horas post – inoculación, e incremento de la temperatura corporal desde las 12 horas hasta 10 días luego de la descarga viral.
El ovino presentó fiebre al día 3 post – inoculación, inapetencia y una úlcera a nivel lingual. El día 4 presentó cojera y generalización de las lesiones en los 4 miembros. Al animal normalizó la temperatura a partir del día 12 post – inoculación y no presentó más sintomatología.
A partir de las muestras tomadas de las lesiones vesiculares de todos los animales fue posible obtener mediante la prueba de fijación del complemento el diagnóstico de Fiebre Aftosa tipo O.
Prueba de Inmunodifusión
Los resultados de las pruebas de Inmunodifusión fueron positivos desde el día 9 hasta el día 30 post – inoculación en los bovinos. En el ovino fue posible detectar Anticuerpos contra el antígenos vía desde el día 13 hasta el día 30 post – inoculación.
Prueba de probang
El aislamiento del virus a partir de muestras de líquido esofagofaringeo fue posible solo a partir de la muestra de uno de los bovinos tomada a 16 días post – inoculación.
| La adopción de estas técnicas es de importancia para evaluar la actividad del virus de la FA en el campo, para realizar vigilancia seroepidemiológica, reforzar la campaña de erradicación de la enfermedad para la evaluación de riesgo en la selección de animales que se van a movilizar hacia áreas libres |
EITB
La detección de anticuerpos contra las proteínas no estructurales del virus de la FA comenzó a partir del día 10 post – inoculación y se mantuvo para todas las proteínas hasta el día 32 post – inoculación en los dos bovinos (Figura 1). El ovino fue positivo a partir del día 8 y también se mantuvo hasta el día 30 (Figura 2).
 Figura 1. Respuesta de anticuerpos contra las proteínas no estructurales en dos
Figura 1. Respuesta de anticuerpos contra las proteínas no estructurales en dos
bovimos inoculados con el virus de la Fiebre Aftosa
 Figura 2. Respuesta de anticuerpos contra las proteínas no estructurales en un ovino
Figura 2. Respuesta de anticuerpos contra las proteínas no estructurales en un ovino
inoculado con el virus de la Fiebre Aftosa
Discusión
La obtención del diagnóstico de FA tipo O a partir de los epitelios de los bovinos y el ovino inoculado experimentalmente, sin anticuerpos contra el virus, evidencia la reproducción de la enfermedad.
La positividad de la prueba de ID post – inoculación del virus, evidencia replicación viral, además de ofrecer información importante sobre el tiempo en que se deben colectar las muestras de suero para la detección de anticuerpos contra el antígeno VIA, hallazgo de laboratorio indicativo de actividad viral de gran utilidad en campañas de erradicación.
Una de las limitaciones de los estudios seroepidemiológicos actuales para la detección de actividad viral en el campo es el hecho de que las pruebas tradicionales no identifican de manera definitiva anticuerpos indicadores de replicación viral.
El único aislamiento del virus a partir del LEF de uno solo de los bovinos, soporta que el virus puede persistir en la faringe de animales como consecuencia de infección. Sin embargo, para establecer el estado de portador sano en al diseminación de la enfermedad, es necesario trabajar con un número mayor de animales infectados naturalmente.
Con relación a la prueba de EITB fue de gran importancia establecer los tiempos mínimo requeridos para la detección de Anticuerpos contra las proteínas no estructurales del virus de la FA indicativos de infección. La adopción de estas técnicas es de importancia para evaluar actividad del virus de al FA en el campo, para realizar vigilancia seroepidemiológica, reforzar la campaña de erradicación de la enfermedad del país dentro de los lineamientos del plan hemisférico, erradicación de la enfermedad y para la evaluación de riesgos en la selección de animales que se van a movilizar haca áreas libres, animales de importación, y evaluación de biológicos.
Considerando los resultados de este trabajo se sugiere realizar este tipo de trabajos involucrando un mayor número de animales, incluir otras especies y adoptar técnicas más sensibles como la ELISA para la detección de Anticuerpos contra las proteínas no estructurales del virus de la FA utilizándola como prueba tamiz para una evaluación a nivel nacional del estado de la actividad viral en el campo.
Bibliografia
1. Alonso Fernández, A; Auge de Mello, P., Gómez, I, Rosemberg, F. El uso del antígeno asociado a la infección viral (VIA) en la detección de ganado expuesto al virus de la fiebre aftosa. Boletín del centro panamericano de fiebre aftosa 18: 17-22, 1975.
2. Alonso, A; Gómez, I, Bahnemann, H.G. La inducción de anticuerpos ant-via en bovinos vacunados y revacunados con vacuna inactiva antiaftosa,. Boletín del centro.
3. Auge de Melo, P., honigman, M.N., Fernández, M.V. Gómez. I. Further information on the survuval of modifiel foot-and-mouth disease virus in cattle. Bull. Off. In t. Epozoot., 73: 489-505, 1970.
4. Alonso A, Gómez, mpd Martins, M.A., et all. Detección of foot-and mouth disease virus infection – asociated antigen antibodies. Comparasion of the enzimed linked inmunoabsorbent assay and agar gel inmunodifusion test. Prev-vet. Med., 9, 233-240 1990.
5. Bachrat. H. L., Boletín del centro panamericano de fiebre aftosa # 7 julio – sep 1972 pp 1-41.
6. Bergmann, I E, Auge de mello, P, Neitzert, E; Berck, E; Gómez, I; Diagnosis of persistent apthovirus infection and its diferentation from vaccination responsein cattle by use of enzime linke inunoelectrotransfer blot analisis with bioenginered nonstructural viral antigens. Am, j vet.res 54, 825-831, 1993.
7. Bergmams, I.E: Malirat, V. Enfoques moleculares para el diagnóstico en laboratorio de la infección persistente con el virus de la fiebre aftosa. Revisión. Boletín del Centro Panamericano de Fiebre Aftosa, 54: 153-177, 1993.
8. Bergmann, I.E, Malirat, V; Auge de mello, P; Gómez I. Detección de secuencias genómicas de virus de la fiebre aftosa mediante hibridación de anticuerpos nucléicos: un enfoque para el diagnóstico de infección persistente. Bol. Centr. Panam. Fiebre Aftosa 59: 131-135. 1993.
9. Burrows, R. Studies on the carrier state of cattle exposed to foot-and-mouth disease virus, J. Hyg; 64: 81-90, 1966.
10. Cowan, K.M; Graves, J. H. A third antigenic component associated with FMD infection. Virology, 30: 528-540 1966.
11. Domingo, E; Mateu G; Martínez M: A: Dopazo, J, Moya, A; y sobrino, F. A genetic variabity and antigenic diversity of foot and mouth disease virus. Applied virology reseatch. Vol 2: 233 plenam publishing corp. N. Y. 1990.
12. Kitching, R. P. Knowless, N.J. Samuel, A: R y Donalson, A. I. Develoment of foot-and mouth disease birus strain characterizacion, a review. Trop. Anim, hith. Produc. 21: 153, 1989.
13. Lobo, C.A; Hanson, R.P. Gutiérrez, A, Beltrán. L.A. Serological detección of natural FMD infection in cattle and pig. Bull. Off int. Epiz. 85: 1075-1104. 1976.
14. Mc. Vicar, J.W. sutmeller, P. FMD: The agar gel difussion precipitation test for antibody to virus infection asociated (VIA) antigen a tool for epozootiologic surveys. A.M.J Epidemiol, 92: 273-278, 1970.
15. Orjuela, J.: Pineda, L.A; Quintero, M.; Sánchez, C.; y Valbuena, R.M.; Manual de técnicas de laboratorio de enfermedades vesiculares. Instituto Colombiano Agropecuario ICA P 1-79 julio de 1997.
16. Roedor, P.L. y Leblanc Smith, P: M: Deteccion and typing of fott and mouth disease virus by enzime linked inmunoabsorbent assay a sensitive rapid and reliable technique for primery diagnosis. Res. Vet Sci 45: 225, 1997.