Antimetabolitos y Drogas Citotóxicas
Patrones clínicos de reacción a los medicamentos de uso en la terapia reumatológica
Metotrexate
El metotrexate es un medicamento antagonista de la síntesis de folatos3, que interfiere con la enzima dihidrofolato reductasa que cataliza la reducción del dihidrofolato a tetrahidrofolato, el cual es un cofactor esencial en la síntesis de timidilato, y de esta manera bloquea la síntesis de DNA y particularmente la fase S del ciclo celular y de la reparación del DNA4. Es un medicamento de amplio uso en reumatología y otras especialidades. Su administración puede hacerse de forma oral o parenteral.
Las reacciones mucocutáneas más frecuentes son:
Estomatitis y úlceras mucosas2,5. La estomatitis puede variar desde eritema leve de la mucosa hasta ulceración de la mucosa con lesiones que recuerdan las aftas, de bordes muy bien definidos redondeadas y se localizan mas frecuentemente en la mucosa del labio o de la lengua (Figura 1). El mecanismo de producción de estas lesiones es por toxicidad directa del fármaco sobre las células de la mucosa oral, que presentan un alto recambio. Su aparición está en relación con la dosis del medicamento, y puede ser una indicación para suspender la terapia2. Se ha dicho que el uso de ácido folínico durante el tratamiento puede disminuir este efecto adverso5.
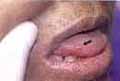
Figura 1. Ulcera de borde eritematoso en la mucosa lingual en un paciente con
Artritis reumatoide y en tratamiento con metotrexate. (Flecha).
La alopecia transitoria de tipo difuso es otro efecto adverso reportado con el medicamento6; en dosis altas, puede ocasionar efluvium anágeno. La alopecia usualmente es transitoria y mejora al suspender la medicación.
Reacciones fototóxicas han sido reportadas como otro efecto adverso del tratamiento con metotrexate pero usualmente a dosis altas6; de particular interés es el fenómeno de fotoreactivación, el cual consiste en la exposición solar inicial del paciente con o sin eritema solar, y posterior a la administración de metotrexate, se observa eritema severo con ampollamiento en las áreas expuestas al sol previamente.
Muchas otras manifestaciones de toxicidad han sido reportadas con este medicamento pero en mucha menor frecuencia, en orden alfabético ellas son: capilaritis, erupciones ampollosas, enfermedad de Peyronie, equimosis, eritema multiforme, eritrodermia, erosión de placas psoriáticas, exantemas, foliculitis, forunculosis, ginecomastia, herpes simple, necrólisis cutánea, onicólisis, paroniquia, prurito, pseudolinfoma, púrpura, quemadura de palmas y plantas, úlceras, urticaria y vasculitis3. También se han descrito y hemos observado aparición de nódulos subcutáneos en pacientes en tratamiento con metotrexate, algunas veces al inicio, probablemente por efecto idiosincrático, y en la mayoría después de varios meses de recibirlo. (Figura 2)
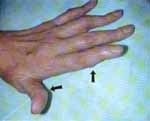
Figura 2. Nódulos en las manos de una paciente con Artritis reumatoide,
secundario al uso de metotrexate por largo tiempo. (Flechas).
Ciclofosfamida
La ciclofosfamida es un agente alquilante derivado de la mostaza nitrogenada (mecloretamina)4 que ha sido usado ampliamente en el tratamiento del cáncer como agente antineoplásico e inmunosupresor en las enfermedades autoinmunes. La droga es más efectiva en las células que presentan una división rápida, y gran parte de su efecto inmunosupresor se debe a la inhibición de la replicación del DNA, es un inhibidor del ciclo celular, pero no específico de ninguna fase ya que puede destruir las células en cualquier fase del ciclo4.
La ciclofosfamida es una droga de metabolismo hepático, en donde se producen dos metabolitos activos, la mostaza fosforamida y la acroleína este último, responsable de la toxicidad en la vejiga.
El efecto mucocutáneo más frecuente es la alopecia de tipo difuso por effluvium anágeno4, el cual consiste en una detención abrupta de la actividad mitótica de las células de la matriz folicular con la consecuente falla en la producción de nuevos tallos pilosos7. Es un efecto dosis dependiente, pero puede presentarse con dosis bajas, se observa más frecuentemente cuando se alcanzan dosis acumuladas de 5 grs6. El pelo generalmente recrece cuando se suspende la terapia, pero el color y la textura pueden ser diferentes y en un porcentaje de pacientes la alopecia puede ser permanente4.
La estomatitis y las úlceras mucosas también pueden presentarse con este medicamento, pero no son tan frecuentes como con otros fármacos.
Se han descrito varios patrones de hiperpigmentación cutánea, incluyendo hiperpigmentación generalizada de la piel y mucosas, hiperpigmentación localizada en las uñas, palmas, plantas, o dientes6. La hiperpigmentación ungueal típicamente ocurre como bandas horizontales o transversas que aparecen en la base de la uña y crecen con ella durante un periodo de 6 meses en promedio. En el pelo se ha descrito cambio de coloración pasando de rojo claro a negro.
Se han descrito también reacciones urticarianas y anafilácticas al medicamento.
Otras reacciones descritas son la extravasación del medicamento en las infusiones IV, eritema acral, radiation recall, eritema multiforme, flushing, y la hidradenitis ecrina neutrofílica7.
Azatioprina
La azatioprina es un antimetabolito derivado de la 6 mercaptopurina que ha sido usado por más de 40 años en la prevención del rechazo del transplante de órganos4. Tiene 3 vías diferentes por las cuales se metaboliza, la primera involucra la producción de un metabolito inactivo por la enzima tiopurina metiltransferasa, que es la responsable de la mielosupresión severa en los casos con déficit congénito de la enzima, la segunda vía consiste en la transformación de la 6 mercaptopurina en ácido 6 tioúrico (metabolito inactivo) por la xantina oxidasa, y la enzima de la tercera vía es la hipoxantina guanina fosforribosil transferasa. Las células B son altamente sensibles a la azatioprina, mientras que las T lo son en mucha menor intensidad.
La azatioprina es considerada una droga de lenta acción y sus efectos pueden perdurar aún después de la suspensión del medicamento.
La azatioprina está asociada con muy pocas manifestaciones mucocutáneas, su toxicidad principal es de tipo hematológico y hepático, además de aumentar el riesgo de desarrollar linfomas. En los pacientes transplantados que han recibido azatioprina por largos periodos está aumentado el riesgo de desarrollar carcinomas escamocelulares en piel4.
Antimaláricos
Son medicamentos derivados de la quinina usados ampliamente en las enfermedades reumatológicas. Payne fue el primero en usar la quinina en el rash del lupus en 1894, posteriormente Davidson y Birt confirmaron respuestas favorables en 19388.
Los agentes más usados en la actualidad son la cloroquina y la hidroxicloroquina. La cloroquina es una 4 aminoquinolina y ha sido la más asociada con manifestaciones cutáneas dada su alta afinidad por la melanina, fenómeno explicado por su carga negativa que produce atracción por la melanina cargada positivamente; este mismo evento es el responsable del depósito del medicamento en el epitelio pigmentado de la retina.
La unión de la cloroquina a la melanina ocasiona una decoloración negro azulosa de la piel, el pelo y las uñas (Figuras 3 y 4). Entre un 10-25% de pacientes que reciben antimaláricos a largo plazo desarrollan pigmentación en la cara, paladar duro, cuello, miembros inferiores especialmente en la cara anterior de las piernas y miembros superiores8. La pigmentación en la piel puede oscurecerse con la exposición a la luz ultravioleta. La pigmentación usualmente resuelve al suspender el tratamiento. Paradójicamente pueden inducir blanqueamiento de los pelos del cuero cabelludo y de la cara.
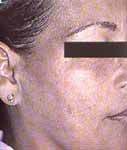
Figura 3. Pigmentación macular difusa en la cara, de color grisáceo
en una paciente con síndrome de Sjögren primario y tratamiento con cloroquina por un año.

Figura 4. Pigmentación de la uña por uso de cloroquina en una paciente con AR.
Cerca de un 3% de pacientes que reciben antimaláricos tienen que descontinuar el tratamiento por reacciones adversas cutáneas8, las más frecuentemente descritas son: prurito, eritrodermia, alopecia, fotosensibilidad, erupciones liquenoides; otras manifestaciones menos frecuentemente descritas son la anhidrosis, la atrofia cutánea, los cambios ungueales.
Los antimaláricos pueden exacerbar dermatosis preexistentes, clásicamente empeoran la psoriasis8 y pueden llevar a eritrodermia psoriática. Sin embargo una de las asociaciones mejor conocidas con los antimaláricos es la reacción liquenoide desencadenada por quinacrina.
Sulfasalazina
Las sulfas son medicamentos de gran utilidad en las enfermedades inflamatorias, todas comparten una estructura química similar en la cual hay un átomo de azufre unido a dos átomos de carbono9. La sulfasalazina es una prodroga que al ingresar al organismo es clivada en sulfapiridina (80%) y ácido 5 aminosalicílico. Las sulfas son metabolizadas en el hígado por acetilación, (existen acetiladores rápidos y lentos determinados genéticamente, estos últimos con mayor probabilidad de presentar efectos adversos), o por hidroxilación, mecanismo responsable de la producción de metabolitos que inducen metahemoglobinemia, hemólisis, y agranulocitosis9. Luego de estos pasos sufren glucoronización y son excretadas por la orina en su mayor parte.
La sulfasalazina es el cuarto medicamento más utilizado en artritis reumatoidea después de los AINES, metotrexate y corticoides10 con una frecuencia de uso del 5%.
Las reacciones cutáneas más frecuentemente observadas durante el tratamiento con sulfas son las erupciones morbiliformes, el eritema nodoso, el eritema multiforme, la dermatitis exfoliativa, la necrolísis epidérmica tóxica, y la coloración azulada ocasionada por la metahemoglobinemia11.
El rash cutáneo probablemente de tipo morbiliforme es la reacción más frecuentemente asociada con la sulfasalazina. Existen varios reportes en la literatura de urticaria ocasionada por sulfasalazina, que ha sido manejada satisfactoriamente con terapia de desensibilización permitiendo, nuevamente, la reintroducción del medicamento12. En casos severos la urticaria ha progresado hacia angioedema generalizado.
Penicilamina
La penicilamina es un medicamento útil en esclerodermia y artritis reumatoidea asociado con una amplia gama de efectos adversos13, gran parte de los cuales son de tipo mucocutáneo. El mecanismo de acción responsable de la mejoría clínica en los casos de esclerodermia y de algunos efectos adversos está relacionado con la interferencia en la formación de los enlaces cruzados entre las moléculas de tropocolágeno y su clivaje cuando se han formado.
El efecto adverso cutáneo más frecuente es la aparición de rash en forma temprana13 y prurito alérgico en un 5% de los casos. El rash de inicio temprano característicamente se inicia en la 2ª o 3ª semana de tratamiento y es de tipo macular; puede asociarse a fiebre medicamentosa y a úlceras orales similares a aftas que mejoran con la disminución de la dosis, y en algunos casos pueden impedir el aumento en estas o aún inducir la suspensión del tratamiento. Otros hallazgos mucosos que pueden presentarse en forma menos frecuente son las gingivoestomatitis, la glositis, y la queilitis.
Se han descrito varias formas de pénfigo inducido por penicilamina (vulgar y foliáceo) y junto con el captopril es la causa más frecuente de esta reacción. Es una complicación generalmente tardía de la terapia, y cuando se sospecha este efecto adverso debe suspenderse el tratamiento y manejarse el cuadro con esteroides sistémicos, con duraciones variables de semanas a meses.
Otros efectos adversos potenciales con la penicilamina son la aparición de lupus-like, con pocos hallazgos cutáneos. La urticaria, dermatitis exfoliativa, caída del cabello, liquen plano, dermatomiositis, elastosis perforans serpenginosa, necrolísis epidérmica tóxica y anetodermia.
Por sus efectos sobre el colágeno la droga puede causar:
Incremento de la fragilidad de la piel, especialmente en las áreas de mayor trauma o presión como son los codos, rodillas, hombros, pies y nalgas, púrpura equimótica (este efecto no indica suspensión de la terapia) y excesivo arrugamiento de la piel. Se sugiere disminuir la dosis del medicamento cuando el paciente se va a llevar a una cirugía y retornar a la dosis inicial una vez haya cicatrizado la herida.
Sales de oro
Las sales de oro son un tratamiento bien establecido para el tratamiento de varias enfermedades reumatológicas, principalmente la artritis reumatoidea14. Su uso terapéutico sin embargo ha sido limitado por la alta incidencia de efectos adversos, especialmente de tipo dermatológico y la aparición de reacciones cutáneas es la causa más frecuente por la cual se debe suspender el tratamiento con sales de oro14. La patogenia de estos efectos no es bien comprendida y se cree que es de tipo alérgico. Recientemente se ha postulado que un porcentaje de casos con reacciones liquenoides a las sales de oro han sido ocasionadas por la contaminación usual del medicamento con níquel14. Un riesgo más elevado de presentar reacciones adversas al oro lo presentan los pacientes con HLA B35, D32 y DR3.
Se ha dicho que la toxicidad cutánea es responsable del 60% de los efectos adversos del medicamento. Las 2 formas clínicas más frecuentes de toxicidad en piel son las dermatitis inespecíficas y las reacciones liquenoides
En un estudio realizado en Francia en el cual se evaluaron pacientes con reacciones cutáneas al oro, el tiempo transcurrido entre el inicio de la terapia y las manifestaciones cutáneas varió entre 2 semanas y 8 meses15, 3 pacientes presentaron reacciones liquenoides, 2 pacientes pitiriasis rosada like con eosinofilia en 1 de los casos, 2 pacientes dermatitis eczematoides y 1 caso urticaria15.
Antinflamatorios no esteroideos (AINES)
En un estudio realizado en España en 1991 los antinflamatorios no esteroideos fueron el tercer grupo de medicamentos mas formulados por los médicos16. De 18.348 reportes de efectos adversos relacionados con medicamentos, el 8.8% implicaron un antinflamatorio no esteroideo como el causante de la reacción, las manifestaciones cutáneas fueron la segunda manifestación más frecuente (20% de los casos) de toxicidad por AINES, luego de los efectos gastrointestinales (39%). Los medicamentos más implicados fueron el diclofenaco, el piroxicam, la indometacina, el naproxen y el ketoprofen16.
Se ha dicho que los pacientes atópicos tienen mayor probabilidad de presentar reacciones alérgicas a estos medicamentos, teoría que es controvertida por algunos otros autores.
Las reacciones cutáneas más frecuentemente ocasionadas por los AINES en orden de frecuencia son, urticaria y angioedema, erupciones fijas por drogas, eritema multiforme y síndrome de Steven Jhonson.
Casi cualquier patrón de reacción cutáneo es posible que sea causado por los AINES; sin embargo, algunos medicamentos están asociados más frecuentemente con algunos patrones específicos, así por ejemplo, la aspirina y la indometacina inducen más comúnmente reacciones urticarianas y angioedema, el piroxicam es el AINE con la mayor tasa de reacciones fototóxicas, las cuales usualmente son de tipo vesicoampolloso; el ketoprofen es el AINE con mayor probabilidad de ocasionar reacciones de contacto cuando se utiliza en forma tópica, la erupción fija por drogas frecuentemente asociada con ibuprofen y naproxen, episodios de vasculitis leucocitoclástica pueden ser inducidos por naproxen e ibuprofen.
Recientemente se ha estudiado si los nuevos AINES inhibidores de la COX-2:
Pueden ser administrados en forma segura a los pacientes con antecedentes de sensibilidad a los AINES clásicos. En un estudio realizado en Caracas Venezuela17 encontró que algunos AINES nuevos como el rofecoxib son relativamente seguros en pacientes con sensibilidad a los AINES clásicos tipo urticaria-angioedema con reacciones cruzadas en sólo el 3% de los casos; otros de los nuevos inhibidores selectivos de la COX 2 presentaron tasas de reacciones cruzadas mucho más altas como el celecoxib (33%), nimesulide (21%) y meloxicam (17%), los autores proponen que uno de los mecanismos por los cuales se median los efectos adversos de tipo urticaria-angioedema en los aines clásicos podría ser la inhibición de la COX-1.
Referencias
- 1. Crowson AN, Magro CM. Recent advances in the pathology of cutaneous drug eruptions. Dermatologic Clinics 1999; 17(3): 537-560.
- 2. Stem RS, Wintroub BU. Cutaneous reactions to drugs. En Fistzpatrick TB, Freedber IM, Eisen A, Austen KF, Goldsmith LA, Katz SI (eds): Dermatology in General Medicine, ed 5. New York, Mc Graw-Hill. 1998; 1: 1633-1642.
- 3. Goerttler E,. Kutzner H, Peter H, Requena L. Methotrexate-induced papular eruption in patients with rheumatic diseases: A distinctive adverse cutaneous reaction produced by methotrexate in patients with collagen vascular diseases. Journal of the American Academy of Dermatology 1999 May; 40(5).
- 4. Silvis NG. Antimetabolites and cytotoxic drugs. Dermatologic Clinics 2001 January; 19(1): 105-118.
5. Lebwohl M, Ali S. Treatment of psoriasis. Journal of the American Academy of Dermatology 2001 November; 45(5): 649-661. - 6. Fitzpatrick JE, Yokel BE, Hood AF. Mucocutaneous complications of antineoplastic therapy. En Fistzpatrick TB, Freedber IM, Eisen A, Austen KF, Goldsmith LA, Katz SI (eds): Dermatology in General Medicine, ed 5. New York, Mc Graw-Hill. 1998; 1: 1642-1653.
- 7. Susser WS, Whitaker-Worth DL, Grant-Kels JM. Mucocutaneous reactions to chemotherapy. Journal of the American Academy of Dermatology 1999 March; 40(3): 367-398.
- 8. Van Beek MJ, Piette W. Antimalarials. Dermatologic clinics 2001 Jan; 19(1): 147-160.
9. Zhu YI, Stiller M. Dapsone and sulfones in dermatology. Overview and update. Journal of American Academy of Dermatology 2001 Sep; 45(3): 420-34. - 10. Blomqvist P, Feltelius N, Ekbom, Klareskog I. Rheumatoid arthritis in Sweden. Drug prescriptions, costs, and adverse drug reactions. J Rheumatol 2000; 27(5): 1171-1177.
Bibliografía
- 11. Katz S. Sulfones. En Fistzpatrick TB, Freedber IM, Eisen A, Austen KF, Goldsmith LA, Katz SI (eds): Dermatology in General Medicine, ed 5. New York, Mc Graw-Hill. 1998; (1): 2790-2793.
- 12. Akahoshi K, Chijiwa Y, Kabemura T y col. Desensitization for sulfasalazine-induced skin rash in a patient with ulcerative colitis. J Gastroenterol 1994 Dec; 29(6): 772-775.
13. Gardner G, Furst DE. Disease-modifying antirheumatic drugs. Potential effects in older patients. Drugs Aging 1995 Dec; 7(6): 420-437. - 14. Choy EH, Gambling L, Best SL, Jenkins RE, Kondeatis E, Vaughan R, Black MM, Sadler PJ, Panayi GS. Nickel contamination of gold salts: link with gold-induced skin rash. Br J Rheumatol 1997 Oct; 36(10): 1054-1058.
- 15. Lizeaux-Parneix V, Bedane C, Lavignac C, Bernard P, Bonnetblanc JM. Cutaneous reactions to gold salts. Ann Dermatol Venereol 1994; 121(11): 793-797.
- 16. Figueras A, Capella D, Castel JM, Laorte JR. Spontaneous reporting of adverse drug reactions to non-steroidal anti-inflammatory drugs. A report from the Spanish System of Pharmacovigilance, including an early analysis of topical and enteric-coated formulations. Eur J Clin Pharmacol 1994; 47(4): 297-303.
- 17. Sánchez Borges M, Capriles-Hulett A, Caballero-Fonseca F, Pérez CR. Tolerability to new COX-2 inhibitors in NSAID-sensitive patients with cutaneous reactions. Ann Allergy Asthma Immunol 2001 Sep; 87(3): 201-204.
Eventos
AMERICAN COLLEGE OF RHEUMATOLOGY
66th ANUAL SCIENTIFIC MEETING
Octubre 25 _ 29 de 2002
New Orleans
U.S.A.

