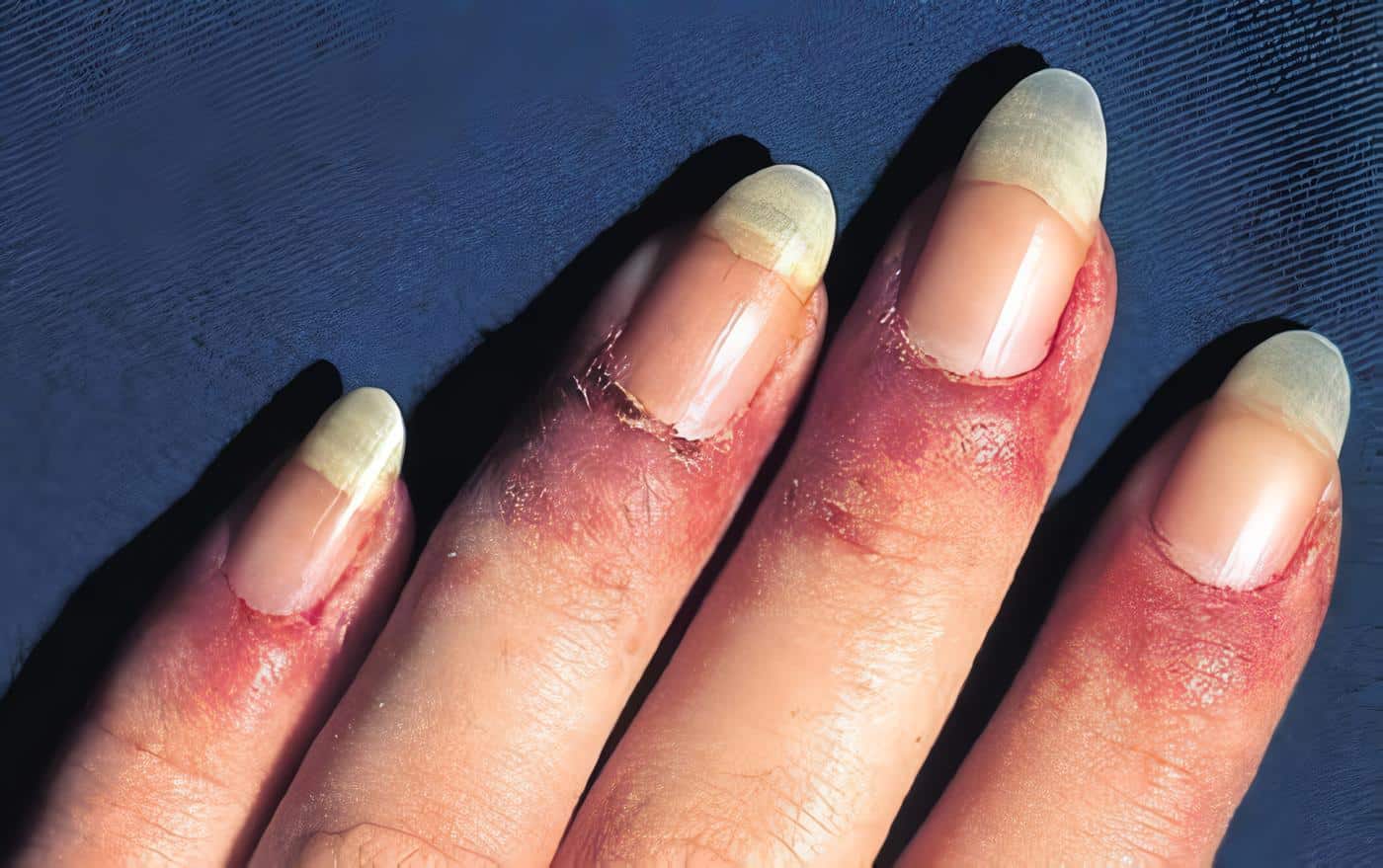
El síndrome de Sjögren se ha descrito como la presentación de síntomas secos (queratoconjuntivitis sicca), asociada a xerostomía, las cuales dependen de infiltrado de la glándula salival y lacrimal por linfocitos paralela a una alteración inmunológica compleja1.
Se han propuesto varias clasificaciones por diversas agrupaciones científicas a través de la historia de este síndrome, realizadas principalmente en Norteamérica y Europa, orientadas a la descripción de pacientes para estudios epidemiológicos y clínicos, dentro de las cuales se encuentra la realizada en 19862 en donde se propone la valoración objetiva de la queratoconjuntivitis sicca con pruebas específicas, la evidencia objetiva de la disminución del flujo salivar, infiltrados linfocíticos observados en la biopsia de glándula salivar menor y la presencia de algunos anticuerpos autoinmunes como factor reumatoide, anticuerpos antinucleares, y anticuerpos contra antígenos nucleares extractables Ro y La. Varias de estas clasificaciones han sido validadas en grandes grupos de pacientes3-4 describiendo hallazgos similares a los propuestos en 1986 con algunas modificaciones. Dentro de las más recientes encontramos la revisión elaborada por Vitali y colaboradores5 quienes introdujeron algunas modificaciones que definen más claramente los pacientes con este síndrome, ya sea primario o secundario y brindando unos criterios de exclusión más precisos.
En nuestro informe, la paciente presentaba franca sialoadenitis clínica e histológica, así como xeroftalmía confirmada por exámenes oftalmológicos, estudios inmunológicos como ANAS, Ro y La altamente positivos, hipergamaglobulinemia con predominio de la IgG, todo lo cual confirma el diagnóstico de síndrome de Sjögren primario.
El síndrome de sjögren puede tener manifestaciones extraglandulares comprometiendo diferentes órganos, dentro de los cuales el pulmón ha sido estudiado ampliamente.
Llama la atención en este caso la asociación del compromiso extraglandular pulmonar y tiroideo que se correlacionó con la etiología autoinmune.
La prevalencia del compromiso pulmonar se ha descrito en un rango amplio (9 a 90%) de los pacientes,6 así como con un amplio espectro de manifestaciones tanto clínicas como imagenológicas6-8. Dentro de las principales están la enfermedad obstructiva de la vía aérea con tos crónica como presentación clínica, la enfermedad pulmonar intersticial con el hallazgo histológico frecuente de neumonitis intersticial linfocítica (NIL)6 y menos frecuentemente la neumonitis intersticial usual (NIU) o la bronquiolitis obliterante con neumonía organizada (BOOP), el linfoma pulmonar, el pseudolinfoma, manifestaciones pleurales y otras.
La evaluación del compromiso pulmonar se ha realizado mediante valoración de parámetros clínicos, funcionales pulmonares, imagenológicos e histológicos9. De estos parámetros y del tipo de pacientes incluidos en los estudios de investigación dependen las diferentes descripciones que se encuentran en la literatura sobre el compromiso pulmonar predominante. Algunos autores han descrito compromiso pulmonar en el 75% de pacientes con síndrome de Sjögren, predominando la enfermedad pulmonar intersticial seguida por la enfermedad de vía aérea pequeña9.
Se ha encontrado predominantemente el compromiso de la vía aérea pequeña, secundaria al compromiso epitelial de la misma, que es frecuente en el pulmón en los pacientes con esta patología, ocasionando manifestaciones subclínicas8.
Las descripciones imagenológicas, especialmente de la TACAR evidencian principalmente compromiso intersticial con opacidad en vidrio esmerilado10-11. Se han descrito también hallazgos de engrosamiento interlobular septal, micronódulos, patrón en panal de abejas y bronquiectasias12. Otros autores13 han encontrado más frecuentemente estadios más avanzados como fibrosis pulmonar y también compromiso seco traqueobronquial.
En el pulmón se pueden encontrar alteraciones que dejan lesiones ocupando espacio o cavidades, como son las bulas y los quistes. Las bulas corresponden a espacios grandes (mayores de un centímetro) que contienen aire, resultado de la destrucción, dilatación y confluencia de la vía aérea de los espacios distales al bronquiolo terminal y sus paredes son el resultado del parénquima comprimido14.
Los quistes son cavidades con paredes epiteliales que se ven como bulas en la radiografía, el nombre que recibe el quiste, generalmente depende de la naturaleza patológica de su pared epitelial14-15, y su tamaño puede oscilar entre 2 a 10 cm14.
Se han descrito múltiples entidades etiológicas que llevan a la formación de quistes15-17, dentro de éstas se encuentran principalmente patologías infecciosas (pneumocistis carinii, estafilococo dorado, tuberculosis), histiocitosis pulmonar (histiocitosis X, granuloma eosinófilo, granulomatosis de las células de Langerhans), linfangioleiomiomatosis, esclerosis tuberosa, neumonía intersticial linfocítica, asociación de NIL con síndrome de inmunodeficiencia adquirida (SIDA) y otras infecciones virales15.
Por medio de la TACAR se pueden detectar fácilmente las anormalidades quísticas y dependiendo de los patrones imagenológicos se puede facilitar un diagnóstico específico15, 18.
En la tabla 4 observamos algunas de las principales patologías que causan quistes pulmonares.
Tabla 4. Principales causas de quistes pulmonares adquiridos (tomado de 19)
| INFECCIONES Micóticas (Aspergillus, coccidioides) Pneumocistis C Bacterianas (Estafilococo dorado, micobacterias) Parasitarias (equinococos paragonimos)ENFERMEDAD EMBÓLICA Tromboembolismo Embolismo séptico MALIGNIDAD ENFERMEDADES AUTOINMUNES ENFERMEDAD PULMONAR INTERSTICIAL ENFERMEDADES DE LA VÍA AÉREA |
Existe también un amplio grupo de enfermedades autoinmunes que pueden generar quistes pulmonares (granulomatosis de Wegener, vasculitis, lupus eritematoso sistémico y artritis reumatoidea)19.
El compromiso quístico pulmonar en el síndrome de Sjögren se ha informado en la literatura, 8,10,12,19-28 con informes variables sobre su prevalencia. Un estudio8 mostró el hallazgo de quistes y bulas por TACAR del 5% (3/61) de pacientes. Otro estudio12 encontró enfermedad quística dentro del grupo de pacientes con síndrome de Sjögren asintomáticos respiratorios y sin alteración evidente en la radiografía de tórax, una presentación sorpresivamente alta del 13% (5/37 pacientes), llamando la atención en los parámetros normales clínicos y radiológicos previos a la toma de la TACAR.
En nuestro país, este es el primer informe de presentación de enfermedad quística pulmonar y síndrome de Sjögren, con el hallazgo ya descrito de quistes con paredes finas y diámetro promedio de 4 mm.
Koyama y colaboradores10 en un estudio retrospectivo, valorando la TACAR en pacientes con síndrome de Sjögren primario encontraron espacios aéreos quísticos en 18 de 60 pacientes (30%), encontrando una proporción similar de la presentación unilateral (15%) o bilateral (15%) de los quistes (9 pacientes cada uno respectivamente). Los espacios quísticos tuvieron una distribución difusa en 15 pacientes (25%) y un patrón en parche en 3 pacientes (5%)10.
En varios informes se ha descrito la asociación de enfermedad quística pulmonar, síndrome de Sjögren y depósito de amiloide.20,22,24,26-27 En algunos casos esta asociación se ha descrito paralela a la presencia de síndrome antifosfolípido con demostración del depósito de amiloide en las paredes bronquiales22. En el caso de nuestra paciente no se demostró depósito de amiloide en el lavado broncoalveolar, ni síndrome antifosfolípido.
Schlegel y colaboradores24 describieron un caso de síndrome de Sjögren con múltiples bulas enfisematosas pulmonares diseminadas en ambos pulmones con detección por inmunohistoquímica de amiloide tipo L (Lambda).
Aparentemente el primer caso informando la asociación de Sjögren primario, amiloidosis y quistes pulmonares fue descrito por Tsunoda y colaboradores27 y un segundo caso posteriormente por Kobayashi y colaboradores26. Pérez-Castrillón y colaboradores20 describieron el hallazgo de una cavidad única con contenido de aire y parénquima pulmonar en su interior como el resultado de gangrena pulmonar secundaria a infección por streptococo Pneumoniae.
Varios informes se han descrito con la asociación de enfermedad pulmonar intersticial manifestada como NIL y la aparición de quistes pulmonares en pacientes con síndrome de Sjögren demostrado histológicamente21 y por tomografía23,28; en los dos casos descritos por Ichikawa y colaboradores23 se evidenciaron lesiones nodulares y quísticas peri broncovasculares. De manera similar Inase y colaboradores25 describieron el caso de un paciente con síndrome de Sjögren con un denso infiltrado linfocítico alrededor de las glándulas bronquiales quien posteriormente desarrolló múltiples bulas. En el caso de nuestra paciente se evidenció la presencia importante de linfocitos, siendo el 30% de la celularidad encontrada en el lavado broncoalveolar (BAL), lo que podría indicar su posible asociación con neumonía intersticial linfocítica (NIL) la cual no se pudo demostrar histológicamente por el riesgo que implicaba para la paciente realizar una biopsia transbronquial.
El mecanismo de la formación del quiste está aún poco entendido. La explicación que la mayoría de autores da a la formación de estos en los pacientes con síndrome de Sjögren está en relación con un mecanismo de válvula y atrapamiento distal de aire, por la obstrucción luminal secundaria al infiltrado y la distensión de los lóbulos terminales12.
Otros autores no han encontrado la formación de quistes en presencia de obstrucción de la vía aérea, y proponen que la neumonía intersticial linfocítica es la responsable de la formación de los quistes con o sin el depósito casual de amiloide12.
En conclusión presentamos el caso de una paciente con Síndrome de Sjögren primario, con compromiso pulmonar importante dado por la presencia de múltiples quistes, es posible que en este caso la asociación principal esté dada con NIL, por los hallazgos en el BAL y porque en el estudio de función pulmonar (Curva de Flujo Volumen) no se demostró compromiso de la vía aérea. La presencia de hipotiroidismo en esta paciente pudiera estar en relación con la mayor asociación de este con patología autoinmune, pero no creemos que haya contribuido a la patogénesis de los quistes. Consideramos finalmente que todo paciente con Síndrome de Sjögren y manifestaciones pulmonares debería tener una TACAR como parte de su estudio, al igual que estudios histopatológicos , si no hay contraindicación para estos, con el fin de definir muy bien el tipo de lesión o lesiones, y actuar en concordancia con éstas.
Agradecimientos
Queremos agradecer a los doctores Alfredo Saavedra y Edgar Sánchez, neumólogos del Departamento de Medicina Interna de la Universidad Nacional, su colaboración en la interpretación de los hallazgos pulmonares y en la realización de la biopsia transbronquial.
Referencias
1. Fox RI. Sjögren’s Syndrome. En Kelly WN, Harris ED jr, Ruddy S, Sledge CB eds. Textbook of Rheumatology. Philadelfia: W.B. Saunders Company: 1997; 955-968.
2. Fox RI, Robinson CA, Curd JG, Kozin F, Howell FV. Sjögren’s Syndrome. Proposed criteria for classification. Arthritis Rheum 1986; 29: 577-85.
3. Vitali C, Bombardieri S, Moutsopoulos HM, Coll J, Gerli R, Hatron PY, Kater L,Konttinen YT, Manthorpe R, Meyer O, Mosca M, Ostuni P, Pellerito RA, Pennec Y, Porter SR, Richards A, Sauvezie B, Schiodt M, Sciuto M, Shoenfeld Y, Skopouli. Assessment of the European classification criteria for Sjögren’s Syndrome in a series of clinically defined cases: results of a prospective multicentre study.The European Study Group on Diagnostic Criteria for Sjögren’s Syndrome. Ann Rheum Dis 1996; 55: 116-21.
4. Vitali C, Bombardieri S, Moutsopoulos HM, Balestrieri G, Bencivelli W, BernsteinRM, Bjerrum KB, Braga S, Coll J, de Vita S, et al. Preliminary criteria for the classification of Sjögren’s Syndrome. Results of a prospective concerted action supported by the European Community. Arthritis Rheum 1993; 36: 340-347.
5. Vitali C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE,Daniels TE, Fox PC, Fox RI, Kassan SS, Pillemer SR, Talal N, Weisman MH; European Study Group on Classification Criteria for Sjögren’s Syndrome. Classification criteria for Sjögren’s Syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis 2002; 61: 554-558.
6. Cain HC, Noble PW, Matthay RA. Pulmonary manifestations of Sjögren’s Syndrome. Clin Chest Med 1998; 19: 687-699.
7. Fairfax AJ, Haslam PL, Pavia D, Sheahan NF, Bateman JR, Agnew J, Clarke S, Turner-Warwick M. Pulmonary disorders associated with Sjögren’s Syndrome.Quarterly journal of medicine, New Series 1981; 199: 279-295.
8. Papiris, Spyros A; Maniati, Maria; Constantopoulos, Stavros H; Roussos, Charis; Moutsopoulos, Haralampos M; Skopouli, Fotini N. Lung involvement in primary Sjögren’s Syndrome is mainly related to the small airway disease. Annals of the Rheumatic Diseases 1999; 58: 61-64.
9. Constantopoulos SH, Papadimitriou CS, Moutsopoulos HM. Respiratory manifestations in primary Sjögren’s Syndrome. A clinical functional, and histologic study. Chest 1985; 88: 226-229.
10. Koyama M, Johkoh T, Honda, Osamu, Mihara N, Kozuka T, Tomiyama N, Hamada S, Nakamura H. Pulmonary Involvement in Primary Sjögren’s Syndrome: Spectrum of Pulmonary Abnormalities and Computed Tomography Findings in 60 Patients. J Thor Imag 2001; 16: 290-296.
11. Franquet T, Gimenez A, Monill JM, Diaz C, Geli C Primary Sjögren’s Syndrome and associated lung disease: CT findings in 50 patients. Am J Roentgenol 1997; 169: 655-658.
12. Uffmann M, Kiener H, Bankier A, Bald M, Zontsich T, Herold CJ. Lung Manifestation in Asymptomatic Patients with Primary Sjögren Syndrome: Assessment with High Resolution CT and Pulmonary Function Tests. J Thor Imag 2001; 16: 282-289.
13. Quismorio FP Jr. Pulmonary involvement in primary Sjögren’s Syndrome. Curr Opin Pulm Med 1996; 2: 424-428.
14. Murphy DM, Fischman AP. Bullous diseases of the lung. In Fishman’s Pulmonary Diseases and Disorders. New York:Mc Graw Hill; 1998: 849-863.
15. Thomas E. Hartman. CT cystic diseases of the lung. Radiology Clin N Am 2001; 39: 348-356.
16. Shamji FM. Classification of cystic and bullous lung disease. Chest Surg Clin N Am 1995; 5: 701-716.
17. Shamji FM, Sachs HJ, Perkins DG. Cystic disease of the lungs. Surg Clin North Am 1988; 68: 581-620.
18. Lee KH. The radiologic differential diagnosis of diffuse lung diseases characterized by multiple cysts or cavities. J Comput Assist Tomogr 2002; 26: 5-12.
19. Scully RE, Mark EJ et al. Case Records of the Massachusetts general Hospital case 17-2001. NEJM 2001; 344: 1701-1708.
20. Pérez-Castrillón JL, González-Castañeda C. Cavitary lung lesion in a patient with Sjögren’s Syndrome. Postgrad Med J 1999; 75: 765-766.
21. Hayasaka S, Fujino N, Yoshinaga T, Kiyama T, Maemoto H, Outsuka Y.Primary Sjögren’s Syndrome with lymphocytic interstitial pneumonia and pulmonary multiple cystic lesions. Nihon Kokyuki Gakkai Zasshi 1999; 37: 802-806.
22. Teruuchi S, Bando M, Hironaka M, Ohno S, Sugiyama Y. Sjögren’s Syndrome with multiple bullae and pulmonary nodular amyloidosis. Nihon Kokyuki Gakkai Zasshi 2000; 38: 918-922.
23. Ichikawa Y, Kinoshita M, Koga T, Oizumi K, Fujimoto K, Hayabuchi N. Lung cyst formation in lymphocytic interstitial pneumonia: CT features. J Comput Assist Tomogr 1994; 18: 745_748.
24. Schlegel J, Kienast K, Störkel S, et al. Primäre pulmonal noduläre Amyloidose und multiple Emphysem bullae bei Sjögren-Syndrom. Pneumologie 1992; 46: 634_637.
25. Inase N, Usui Y, Tachi H, et al. Sjögren’s Syndrome with bronchial gland involvement and multiple bullae. Respiration 1990; 57: 286_288.
26. Kobayashi H, Matsuoka R, Kitamura S, Tsunoda N, Saito K. Sjögren’s Syndrome with multiple bullae and pulmonary nodular amyloidosis. Chest 1988; 94: 438-440.
27. Tsunoda N, Saito K, Kobayashi H, Matsuoka R, Kitamura S.A case of multiple nodular pulmonary amyloidosis associated with Sögren’s Syndrome and multiple bullae. Nihon Kyobu Shikkan Gakkai Zasshi 1987; 25: 1364-1369.
28. Meyer CA, Pina JS, Taillon D, Godwin JD. Inspiratory and expiratory high-resolution CT findings in a patient with Sjögren’s syndrome and cystic lung disease.Am J Roentgenol 1997 Jan; 168: 101-103.