El esquema de tratamiento que se inicia en cada paciente depende de las manifestaciones clínicas sugerentes del grado de compromiso renal o de acuerdo con el grado histológico observado en la biopsia renal4, 5 (ver tabla Nº 5) . En enfermedad moderada se inicia con prednisona, si ocurre una respuesta completa, con disminución de la actividad de la enfermedad, se pasa a días alternos con monitorización de las reactivaciones. Si no hay una respuesta completa a la prednisona o la nefritis empeora, se inician ciclos mensuales de ciclo-fosfamida5, 6.
En enfermedad severa se inicia con prednisona y pulsos mensuales de ciclofosfamida por seis a siete meses5.
La transición a terapia inmunosupresiva de mantenimiento o descontinuación de la terapia de inducción generalmente se indica a los seis meses de tratamiento, pasando en aquellos pacientes que han respondido adecuadamente a prednisona oral en días alternos. En quienes a los seis meses no se ha obtenido remisión completa, se mantienen con pulsos de ciclofosfamida cada tres meses5.
Otros esquemas alternativos para el mantenimiento incluyen pulsos de metilprednisolona, ciclofosfamida oral por dos a seis meses, clorambucil oral o azatioprina diario5.
Nuestros pacientes fueron manejados de acuerdo con el tipo histológico: Los pacientes con grado histológico I y II recibieron prednisona; de los que tuvieron grado III 75% recibió prednisona y ciclofosfamida. En estos tres pacientes se realizó tratamiento con inmunosupresores porque por las manifestaciones estrarenales (LES florido, síndrome antifosfolípido, artritis) o complicaciones del tratamiento con corticoides (síndrome Cushing) y del compromiso renal (insuficiencia renal crónica) sustentaban su uso (ver gráfico Nº 7 y Nº 8). De los pacientes con clasificación tipo IV a todos se les indicó tratamiento combinado con prednisona /ciclofosfamida , excepto uno (8.3%) que fue manejado con prednisona/azatioprina (único caso familiar de la serie). De los pacientes con indicación de prednisona/ciclofosfamida dos (16.6%) abandonaron el tratamiento y decidieron recibir medicina bioenergética.
Los pacientes no biopsiados fueron manejados de acuerdo con las manifestaciones renales sugerentes del tipo histológico y por el grado de actividad extrarenal de la enfermedad. Diez recibieron prednisona prednisona/ciclofosfamida, uno prednisona/ciclofosfamida/metrotexate (presentaba edema pulmonar, cerebritis e ipotiroidismo, además de IRA, SN y SNA). Un paciente abandonó el tratamiento.
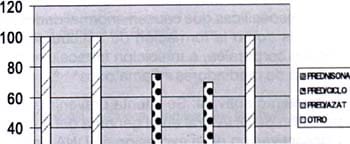
Gráfico No. 8 Pacientes con nefritis lúpica Santafé de Bogotá. 1983-1999. CORELACIÓN TIPO HISTOLÓGICO Y TRATAMIENTO
Terapia del Futuro
Para el futuro se está trabajando en varias líneas de investigación:
• Dieta: Se propone restricción protéico calórica en casos especiales y el uso de inhibidores de prostaglandinas (ácido eicosapentaenoico) para evitar la progresión del daño renal6, 5. Además aporte de proteínas (caseína) con suplementos de grasas de pescado5. Se ha descrito el uso de PGE1 y análogos intravenosos en pacientes con nefritis lúpica quienes cursan con edema y lupus activo5. Los pacientes que presentan hipercolesterolemia deben tratarse para disminuir los niveles séricos y mejorar el pronóstico4; en los pacientes con HTA se disminuye la ingesta de sal y en los que cursan con IR se disminuye el aporte de proteínas4. También se describe el uso de inhibidores de radicales libres, bloqueadores de los receptores del factor activador de plaquetas y de tromboxanos sintetasa, inhibidores de la síntesis de óxido nítrico antagonistas de los receptores de endotelina A5.
• Eliminación de subgrupos de linfocitos T: Se está investigando con estudios monoclonales conjugados con toxinas (inmunotoxinas), subgrupos de LB (B leu-1+) que intervienen en la formación de autoanticuerpos y con subgrupos de LT causales de actividad auxiliar excesiva5,6. El agente LJP397 (tolerogen de células B) se une a la porción Fab de los anticuerpos anti- DNA en la membrana de las células B autoreactivas y produce regulación de la síntesis de DNA de las inmunoglobulinas y aboptosis de células B4. Además se propone irradiación linfoide total y transplante de médula ósea5.
• Hormonas sexuales: Se ha observado probable beneficio del uso de castración, andrógenos, antagonistas de estrógenos y bromocriptina en mujeres con LES5,6.
• Genética molecular: Con fármacos se intenta provocar inhibición intracelular de la síntesis de proteínas específicas que causan anormalidades particulares como la formación de anticuerpos anti células corporales, e inhibición intracelular de la síntesis de mediadores inflamatorios4, 5, 6.
• Tratamiento antiviral: Se intenta prevenir la incorporación de DNA viral en el genoma del huésped y desactivación de la expresión de DNA viral5,6.
• Anticuerpos monoclonales para la fracción del complemento C5 que disminuyen la producción de C5a y C5b-9 y la consecuente generación de complejos inmunes y posterior respuesta inflamatoria4,5.
• Un ligando CD40 inhibe la producción de anticuerpos patogénicos y la producción de citoquinas inflamatorias y activación de células endoteliales dependientes de células T 4,12.
Pronóstico
La enfermedad en general tiene un curso crónico y variable en cada paciente, con exacerbaciones y remisiones espontáneas”. Se describe una sobrevida de 95% a cinco años8 y de 85% a los 10 años7, con una mortalidad de 10%7. La falla renal es una causa importante de morbilidad; las infecciones constituyen la causa más importante de mortalidad3 y se relacionan con altas dosis de corticoides y citotóxicos.
El seguimiento de los pacientes se hace con C3, C4, anti DNA y pruebas de función renal, además de las manifestaciones clínicas7. Las células LE no se usan en el seguimiento por tener baja sensibilidad.
Entre los factores de pronóstico más importantes se cuentan7, 8, 37:
• Sexo ( el sexo masculino es de peor pronóstico)
• Raza (la negra responde menos favorablemente)
• Edad (empeora el pronóstico en los menores de 12 años)
• Anemia hemolítica, trombocitopenia, micro-angiopatía trombótica
• Hiperazoemia
• Sedimento urinario con signos de nefritis
• HTA durante los primeros 4 meses de la enfermedad
• Hipocomplementemia (CH50 disminuido es predictivo de mortalidad)
• Niveles elevados de anti DNA
• Síndrome nefrótico persistente
• Recaídas múltiples5
• Retardo en el inicio de la remisión renal5
• Severa actividad lúpica extrarenal
• Biopsia renal con cambios inflamatorios. La nefritis mesangial tiene mejor pronóstico, mientras que la proliferativa difusa tiene el peor pronóstico8. La nefritis lúpica membranosa tiene un pronóstico en general bueno4.
La evolución de los pacientes revisados ha sido satisfactoria en el 72% de los casos. Tres pacientes (7.6%) presentaron LES latente, un paciente (2.5%) LES florido y dos pacientes remitieron expon-táneamente. Hubo una mortalidad de cuatro pacientes (10%). Las causas de muerte fueron: abandono del tratamiento en el 50%, agudización de la enfermedad 25% y una niña falleció a los 24 años de edad en otra institución y desconocemos la causa de muerte. Ver gráfico No. 9 y 10
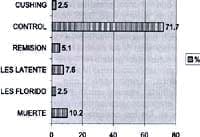
Gráfico No. 9 Pacientes con nefritis lúpica Santafé de Bogotá. 1983-1999
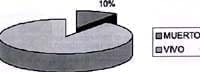
Gráfico No. 10 Pacientes con nefritis lúpica Santafé de Bogotá. 1983-1999
Bibliografía
1. Gordillo G. Glomerulopatía del lupus eritematoso sistémico. En: GordilloG.Nefrología Pediátrica. 1ªed.España: Mosby/doyman libros SA. 1996: 222-33.
2. Cassidy JT and Petty Re. Systemic Lupus erythematosus. En: Pediatric Reumatology 3ªed..Philadelphia: WB Sauders Company.1995:260-310.
3. Lehman T, Mouradian J. Systemic lupus erythematosus. En: Holliday M and Barrat M. Pediatric Nephrology. 3ªed.Baltimore:Willians & Willians.1994:849-70.
4. Belmont M. Lupus Clinical Overview. Belmont@is2.nyu.edu.
5. Balow J E, Bumpas DT, Austin III HA. Lupus nephritis. En: Brady HR, Willax C. Therapy in Nephrology and arterial hypertention a company Brener and Rector´s.1ªed.Canadá:W B Sawders Company;1999.
6. Loredo A, Cota AR. Lupus eritematoso sistémico. En: Loredo A, Carbajal L. Medicina interna pediátrica.3ªed en español.Mexico: McGraw Hill I;1996:132-49.
7. Lang B, Silverman E. A clinical overview of systemic lupus erithematosus in childhood. Pediatrics Review.1993;14(5):194-202.
8. Yang L, Chen W and Lin Ch.Lupus nephritis in children- a review of 167 patients. Pediatrics.1994;94 (3):335-40.
9. Lehman TJA, McCurdy DK, Bernstein BH, King KK, Hanson V. Systemic lupus erytematosus in the first decade of life. Pediatrics.1989; 83:235-9.
10. Silverman E. Pediatric lupus. Lupus Canada Bulletin.1993;3(1):1-4. https://www.lupuscanada.org/html/pediatric_lupusl.
11. Tsao B, Cantor R, Kalunian K, Chen Ch and cols. Evidence for linkage of a candidate chromosome 1 region to human systemic lupus erythematosus.J Clin Invest.1997;99:725-31.
12. Topologlu R, Bakkaloglu A, Slingsby J and cols. Molecular bsis of hereditary C1q deficiency associated with SLE and IgA nephropathy in Turkish family.Kidney International.1996;59:635-42.
13. Yellin M, D´agati V, Parkiinson G and cols. Immunohistologic analysis of renal CD40 and CD40L expression in lupus nephritis and other glomerulonephritides. Artrhitis & Rheumatism.1997;40(1):124-34.
14. Font , Torras A, Cevera R, Darnell A, Revert L, Ingelmo M. Silent renal disease in systemic lupus erithematosus. Clin Nephrol.1987;27:283–8.
15. Naiker I, Chrystal V, Randeree I, Seedat Y.The significance of arterial hypertension at the onset of clinical lupus nephritis.Postgrad Med J.1997;73:230-3.
16. Makker SP.Glomerular diseases.En: Kher KK,Makkers SP. Clinical pediatric nephrology.1ªed United States America: Mc Graw Hill;1992:233-44.
17. Glassock RJ, Cohen AH.secundary glomerular dissease. En: Brenner BM and Rector FC. The kidney. Vol II.2ª ed.Philadelphia: WB Sawders; 1981:1493-510.
18. Schoroeder J, Euler H. Recognition and management of systemic lupus erythematous.Drugs.1997;54(3):422-34.
19. Schwartz MM.The role of renal biopsy in the management of lupus nephritis. Semin Nephrolo.1985;5:255-63.
20. Balow JE, Austin III HA, Muenz LR : Effect of treatment on the evolution of renal abnormalities in lupus nephritis. N Eng J Med.1984;311:491-5.
21. Kimberly RP, Lockshin MD, Sherman RL, et al. High dose intravenous methylprednisolone pulse therapy in systemic lupus erytematosus. Am J Med.1981;70:817-25.
22. Boumpas DT, Austin III HA, Vaughn EM, Klippel JH, Steinberg AD, Yarboro CH, Balow JE. Controled trial of pulse methilprednisolone versus cyclophosphamide in severe systemic lupus nephritis. Lancet.1992;340:741-5.
23. Austin HA, Klippel JH, Balow JE, LeRiche NG, steinberg AD, Plotz PH, Decker JL. Therapy of lupus nephritis: controled trial of prednosone and cytotoxic drugs. N Eng J Med. 1986; 314: 614-9.
24. Felson DT, Anderson J. Evidence for the superioritiy of immunosuppresive drugs and prednisone over prednisone alone in lupus nephritis: results of a pooled analysis. N Eng J Med. 1984; 1528-33.
25. Lehman T, Sherry D, Wagner-weiner L, and cols. Intermittent intravenous cyclophosphamide therapy for lupus nephritis. J Pediatr.1989;114:1055-60.
26. Austin HA, Klippel JH, Balow JE, LeRiche NG, Steinberg AD, Plots PH, Decker JL.Therapy of lupus nephritis.N Engl J Med.1986;314:614-9.
27. McCune WJ, Golbus J, Zeldes W, Bohlke P, Dunne R, Fox DA.Clinical and immunologic effects of mothly administration of intravenous cyclophosphamide in severe systemic lupus erytematosus. N Eng J Med.1988;318: 1423-51.
28. Lehman TJA, Sherry DD, Wagner-WeinerL, et al. Intermittent intravenous cyclophosphamide for lupus nephritis. J Pediatr.1989;114: 1050-1060.
29. Finn GP, Sidau RNB.Protecting the bladder from cyclophosphamide with mesna.N Eng J Med.1986;314:61.
30. Fu L, Yang LY, Chen WP and Lin CY. Clinical efficacy of cyclosporin a neoral in the treatmen of paediatric lupus nephritis with heavy proteinuria.British J Rheumatology.1998;37:217-21.
31. Tanaka R, Yoshikawa N, Kitabo Y, Ito H,Nakamura H. Long-term cyclosporin treatment in children with steroid-dependent nephrotic syndrome. Ped Nephrol. 1993;7:249-52.
32. Feutren G, Querin S, Noel L, Chatenoud and cols. Effects of cyclosporine in severe systemic lupus erytematosus. J Pediatr.1987;111(6): 1063-8.
33. Ter Borg EJ, Tegsess AM, Kallenberg CG.Unexpected severe reversible cyclosporine A-induced nephrotoxicity in a patient with systemic lupus erytematosus and tubulointerstitial renal disease. Clin Nephrol.1988;29:93-5.
34. Lewis EJ, Hunsucker LG, Lan SP, Rohde RD, Lachin JM. A controlled trial of plasmapheresis therapy in severe lupus nephritis. N Eng J Med.1992; 326: 1373-9.
35. Boletis JN, Loannidis JP, Boki KA, Moutsopoulos HM. Intravenous immunoglobulin compared with cyclophosphamide for proliferative lupus nephritis. Lancet.1999;354:9178):569-70.
36. Dooley MA, Cosio FG, Nachman PH, Falkenhain ME, Hogan SL, Falk RJ, Hebert LA. Mycophenolate mofenil therapy inlupus nephritis: clinical Observations. J Am Soc Nephrol.1999;10(4):833-9.
37. McCurdy D, Lehman T, Berstein B, Hanson V, King K, Nadorra R and Landing B. Lupus Nephritis: prognostic factors in children. Pediatrics.1992;89(2):240-7.