Un Reto para el Pediatría
* Prof. Gladys amaya
** Dr. Pedro Alberto Sierra Rodriguez
*** Dr.Luis Fernando Gordon
* Profesora Asistente Universidad Nacional
Departamento de nutrición.
** Profesor Asistente Universidad Nacional
Departamento de pediatría
Coordinación servicio de lactantes
Hospital La Misericordia
*** Residente de pediatría – segundo año
Universidad Nacional
Introducción
Es frecuente encontrarnos niños con hipoglicemias de difícil manejo en las salas de recién nacidos y lactantes, a los cuales les hemos colocado infusiones de dextrosa y continúan hipoglicémicos. ¿Qué hacer en estos casos?
Esta revisión persigue crear otras alternativas de manejo diferentes, a las infusiones de dextrosa, para el manejo de estos pacientes con hipoglicemia refractaria.
De todos los tejidos del organismo, el cerebro es quizá el que más depende de un aporte normal de glucosa, para suplir sus necesidades, por lo tanto una hipoglicemia prolongada o recurrente, sobre todo en las primeras horas de vida, puede traer como consecuencia lesiones cerebrales irreversibles, que se podrán manifestar por crisis convulsivas.
Historia
Desde 1911 los niveles de azúcar se han estado midiendo en los recién nacidos. La primera hipoglicemia neonatal significativa, fue reportada en 1937.
En 1959 el reporte de una hipoglicemia neonatal sintomática transitoria generó reportes a nivel mundial.
Subsecuentemente fueron descubiertos muchos síndromes hipoglicémicos, estos incluyen deficiencias en los transportadores sanguíneos de glucosa, la asociación de hiperinsulinismo e hipoglicemia y una variedad de deficiencias de la acetil coenzima A deshidrogenasa.
Definición de Hipoglicemia
Los criterios establecidos por Cornblath y schwartz1 para la hipoglicemia se han utilizado ampliamente durante los últimos 20 años, la glicemia más baja para prematuros es de 20 mg/dl, para neonatos a término en los primeros tres días de vida, 30 mg/dl y en adelante 40 mg/dl2.
Sin embargo, surge preocupación, ya que lo estadísticamente correcto puede no ser fisiológicamente adecuado y que estos valores pueden hacer que algunos prematuros y recién nacidos a término, sintomáticos, estén en peligro de lesión por sufrir una hipoglicemia no tratada2 .
En general se considera que un límite inferior más prudente para la glicemia es de 40 mg/dl, en todos los lactantes y niños, incluyendo prematuros y neonatos pequeños para la edad. Esto identificará un número mayor de neonatos con hipoglicemia2.
En un estudio que compara los criterios de Corblath y schawartz, o sea un límite de glicemia inferior de 30 mg/dl, con una cifra tope de 40 mg/dl, Sexton comprobó que el porcentaje de neonatos con hipoglicemia aumentaba de 8.1 a 20.6%2.
Ya que existe un desface entre las medidas efectuadas por dextrostix y los valores reales de la glicemia central, 20 mg/dl, los valores bajos o los obtenidos en criaturas sintomáticas deben correlacionarse con valores de glicemia central.
También hay que tener cuidado, en la muestra obtenida, porque la concentración de glucosa en sangre entera es de 15% menor, que en suero o plasma, debido a la concentración relativamente baja, de glucosa en los glóbulos rojos2.
Homeostasis de la Glicemia
El mantenimiento de las concentraciones normales de glucosa en sangre, el cual debe lograr un rango estrecho de cifras en la población pediátrica, es resultado de la compleja interacción entre la acción hipoglicemiante de la Insulina y la acción hiperglicemiante de las llamadas hormonas contrarreguladoras (glucagón, epinefrina,norepi- nefrina, cortisol y hormona de crecimiento). Lo anterior tiene como objeto proveer al organismo de los substratos energéticos necesarios para satisfacer sus demandas metabólicas básales2.
Si bien todos los tejidos utilizan glucosa como fuente de energía, este es el único nutriente que puede ser utilizado por el sistema nervioso(rata de uso de la glucosa por el cerebro, es de 4-5 mg/ 100 grs de cerebro por minuto)3.
El organismo del niño obtiene la glucosa (energía)a través de:
4.1 carbohidratos de la dieta: los cuales constituyen el aporte exógeno y se almacenan en forma de glucógeno en el hígado y en el músculo.
4.2.Compuestos glucogénicos obtenidos por gluconeogénesis como son: aminoácidos provenientes del catabolismo protéico músculo esquelético(50%), lactato proveniente de la oxidación de glucosa en el músculo esquelético y reciclado a nivel hepático y renal(30%) y glicerol proveniente de la hidrólisis del tejido adiposo(10%).
4.3.Glucógeno hepático; por medio de la glucogenólisis.
Resumiendo, los principales mecanismos que mantienen los niveles séricos estables de glucosa3:
El hígado, funciona como un sistema “tampón” de glucosa, esto es, cuando la glucosa aumenta a valores muy altos, la insulina permite que los dos tercios de ella, se almacenen en forma de glucógeno hepático, así como en períodos de disminución de la glicemia, el hígado libera glucosa hacia el torrente circulatorio.
La acción de la insulina, en contraposición a la acción del glucagón, los cuales son mecanismos de primera línea contra la hiperglicemia y la hipoglicemia respectivamente.
El estímulo de la hipoglicemia en hipotálamo, que a su vez estimula el sistema nervioso simpático y a las suprarrenales, lo cual produce liberación de adrenalina, la cual constituye un importante mecanismo protector contra la hipoglicemia.
Por último la secreción durante días y horas de la hormona del crecimiento y del cortisol, los cuales disminuyen la utilización de la glucosa por parte de la célula.
La Insulina y sus Efectos Metabólicos
La insulina es una hormona asociada con el exceso de energía3.
La insulina es la hormona anabólica por excelencia, lo anterior en virtud de que promueve el almacenamiento de los excesos de nutrientes de la dieta, es decir su principal efecto es el almacenamiento en forma de glucógeno hepático.
Mecanismos Como Actúa la Insulina
6.1.La insulina inhibe la fosforilaza hepática, enzima que actúa sobre el glucógeno para convertirlo en glucosa (Inhibe la glucogenolisis).
6.2. La insulina aumenta la captación de glucosa que proviene de la sangre por las células hepáticas. Incrementa la actividad de la enzima glucoquinasa, que produce la fosforilación inicial de la glucosa, cuando se difunde al interior de la célula hepática (la glucosa queda atrapada de manera transitoria dentro de los hepatocitos).
6.3 La insulina aumenta la actividad de la enzima que promueve la síntesis de glucógeno( glucógeno sintetiza).
6.4 La insulina inhibe la gluconeogénesis, la cual tiene lugar en el hígado, desintegración de la proteína corporal para formar glucosa. Por lo tanto inhibe el catabolismo protéico.
6.5. Efecto de la insulina sobre el metabolismo de las grasas: La insulina aumenta el consumo de glucosa en la mayor parte de los tejidos, lo que disminuye el consumo de grasas de manera automática. Inhibe la acción de la lipasa, enzima que hidroliza los triglicéridos, en ácidos grasos libres y glicerol, los cuales se oxidan en el hígado y forman cuerpos cetónicos (acetoacetato, B- hidroxibutirato y acetona), los cuales utilizan como combustible alterno el músculo y el cerebro.
Causas de la Hipoglicemia Refractaria en el Neonato y en el Lactante
7.1 Aumento en la utilización de la glucosa.
7.1.1 Hiperinsulinismo endógeno
7.1.1.1 Nesidioblastosis
7.1.1.2 Hiperplasia o adenoma de célula insular
7.1.1.3 Síndrome de beckwith-wiedemann
7.1.2 Hiperinsulismo exógeno
7.1.2.1 Reacción insulínica en la diabetes sacarina
7.1.2.2 Mala administración de insulina por descuido o maltrato del niño
7.2 Disminución de la producción o sustrato limitado
7.2.1 Deficiencias hormonales
7.2.1.1 Hipopituitarismo o deficiencia aislada de hgh.
7.2.1.2 Insuficiencia suprarenal primaria.
7.2.1.3 Hipotiroidismo
7.2.1.4 Deficiencia de glucagón.
7.2.1.5 Falta de respuesta de medula suprarrenal (enf. de addison).
7.3 Glucogenosis
7.3.1 Tipo i: déficit de glucosa-6-fosfatasa.
7.3.2 tipo iii: déficit de amilo 1,6 glucosidasa.
7.3.3 tipo iv: déficit de fosforilasa hepática.
7.3.4 Déficit de glucógeno sintetasa.
7.4 Defectos de la gluconeogénesis.
7.4.1 Déficit de fructuosa 1,6 difosfatasa.
7.4.2 Déficit de piruvato carboxilasa
7.4.3 Déficit de fosfoenol-piruvato-carboxi-kinasa.
7.4.4 Intoxicación alcohólica aguda.
7.4.5 Intoxicación por salicilatos.
7.5 Disminucion de producción de combustible alternativo.
7.5.1 Defectos en la oxidación de ácidos grasos.
7.5.1.1 Deficiencia de carnitina
7.5.1.2 Deficiencia de deshidrogenasa de acetil-coenzima a.
7.5.2 Defecto de cetogénesis.
7.5.2.1 Deficiencia de lipasa de coa-umg.
7.6. Otros defectos enzimáticos.
7.6.1 Galactosemia: deficiencia galactosa 1-fosfato uridil transferasa.
7.6.2 Intolerancia a la fructuosa: deficiencia fructuosa-1- fosfato aldolasa.
Hiperinsulinismo Neonatal y del Lactante
El hiperinsulinismo es sin duda la causa más importante de hipoglicemia en la primera infancia.
Los niños que sufren de alguna de las formas de hiperinsulinismo están expuestos al gran peligro de mostrar convulsiones y daño cerebral permanente4. En Finlandia, en un estudio de vigilancia de 151 niños con hipoglicemia diagnosticada durante los primeros días de vida, se comprobó que el grupo que tenía convulsiones se diagnosticó más tarde(a las 39 horas de edad), y que había una mayor tendencia a lesión cerebral tardía (50%), mientras el grupo sin convulsiones fue diagnosticado antes (21 horas de edad) y tenía menos probabilidad de lesión cerebral(12%)2.
Apreciaciones han sido obtenidas para poblaciones no seleccionadas y es calculado que la frecuencia de presentación del hiperinsulinismo es de 1 caso por 40.000 o 50.000 personas. Por otra parte en poblaciones especificas, como Arabia Saudita, la frecuencia es de 1:2500 y en Finlandia de 1:3200. En estas poblaciones la alta frecuencia de la enfermedad se podría deber a la alta frecuencia de consanguinidad entre los matrimonios.
8.1 Regulación de la Secreción de Insulina por Parte de la Culula Beta
La glucosa y otros nutrientes energéticos como los aminoácidos, estimulan la secreción de insulina por su metabolismo para aumentar la proporción intracelular de ATP/ADP. Los incrementos en la razón ATP/ADP activan una proteína de membrana plasmática, el receptor de sulfonilurea(SUR), para que cierre un conducto de potasio(conducto KATP). Ello a su vez ocasiona despolarización de la membrana, penetración del calcio extracelular y liberación de insulina desde los gránulos de almacenamiento (Figura No. 1).
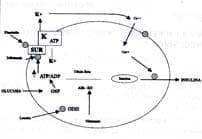
Figura No. 1 Regulación de la secreción de insulina en la célula beta del páncreas. Consultar con el texto Claves SUR= receptor de sulfonilurea; K=potasio; GK= glucosa cinasa; GDH= glucosa deshidrogenasa, alfa; K ATP= conducto de potasio activado por ATP. Tomado de Stanley Charles. Hiperinsulinismo en lactantes y niños4
8.2. Formas Adquiridas y Genéticas del Hiperinsulinismo en Neonatos y Lactantes
8.2.1 Hiperinsulinismo Transitorio – Hijo de Diabética
La diabetes mal controlada en la gestante expone al feto a niveles excesivamente altos de glucosa, con lo cual surge hiperinsulinismo en el neonato y se produce un crecimiento excesivo; los lactantes en cuestión, de manera típica, son grandes para la edad gestacional y están expuestos al gran peligro de mostrar hipoglicemia inmediatamente después de nacer. Se les debe pasar infusión de dextrosa, a veces continua, durante dos a cuatro semanas de vida, pero después al parecer muestra resolución completa4. Por costumbre se han utilizado, en esta situación, dosis altas de glucocorticoides, pero no han sido muy eficaces. El diazóxido suprime de manera especifica la liberación de insulina y es eficaz en dichos lactantes.
8.2.3 Hiperinsulinismo Congénito
El hiperinsulinismo persistente en el lactante, además de su relación muy frecuente con anormalidades difusas de la regulación de las células beta en todo el páncreas a veces lo hace con la enfermedad focal, como sería un adenoma insular aislado.
En el pasado se aplicó, a grupos no focales del trastorno, términos como nesidioblastosis. En el presente se prefiere llamar Hiperinsulinismo congénito4.
8.2.3.1. Hiperinsulismo Hereditario
Es la forma más común de hiperinsulinismo congénito4.
Es causado por defecto genético en el receptor de sulfonilurea (SUR) y en los conductos de potasio (KATP)4.
El trastorno se identificó por primera vez por estudios de ligamiento de familias con dos o más hijos afectados, los que señalaron que el gen estaba en el brazo corto del cromosoma 11. Se ha hecho cartografía genética del SUR y, en fecha reciente, del conducto de potasio(KATP) de células B, en la misma región cromosómica4.
Los signos aparecen desde el período neonatal, con un niño grande para la edad gestacional y en término de 1-2 dias, comienzan las manifestaciones sintomáticas de la hipoglicemia, las cuales son de difícil control y se necesitan infusiones de dextrosa de 15-20 mg/Kg/min. El diazóxido es ineficaz (se necesita que el receptor de sulfonilurea sea normal). Se obtienen resultados parciales tras administración de octreótido. Pero muchos de estos lactantes necesitan tratamiento quirúrgico y en el 95% de los casos PANCREATECTOMIA SUBTOTAL4.
8.2.3.2. Hiperinsulinismo Autosómico Dominante
Se desconoce cuál es el locus genético.
El cuadro clínico es menos grave.
A pesar de que unos cuantos casos han surgido desde el período neonatal, muchos niños no son grandes al nacer para la edad gestacional y otros más, no han tenido hipoglicemia sintomática hasta fecha ulterior en la niñez(6 meses o más) o en la vida adulta4.
Todos los casos señalados han reaccionado extraordinariamente a la dieta y al diazóxido4.
8.2.4. Síndrome de Hiperinsulismo – Hiperamonemia
Es una forma intermedia entre el hiperinsulinismo recesivo y el dominante; dichos pacientes presentan incrementos leves y persistentes del amonio en sangre hasta 100-200 Mcrmol/l (3-6 veces lo normal)4. El hiperinsulinismo hiperamonemia es asintomático4. Se supone que el trastorno es genético4. Los pacientes responden al diazóxido o a la dieta sola.
8.2.5. Hiperinsulimso Farmacoinducido
Puede surgir como consecuencia de aplicación de insulina exógena4. Es rara la inyección de insulina en el niño no diabético, a veces es parte del llamado SíNDROME DE MUNCHAUSEN en el cual se administra al niño insulina por parte de parientes o los padres.
Diagnóstico Del Hiperinsulinismo
La historia clínica es fundamental5.
Tener en cuenta la edad del inicio y la relación con el ayuno5.
9.1 Criterios Diagnósticos del Hiperinsulinismo
9.1.1. Rápido inicio de síntomas, luego de cortos períodos de ayuno, cuando la madre deja de darle leche materna.
9.1.2. Altas infusiones de glucosa (mayores de 12 mg/Kg/min).
9.1.3. Ausencia de cetonemia, cetonuria y acidosis al momento de la hipoglicemia.
9.1.4. Incremento de la glicemia mayor de 30 mg/dl sobre el nivel basal, luego de la administración de glucagón.
9.1.5. Insulina mayor de 5-10 Micro U/ml concomitante con una glicemia menor de 40 mg/dl.(debido a la corta vida media de la insulina, 1.25 minutos, su determinación al azar, no es de utilidad)5.
9.1.6. Relación insulina/glicemia mayor de 0.4, se debe realizar durante varias oportunidades.
9.1.7. Cortisol mayor 12 Ug/dl, concomitante con una cifra baja de glicemia.
9.1.8. Hormona de crecimiento mayor de 10 ng/ml.
9.1.9. Prueba de glucagón. Se administra 1 mgr de glucagón.
9.1.10. prueba con somatostatina(octreotido). Se administra 10 Mcrgr/Kg SC de octreótido.
La escanografía y lan resonancia magnética abdominal no tienen valor diagnóstico.
Caso Clínico No. 1
Lactante de 3 meses, ingresa al hospital de la Misericordia, por cuadro de 3 horas de evolución, de palidez mucocutanea, diaforesis, hiporexia y emesis, la madre toma glucometría de 43 mg/dl, por lo cual consulta.
ANTECEDENTES: producto de tercera gestación, con diagnóstico a las 34 semanas de polihidramios, se realiza cesarea en el hospital de Kennedy, previa maduración pulmonar a las 36 semanas de gestación. Peso: 3600gr, talla: 54 cms. Paciente presenta deterioro respiratorio en la primera hora de vida, presenta paro cardiorespiratorio. Recibió apoyo inotrópico y ventilación mecánica. Se hizo diagnóstico de hipoglicemia, la cual se maneja con infusiones de dextrosa. El paciente persiste con cifras bajas en la glucometría, presenta crisis convulsiva el décimo día de vida postnatal, se halla glucometría de 10 mg/dl. Por lo cual es remitido.
EXAMEN FISICO: Peso:5500 gr, FC:148xmin, FR: 32xmin, epicanto, puente nasal ancho, hipertelorismo, no se encontraron visceromegalias, pliegues simianos en palmas de manos.
Se maneja en el servicio de lactantes con infusiones altas de glucosa hasta de 12 mg/kg/min. Se disminuye paulatinamente flujo metabólico y se administra dieta vía oral, más almidón crudo (1gr/Kg/día). Se logra control satisfactorio con este manejo, se retiran líquidos endovenosos y se adiciona diazóxido.
PARACLÍNICOS: Datos de insulina y glucosa con hipoglicemia: 9, am.: insulina: 12, glicemia:42 (relación/Ins/glicemia:= 28); 10 a.m., insulina: 15.4, glicemia: 36 (relación ins/glicemia:O.4), cortisol: 54 mg/ml, hormona crecimiento: 14.7 ng/ml, ácido láctico: 2.69 mmol/l, ácido pirúvico: 0.71 mmol/l, difenhidracina:negativo, cloruro férrico: negativo, nitroprusiato:negativo, nitrasonaftol: negativo, cromatografía de aminoácidos en orina; normal, en sangre:normal. T3:2.6 ng/ml,T4:14.6, TSH:4.07 Ul/mol.
Cetonemia y cetonuria:negativos.
Tratamiento del Hiperinsulinismo
El manejo debe ser multidisciplinario(pediatra, endocrinólogo, especialista en enfermedades metabólicas, nutricionista y cirujano pediatra).
El hiperinsulinismo es LABORATORIO DEPENDIENTE, se deben hacer los exámenes paraclínicos lo más rápido posible, entre más rápido se llegue al diagnóstico mejor para el paciente, para que no se complique durante una larga estancia hospitalaria.
Si el paciente llega convulsionando se coloca bolo de DAD 10% 300 mg/Kg en media hora y luego se siguen infusiones de dextrosa de 6 mg/Kg/min y se continúan aumentando a 8- 10- 12 y 15 mg/Kg/min (estas últimas requieren catéter venoso central).
11.1. Manejo Farmacológico
11.1.1. Diazóxido (PROGLYCEM)
Es un derivado benzotiadiazina, antihipertensor y antidiurético, con potentes acciones hipoglicemiantes, cuando se administra por vía oral8.
MECANISMO DE ACCIÓN: Inhibe el receptor de sulfonilureas (SUR) bloqueando la secreción de insulina8.(Figura No 1).
Administrado oralmente produce un pronto incremento en los niveles de glucosa, comienza a la hora y generalmente no más de 8 horas, en presencia de función normal8.
USOS TERAPÉUTICOS: Útil en niños con Hiperinsulinismos debidos a nesidioblastosis (Grant y col) y también en niños con insulinomas inoperables8.
DOSIS: 8-15 mg/kg/día, 3 dosis.8
La dosis debe ser individualizada , basada en la severidad de la hipoglicemia y en la respuesta clínica del paciente; iniciar preferiblemente con 3mg/kg/día.
PRESENTACIÓN COMERCIAL: PROGLYCEM suspensión 50 mg/cc.
EFECTOS SECUNDARIOS: retención de sodio y líquidos, hiperuricemia, hipertricosis, trombocitopenia, leucopenia, hiperglicemia,efectos gastrointestinales (nauseas,diarrea), hipotensión ocurre ocasionalmente8.
ALTERACIONES INFRECUENTES: rubor, dolor e inflamaciion local, alteraciones del gusto y del olfato, salivacion excesiva y disnea8.
11.1.2. Somatostatina:
Si bien se describió inicialmente como una sustancia hipotalámica que inhibe la liberación de la hormona del crecimiento, en la actualidad está claro que la somatostatina también se encuentra en otros tejidos, como el tubo digestivo y el páncreas, donde inhibe la liberación de ciertas hormonas gastrointestinales y pancreáticas (como la insulina)9.
OCREÓTIDO(SANDOSTATIN): un análogo de la somatostatina aprobado para su uso por la food and drug adminstration(FDA de USA). Este tiene una vida media más prolongada que la somatostatina, y cuando se interrumpe su administración, no hay hipersecreción de rebote de hormona de crecimiento9.
MECANISMO DE ACCION: suprime la secreción de Insulina en un punto más bajo de la vía metabólica a nivel de la liberación de insulina mediada por calcio9.(Figura N° 1)
USOS TERAPÉUTICOS: bloquea la liberación de hormona en neoplasias secretoras de sustancias endocrinas entre ellas: INSULINOMAS, GLUCAGONOMAS, TUMORES CARCINOIDES Y SOMATOTROPINOMAS9.
MAS.
DOSIS:10 Mcrg/K,c/8H.Subcutanea9.
PRESENTACIÓN COMERCIAL: SANDOSTATIN Amp 0.1 mg/ml y o.5 mg/ml.
EFECTOS SECUNDARIOS: diarrea, malabsorción, náuseas y flatulencias; anormalidades de la vesícula biliar (cálculos y sedimento biliar) y ritmos cardíacos anormales9.
11.1.3. Nifedipina en el Tratamiento de Hipoglicemia Hiperinsulinémica de Persistente
El Dr. Eichman D, Hufmagel M, Quick P, Santer R del hospital Universitario Pediátrico Schwanenweg Alemania, reportaron tratamiento de hipoglicemia hiperInsulinémica persistente, con dosis orales de nifedipina de 0.7- 2 mg/Kg/día, y tuvieron un significativo efecto clínico10.
En uno de los casos la monoterapia con nifedipina previno la hipoglicemia10.
En el segundo caso, la nifedipina, redujo las dosis y los efectos secundarios de otras sustancias y consecuentemente la terapia quirúrgica10.
11.2. Tratamiento Dietariio del Hiperinsulinismo
Se realizó con dos objetivos: primero con fines nutricionales, para el cual se ofreció la alimentación para la edad y el segundo con el fin de contribuir en la regulación de la glicemia, utilizando una dispersión en agua de almidón de maíz crudo, en cantidades de 5-7g/Kg/dia (en 1 onza de agua 1medida de almidón de maíz de 5 gramos) repartido en ocho tomas 1 toma cada 3 horas e intercalado con la alimentación láctea; el consumo del almidón se dificultó por el sabor, por lo cual hubo la necesidad de administrarlo por sonda, teniendo el cuidado de irrigar la sonda una vez se administra, para evitar su adherencia a las paredes al perder el agua y asi obstruirla fácilmente.
El almidón en los cereales y en los vegetales se deposita en los amiloplastos de la célula, éstos a su vez forman el gránulo de almidón que, para cada planta, tiene tamaños característicos; estos gránulos para la mayoría de las plantas constan de 1/3 parte de amilosa y 2/3 partes de amilopectina proporción que depende, en cada planta, de la disponibilidad enzimática para la síntesis de enlaces 1-4 ó 1-612. La amilosa está formada por residuos de glucosa unidos en forma lineal por enlaces alfa 1-4 y la amilopectina tiene cadenas lineales con ramificaciones cada 15 a 30 residuos de glucosa, unidas por enlaces alfa 1-6 y que les dan el efecto de arbusto y tiende a hacerlas menos dispersables en el agua.
La extracción del almidón para cada planta amerita un proceso tecnológico que garantice el rompimiento del gránulo y la liberación del almidón de la proteína y del germen. Comercialmente disponemos de almidón de maíz, almidón de yuca y almidón de arroz, éstos dos últimos tienen un sabor poco aceptado en la alimentación, por lo cual ha sido más utilizado el primero.
La hidrólisis enzimática del almidón se inicia con la acción de la amilasa salival, cuyo pH óptimo es 6.9 con inactivación a pH 4, lo que le permite actuar muy bien en el lactante, quien mantiene acidez gástrica post- prandial poco marcada. La leche materna contiene una amilasa resistente a la digestión gástrica la cual actúa en el intestino delgado, es similar a la amilasa salival y su actividad disminuye con el tiempo, pero es comparable con la actividad de la amilasa pancreática producida a los 6 meses de edad; estas dos enzimas le permiten al lactante pequeño tolerar ingestas de almidón de 5.5-6g/Kg/dia. La amilasa salival y la pancreática son alfa-amilasas, que desdoblan el almidón en los enlaces alfa 1-4, produciéndose así maltosa y maltotriosa y muy poca glucosa. La amilasa no se fija en los enlaces alfa 1-6 de la amilopeptina y tiene poca especificidad por los enlaces alfa 1-4 situados cerca de las ramificaciones alfa 1-6.
Entonces la digestión de la amilopectina resulta no solo en maltosa y maltotriosa, sino en polímeros de glucosa que incluyen los enlaces de ramificación alfa 1-6 también llamadas dextrinas alfa limite / 8 mol de glucosa con 1 o más enlaces alfa1-6 y que son 1/3 de los productos de la digestión del almidón en el duodeno. Procedentes de los extremos no reductores, se desdoblan por la glucoamilasa y la sacarasa13. Esto nos permite conocer la disponibilidad enzimática en el tubo digestivo humano. Ahora veamos lo que se sabe sobre la digestibilidad del almidón de las diferentes fuentes dietarias.
La opinión acerca del concepto de la biodisponibilidad del almidón de los vegetales que consumimos ha cambiado dramáticamente en la última década. El conocimiento presente sugiere que el almidón de las diferentes fuentes alimentarias difiere considerablemente con relación tanto a la velocidad y magnitud en que es captado por el intestino humano14-15. La antigua opinión de que el almidón estaba completamente disponible para su absorción en el intestino delgado ha cambiado16-17. El aspecto nutricional de cuantificar cuanto almidón no es digerido y a qué pérdida calórica corresponde, quizás no es lo importante, si no más bien los conceptos que de aquí se derivan, como la selección de los alimentos fuentes de almidón que son digeridos y absorbidos lentamente, en el manejo dietario de ciertas condiciones como el caso que aquí nos ocupa.
Existen mecanismos asociados con el aumento de la biodisponibilidad del almidón como el grado de gelatinización, que es un fenómeno físico observado durante el tratamiento térmico del alimento en presencia de un exceso de agua, y que sucede en la mayoría de los procesos tecnológicos a que son sometidos los almidones antes de su consumo. El grado de gelatinización difiere de acuerdo con el tipo de proceso y las condiciones de procesos empleados; se conoce desde hace mucho tiempo que los gránulos crudos de almidón son atacados lentamente por las amilasas invitro y que el tratamiento térmico aumenta la biodisponibilidad18. En un sistema invitro de evaluación de la digestibilidad del almidón en diferentes productos, usando alfa- amilasa pancreática, se usó la suspensión de harina de trigo hervida como control. El almidón en forma de harina cruda fue extremadamente poco susceptible a la alfa-amilasa pancreática19, en contraste los productos altamente gelatinizados fueron altamente disponibles, mientras que un producto parcialmente gelatinizado (GG46%) se hidrolizó a una velocidad significativamente lenta. La respuesta glicémica post- prandial en ratas, administrados los almidones por intubación, también mostró diferencias importantes:
El almidón crudo no solo mostró una respuesta metabólica reducida sino también retardada, cuando se comparó con los productos procesados con moderados y altos grados de gelatinización.
Sin embargo, a diferentes grados de gelatinización no se evidenciaron diferencias significativas entre dos productos, lo que puede evidenciar que hay otros factores que pueden alterar la respuesta glicémica.
Si bien el procesamiento de los cereales aumenta la biodisponibiidad, pueden ocurrir algunos fenómenos que reducen la susceptibilidad a las amilasas, por ejemplo la presencia de complejos entre el almidón nativo y los lípidos, el fenómeno de retrogradación que ocurre con el almacenamiento en frío de los productos previamente gelatinizados, así como la presencia de otros productos como la fibra dietaria y la presencia de antinutrientes (ácido fítico, polifenoles, lecitinas, catequina y el ácido tánico).
Las experiencias clínicas en pediatría con el uso de almidón de maíz crudo, se refieren a su uso en niños con glucogenosis tipo I en quienes se ha reportado que administrado en dosis de 1.5-2 gr /kg/día puede mantener la glicemia normal entre 4-10 horas, obviamente con la necesidad de alimentar al niño cada 2 horas. Este modelo ha sido empleado en niños mayores de 2 años; este grupo considera que en niños menores solo se ha reportado éxito con dosis menores y más frecuentes20.
Para aumentar la palatibilidad del almidón de maíz crudo, se puede mezclar con diferentes bebidas como leche, refrescos de frutas, bebidas carbonatadas o con alimentos fríos como helados, yoghurt o puré de frutas. Algunos estudios han reportado que la mezcla de este almidón con bebidas azucaradas lo hace menos efectivo.
Recomienda el grupo inglés que, cuando se inicie el tratamiento, se deben hacer pruebas en ayuno con el almidón y en condiciones controladas hospitalarias, para valorar en el niño la respuesta metabólica con mediciones seriadas de glicemia y lactato. Con estos resultados se establece la cantidad y frecuencia de suministro.
Antes de que sea instituido como manejo ambulatorio se debe valorar palatibilidad y aceptación. Algunos pacientes pueden experimentar efectos colaterales como: diarrea, distensión abdominal, flatulencia, pero estos síntomas son transitorios generalmente. En los niños las alimentaciones nocturnas se mantienen hasta que hayan dejado de crecer, la principal dificultad es interrumpir el sueño del niño.
11.3. Tratamiento Quirúrgico del Hiperinsulinismo
El tratamiento quirúrgico tiene sus indicaciones precisas en los pacientes con Hiperinsulinismo, la cirugía recomendada es la PANCREATECTOMIA DEL 95%11. Consiste en resecar el páncreas dejando solamente la glándula subyacente entre el conducto biliar común y el duodeno y un pequeño borde del páncreas a lo largo de la extensión del duodeno.
INDICACIONES: los pacientes con Nesidioblastosis (síndrome de dismaduración de las células de los islotes) y los pacientes con receptor alterado de sulfonilurea, no responde a la dieta ni al diazóxido, ni al octreótido y son quirúrgicos.
El 82% de los pacientes que se operan muestran una lesión histopatológica focal y solamente el 33% mostraron una lesión difusa11.
La complicación postquirúrgica más importante es la diabetes mellitus, se desarrolla en el 14% de los operados, los cuales tienen una lesión histopatológica difusa11.-
Bibliografía
1. Cornblath M.,Schwartz R.Carbohidrate metabolism in the neonate,Philadelphia.W.B. Sawnders 1996.
2. LaFranchi Stephen. Hipoglicemia durante la lactancia y la niñez. Clinicas Pediátricas,volumen de endocrinología 1987:1017-50.
3. Guyton A. Tratado de Fisiología médica,8ºedición. Editorial McGraw Hill Interamericana 1992.
4. Stanley Charles. Hiperinsulinismo en lactantes y niños. Clinica Pediatrica Norteamerica. No 2. Endocrinología 1997: 385-95.
5. Correa J., Gomez J, Posada R.Fundamentos de Pediatría. Hipoglicemia postneonatal 1514-9.
6. Eichman D, Hufnagel M., Quick P y Santer R. Treatment of Hyperinsulinaemic hypoglycaemia with nifedipine. European journal of Pediatrics. 1999; 158: 204-6
7. Sperling M.Hypoglycemia in the Infant and Child: 693-713.
8. Goodman A, Hartman J. Las Bases Farmacológicas de la terapéutica. Mcgraw Hill. Interamericana Editores. México 8º Edición, 1996: 855-6,1609.
9. Goodman A., Hartman J. Las Bases farmacológicas de la terapéutica. Mcgraw Hill. Interamericana Editores. México 8º Edición, 1996: 1453-4.
10. Eichmann D, Hufnagel M.,Quick P., Santander R. Treatment of hyperinsulinaemic hypoglycaemia with nifedipine.European journal of Pedatrics 1999;158:204-6.
11. Lovvorn H.,Nance M.,Ferry R and col.Congenital hyperinsulinism and the surgeon: lessons learned over 35 years.J Pediatr Surg 1999;
12. Charley,H.Tecnología de alimentos. Procesos físicos y químicos en la preparación de alimentos.Editorial Limusa.1987:174-87.
13. Rojas M.,Guerrero R.Nutrición clínica y Gastroenterología Pediatrica. Editorial Panamericana.1999:30-1.
14. Jenkins D.,Wilover T and col.Glicemic index of foods:a physiological basis for carbohydrate exchange. Am. J Clin Nutr 1981;34:362-6.
15. Levitt A, Malabsorption of starch: A normal phenomenon. Gastroent 1983; 85: 769-70.
16. Stephen A, Haddad A, Phillips S. Passage of carbohydrate into the colon. Direct measures in humans. Gastroent 1983;85:589-95.
17. Jenkins D,Cuff D, Wolever T, knowland D and col.Digestibility and glicemic response. Am J Clin Nutr 1986;43:210-2.
18. Noble I, Dean M, Wing M, Halliday E. In vitro digestion of starch of long and short cook cereals. Cereal chem 1993;10:243-4.
19. Holm J., Bjorck I, Sjoberg L.and col.Starch availability in vitro and in vivo after flaking, steam-cooking and popping of wheat. J Cereal Sci 1985;3:193-206.
20. Shaw, Lawson V. Clinical Pediatric Dietetics.1st edition .Pediatric group of the British Dietetic Association, Blackwell Scientific Publication, oxford, 1994. 34:786-92.