Estudios en animales.
Los experimentos con varios dipéptidos que contenían tirosina, cistina y glutamina arrojaron evidencia convincente de que estos sustratos son de fácil disponibilidad y que sus aminoácidos constituyentes se incorporan instantáneamente en las diversas proteínas tisulares.(31-36)
Después de inyectar un bolo o en condiciones de nutrición parenteral total (NPT) continua. Estos péptidos suministran tirosina, cistina y glutamina, respectivamente, para mantener sus depósitos intra o extracelulares.(31-35,37,38)
La nutrición parenteral con dipéptidos promueve el crecimiento y la retención del nitrógeno.(39-44)
La alanilglutamina administrada por vía intravenosa reduce la pérdida de glutamina en los músculos durante el estrés(45) y previene la atrofia de la mucosa intestinal en las ratas alimentadas por vía parenteral.(46)
Estudios en seres humanos.
Los estudios con animales de experimentación son quizás menos adecuados para investigar el metabolismo de los aminoácidos en las células debido a las diferencias en la distribución intracelular de los aminoácidos en el músculo humano comparado con el animal.(45,47,48)
Por lo tanto, es necesario hacer estudios en seres humanos para evaluar la eficacia y la seguridad de los péptidos de cadena corta y para determinar si su administración por vía intravenosa influye de manera favorable sobre la economía global del nitrógeno en los pacientes o si conlleva algún otro beneficio clínico.
Voluntarios sanos.
Los estudios cinéticos han demostrado que la alanil-glutamina,(49) la glicil-tirosina(49) y la alanil-tirosina,(50) se hidrolizan rápidamente tras ser inyectados en bolo; la vida media de eliminación oscila entre 3,8 y 5,8 minutos (tabla 2).
El volumen aparente de distribución fue cercano a los 12L, lo cual corresponde al compartimento extracelular.
Tabla 2. Valores cinéticos para L-alanil-L-glutamina (Ala-Gln), glicil-L-tirosina (Gly-Tyr), y L-alanil-L-tirosina (Ala-Tyr).
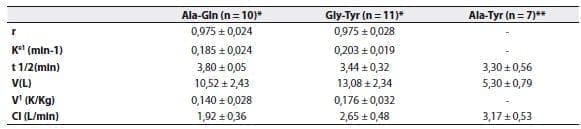 Los valores corresponden a la media + SD. r2, coeficiente de determinación; Ke1, constante de la tasa de eliminación; t1/2, vida media
Los valores corresponden a la media + SD. r2, coeficiente de determinación; Ke1, constante de la tasa de eliminación; t1/2, vida media
de eliminación; V, volumen de distribución; V1, coeficiente de distribución; Cl, depuración plasmática.
* Datos adaptados de Albers y colaboradores(49)
** Datos adaptados de Druml y colaboradores(50)
± alt + 0177
I = alt ± -134
La infusión continua de una solución comercial de aminoácidos suplementada con los dos dipéptidos sintéticos no produjo efectos secundarios y tampoco dio lugar a quejas.(51)
Como resultado de la infusión de la solución suplementada con los péptidos hubo un incremento rápido de las concentraciones plasmáticas de alanina, glutamina, glicina y tirosina.
Durante todo el periodo de infusión solamente se pudieron medir trazas de los dipéptidos en el plasma. Puesto que los valores estaban justo sobre el límite de detección.
Puesto que no se detectó ninguno de los dipéptidos en la muestra de orina tomada a las 6 horas, los resultados apuntaron hacia una hidrólisis “casi cuantitativa” de los péptidos infundidos e indicaron la utilización posterior de los aminoácidos libres. No se observaron cambios apreciables en las concentraciones de glutamina libre durante la infusión de la solución isonitrogenada de control, pero sí se observó una disminución continua de los niveles de tirosina.
Estos resultados se han confirmado por medio de estudios cinéticos(52,53) y en otras investigaciones en las cuales se demostró en voluntarios sanos la utilización eficiente de una solución basada en un dipéptido glicílico.(54) Loch y sus colaboradores estudiaron recientemente la eliminación orgánica de los dipéptidos con contenido de glutamina en seres humanos postabsortivos y emaciados.(55,56)
Péptidos infundidos se hidrolizan
Estos resultados destacan el hecho de que los péptidos infundidos se hidrolizan fácilmente en los seres humanos.
Los valores que reflejan una vida media de eliminación excesivamente corta, unas tasas excepcionalmente altas de depuración de los péptidos y también la disponibilidad rápida de los aminoácidos libres constituyentes indican que los péptidos son asimilados con eficacia.
Los resultados indican que la alanil-glutamina, la glicil-tirosina y otros dipéptidos sintéticos se pueden utilizar con eficiencia y seguridad como fuente de aminoácidos libres (glutamina, tirosina y otros) en el contexto de la nutrición parenteral.
Pacientes catabólicos.
Como se mencionó anteriormente, el agotamiento profundo de la glutamina intracelular es característico de las condiciones de trauma o de otros tipos de hipercatabolismo.(15)
Dos observaciones recientes sugieren que la glutamina participa en la regulación del balance proteico en los músculos: la asombrosa correlación directa entre la glutamina muscular y la tasa de la síntesis proteica,( 57) y el efecto positivo de la glutamina sobre los procesos de anabolismo proteico in vitro.(58,59)
Si manteniendo los depósitos de intracelulares de glutamina es posible promover la conservación de la proteína muscular.(57,59) Existe una indicación lógica para suplementar con glutamina la alimentación parenteral de los pacientes traumatizados e infectados.
Su inestabilidad en las soluciones acuosas hace imposible agregarla a las preparaciones existentes. Este obstáculo se podría superar por medio de dipéptidos sintéticos que contengan glutamina.
La infusión durante 5 días de una solución de Nutrición parenteral Total (NPT) suplementada con alanil-glutamina y glicil-tirosina en pacientes sometidos a cirugía electiva mayor permitió mejorar el balance de nitrógeno en el postoperatorio, en comparación con los controles que recibieron NPT isonitrogenada e isoenergética sin los péptidos(60) (figura 1).
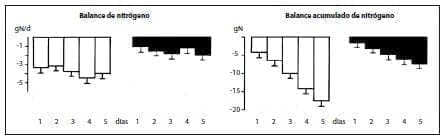
Figura 1. Balance diario y acumulado del nitrógeno (media + SEM, n = 6) en pacientes que recibieron Nutrición parenteral Total (NPT) convencional (columnas abiertas) o suplementada con alanil-glutamma (280 mg/kg de peso corporal por día) y gliciltirosina (50 mg/kg de peso corporal por día; columnas negras), después de cirugía electiva. ***p < ,00l: **< ,01.
Este mejor equilibrio del nitrógeno estuvo Asociado con el mantenimiento de los depósitos intracelulares de glutamina, los cuales disminuyeron marcadamente en los pacientes de control en comparación con sus valores preoperatorios (figura 2A).
Las concentraciones de tirosina en los músculos disminuyeron cuando no se suplementó con glicil-tirosina, mientras que los valores intracelulares mejoraron cuando se administraron los péptidos (figura 2B).
Los péptidos no pudieron detectarse ni en el plasma ni en el músculo, y no hubo diferencia en las concentraciones plasmáticas de los aminoácidos constituyentes entre los dos grupos de tratamiento.
No se observaron efectos secundarios como consecuencia de la infusión de las soluciones, y la recuperación postoperatoria fue normal en todos los pacientes.
La administración intravenosa de alanil-glutamina después de colecistectomía contribuyó a preservar los depósitos de glutamina intracelular (91% del valor preoperatorio) y se eliminó el cambio característico en el perfil de los ribosomas musculares.(61)
Barua y colaboradores informaron haber obtenido efectos benéficos con la infusión a corto plazo de alanil-glutamina sobre la síntesis proteica en los músculos, evaluada con base en la incorporación del [13C] leucina en pacientes postquirúrgicos a quienes se les administró nutrición parenteral sin glutamina.(62)
En pacientes en estado crítico no se logró influir de manera apreciable sobre la concentración intracelular de glutamina en los músculos administrando diariamente cerca de 20 g de alanil-glutamina (13 g de glutamina).(63,64)
Sin embargo, el balance acumulado del nitrógeno fue mucho mejor en el grupo de quienes recibieron los péptidos, y mejoró los días 1 y 2 (figura 3).
 Figura 2. Concentraciones de glutamina (A) y tirosina (B) en las células musculares (medias + SEM, n = 6 en controles y en pacientes que recibieron NPT suplementada con alanil-glutamina (280 mg/kg de peso corporal por día) y glicil-tirosina (50 mg/kg de peso corporal por día), icw, agua intracelular; OP, operatorio. *p <,05; ***p < ,001.
Figura 2. Concentraciones de glutamina (A) y tirosina (B) en las células musculares (medias + SEM, n = 6 en controles y en pacientes que recibieron NPT suplementada con alanil-glutamina (280 mg/kg de peso corporal por día) y glicil-tirosina (50 mg/kg de peso corporal por día), icw, agua intracelular; OP, operatorio. *p <,05; ***p < ,001.
 Figura 3. Balance diario y acumulado del nitrógeno (medias + SEM, n = 6) en pacientes en estado crítico que recibieron NPT convencional (columnas abiertas) o suplementada con péptidos (270 mg de alanil-glutamina por kilogramo de peso corporal por día; columnas negras). *p < ,05; **p < ,01.
Figura 3. Balance diario y acumulado del nitrógeno (medias + SEM, n = 6) en pacientes en estado crítico que recibieron NPT convencional (columnas abiertas) o suplementada con péptidos (270 mg de alanil-glutamina por kilogramo de peso corporal por día; columnas negras). *p < ,05; **p < ,01.
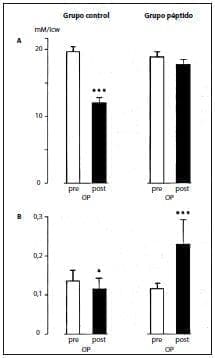 Figura 2. Concentraciones de glutamina (A) y tirosina (B) en las células musculares (medias + SEM, n = 6 en controles y en pacientes que recibieron NPT suplementada con alanil-glutamina (280 mg/kg de peso corporal por día) y glicil-tirosina (50 mg/kg de peso corporal por día), icw, agua intracelular; OP, operatorio. *p <,05; ***p < ,001.
Figura 2. Concentraciones de glutamina (A) y tirosina (B) en las células musculares (medias + SEM, n = 6 en controles y en pacientes que recibieron NPT suplementada con alanil-glutamina (280 mg/kg de peso corporal por día) y glicil-tirosina (50 mg/kg de peso corporal por día), icw, agua intracelular; OP, operatorio. *p <,05; ***p < ,001.
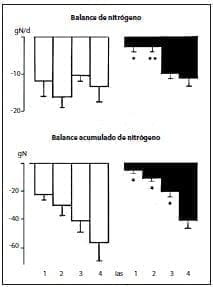 Figura 3. Balance diario y acumulado del nitrógeno (medias + SEM, n = 6) en pacientes en estado crítico que recibieron NPT convencional (columnas abiertas) o suplementada con péptidos (270 mg de alanil-glutamina por kilogramo de peso corporal por día; columnas negras). *p < ,05; **p < ,01.
Figura 3. Balance diario y acumulado del nitrógeno (medias + SEM, n = 6) en pacientes en estado crítico que recibieron NPT convencional (columnas abiertas) o suplementada con péptidos (270 mg de alanil-glutamina por kilogramo de peso corporal por día; columnas negras). *p < ,05; **p < ,01.
[enc_su_spacer]
Peterson y sus colaboradores estudiaron el efecto postoperatorio a largo plazo de la Nutrición parenteral Total (NPT) suplementada con glicil-glutamina sobre los perfiles de los ribosomas musculares y observaron que las alteraciones eran menos profundas que en los controles.(65) Más importante aún es la observación de Tremel y sus colaboradores en el sentido de que la nutrición parenteral suplementada con glutamina puede evitar la respuesta atrófica de los intestinos asociada con la Nutrición parenteral Total (NPT) en los pacientes de cuidados intensivos.(66)
(Lea También: Dinámica de los Péptidos in Vivo )
Interpretación de los resultados clínicos.
Estudios realizados recientemente en animales han demostrado que el consumo de glutamina en el tracto intestinal aumenta notablemente cuando hay catabolismo.(67-69)
Extrapolando a partir de los datos experimentales, se trata aproximadamente de 10 a 14 g de glutamina al día en un paciente de 70 kg.(67)
Incluyendo la absorción de cerca de 4 g de glutamina al día por parte del riñón del perro(69) y considerando la glutamina que necesitan diariamente las células de proliferación rápida.(70,71) El influjo total de glutamina podría ser de 14 a 20 g/día.
Durante el estrés, el valor reportado de la glutamina que sale del músculo varía entre 9 y 13 g/día, dependiendo de la severidad del estímulo catabólico.(67,68) Se calcula que el consumo de glutamina supera a la liberación en 5 ó 6 g/ día.
Esta cifra concuerda con el grado de agotamiento de la glutamina en el tejido muscular de nuestros pacientes quirúrgicos tratados con Nutrición parenteral Total (NPT) convencional durante un periodo de 3 días.(60)
Así, al administrar cerca de 13 g de glutamina al día en forma del dipéptido alanil-glutamina casi se eliminó el agotamiento de este aminoácido en el tejido muscular y mejoró notablemente el balance de nitrógeno.(60)
Estos resultados sugieren que es posible suplir la mayor demanda celular de combustible metabólico y las necesidades intestinales de los pacientes quirúrgicos mediante la administración diaria de unos 13 g de glutamina al día.
Por otro lado, la misma cantidad de alanil-glutamina (20 g/día) no influyó sobre los depósitos intracelulares de glutamina libre en los casos de trauma accidental severo, aunque sí mejoró la economía del nitrógeno en la fase posterior al trauma.(63,64)
Por lo tanto, la mayor necesidad intestinal y la demanda celular de combustible metabólico se compensan en parte, pero no se satisfacen totalmente en estos pacientes.
Pacientes sometidos a transplante de médula ósea
Wilmore y sus colaboradores obtuvieron resultados muy semejantes suplementando con 20 g de glutamina al día la nutrición de pacientes sometidos a transplante de médula ósea y a irradiación de todo el cuerpo.(72)
El balance de nitrógeno mejoró solamente durante los primeros días del estudio, después de los cuales hubo un deterioro constante de la retención.
Sin embargo, cuando se administraron 40 g de glutamina al día se prolongó ese efecto benéfico durante todo el estudio.(73)
Este estudio ciego controlado sugiere que la nutrición parenteral suplementada con glutamina reduce de manera significativa la morbilidad hospitalaria en comparación con la alimentación convencional sin glutamina.
Contrario a lo anterior, no se observó efecto alguno sobre el metabolismo y el resultado cuando se añadieron 20, 40 ó 60 g de alanil-glutamina a la Nutrición parenteral Total (NPT) de los pacientes con pancreatitis aguda.(74-76)
Todos estos pacientes gravemente enfermos llegaron al hospital con concentraciones muy bajas de glutamina intracelular (2,8 a 6,6 mmol/L de agua intracelular).
Sería tentador especular si la capacidad para utilizar los sustratos se limita seriamente durante las enfermedades críticas.
Es bien sabido que la utilización de los sustratos depende en últimas de la viabilidad celular y es limitada cuando los niveles de energía libre son bajos.(77)
De acuerdo con la hipótesis original, la función de la glutamina intramuscular era suministrar carbono y nitrógeno al hígado. Y cualquier déficit de glutamina podría limitar estos procesos hepáticos durante el estrés catabólico.(15,78,79)
Considerando lo que sabemos hoy, sería necesario revisar esta hipótesis. La glutamina es en primer lugar un nutriente indispensable para el mantenimiento normal de la mucosa intestinal( 16) y, supuestamente, de las células proliferantes.( 70,71)
El supuesto aumento de la necesidad que tiene el intestino de combustible metabólico durante el estrés podría ir de la mano con una mayor demanda de glutamina en los músculos. Lo cual agotaría la glutamina intracelular.
Este razonamiento lleva a la conclusión de que es esencial administrar cantidades adecuadas de glutamina para mantener la mucosa y las células en rápida proliferación.
Para preservar el depósito de glutamina muscular y para mejorar la economía general del nitrógeno durante las condiciones de estrés.
Uso de dipéptidos con contenido de glutamina.
La mayor preocupación con respecto a utilizar glutamina libre como lo hizo Wilmore en algunos estudios(80,81) es la dificultad de hacerlo de rutina en la clínica.
Debido a la inestabilidad de la glutamina libre en soluciones acuosas (formación de ácido piruglutámico y amoníaco). Las soluciones de NPT que contienen glutamina deben prepararse frescas en condiciones asépticas estrictas y almacenarse a 4 °C como lo recomiendan Khan y sus colegas.(82,83) Para reducir el riesgo de precipitación, la concentración de glutamina en dichas soluciones no debe ser superior al 1 ó 1,5%.
Por consiguiente, administrar con esa solución 40 g de glutamina a los pacientes traumatizados o en estado crítico es una carga grande. En especial si tienen restricción de líquidos. Con la ayuda de la alanil-glutamina, altamente soluble y estable, es posible administrar la cantidad necesaria en unos 200 mL.
Manteniendo las soluciones a 4 °C se puede retardar la descomposición de la glutamina. Pero llega el momento en que deben calentarse para hacer la infusión a una temperatura fisiológica.
El aumento de temperatura produce un incremento considerable de los productos de descomposición: piroglutamato y amoníaco. Es necesario definir los límites aceptables de estos contaminantes en las soluciones intravenosas.
También existe el riesgo serio del desarrollo de bacterias en las soluciones de glutamina, en particular cuando se preparan sin asesoría farmacéutica.