En el artículo anterior nos referimos a las recomendaciones SEPAR sobre la práctica del Lavado Bronquioloalveolar LBA, componentes normales del mismo, complicaciones, contraindicaciones y utilidad clínica.
En el presente artículo queremos enfatizar en el manejo de la muestra del LBA, desde su toma, transporte y procesamiento, hasta su análisis, puesto que del buen manejo de estas circunstancias depende el rendimiento que podamos obtener.
El artículo refleja la experiencia adquirida en el departamento de patología del Hospital Santa Clara de Bogotá durante algunos años de trabajo, con las adaptaciones inherentes a las limitaciones del medio, lo cual lo vuelve no solo útil sino también muy práctico. (Lea también: Zanamivir inhalado para la prevención de la influenza en las familias)
Paulina Ojeda, MD*,
José G. Bustillo, MD**
* Jefe dpto de Patología Hospital Santa Clara. Bogotá – Profesora asistente Universidad El Bosque. Bogotá. Patóloga Fundación Cardio Infantil.
** Coordinador Departamento de Medicina Interna Hospital Juan N Corpas. Docente Universidades La Sabana, Javeriana y El Bosque.
Introducción
El punto básico en el análisis de un LBA, es la abolición del moco de la muestra, lo cual se logra descartando la primera alicuota aspirada durante el lavado y posteriormente filtrando con doble gasa antes de su centrifugación.
Es importante su abolición no solo porque lleva consigo células inflamatorias que alterarían el conteo diferencial celular, sino porque además puede dar lugar a falsos positivos en la investigación de Neumocistis Carini.
Recolección y procesamiento de la prueba
La muestra obtenida debe recogerse en recipiente plástico para evitar la adherencia de células al vidrio y de esta manera no alterar el recuento celular. No necesariamente debe transportarse entre hielo, depende del clima y mas que el transporte, es importante su rápido procesamiento.
En nuestra experiencia, la demora en el procesamiento lleva a proliferación bacteriana y de hongos, lo cual hace a la muestra no adecuada para diagnóstico.
Una vez filtrada la muestra se centrifuga en tubo plástico a 2.500 rpm por 5 minutos, posteriormente se descarta el sobrenadante cuando no se dispone de medios para su análisis y se realiza un análisis macroscópico del sedimento, ya que en algunos casos sirve de guía para solicitar coloraciones especiales complementarias que contribuyen al diagnóstico.
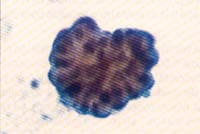
Por ejemplo, en la figura 1, se muestra un LBA cuyo sedimento es abundante grumoso y blanquecino, características que hacen sospechar una proteinosis alveolar , circunstancia en la cual es mandatorio, además de las coloraciones de rutina, solicitar una coloración de PAS con diastasa, la cual nos puede mostrar cuerpos eosinofílicos en medio de un material proteináceo, característico de esta entidad.
Figura No. 1 LBA de paciente con Proteinosis Alveolar
Un sedimento como el que observamos en la figura 2, el cual presenta una coloración negra , caracteriza a un paciente que trabaja en minas de carbón o en areneras y la luz polarizada nos ayuda a ver la cantidad de partículas de silice presentes en el extendido.
Figura No. 2 LBA de paciente trabajador de arenera

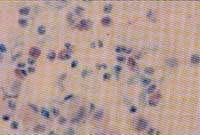
Para el análisis microscópico del sedimento se realizan dos coloraciones de rutina: Papanicolau y Diff Quik. La primera específicamente nos ayuda a excluir una neoplasia, principalmente un adenocar-cinoma o un carcinoma bronquioloalveolar, entidades que clínica y radiológicamente pueden simular una EPID, teniendo el lavado broncoalveolar (figura No. 3) un rendimiento de más del 95% para el diagnóstico de estos tumores.
Figura No. 3 LBA de paciente con Ca. Bronquioloalveolar. Coloración de Papanicolau 40X.
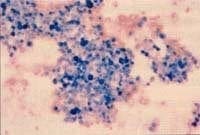
El Diff Quik es una coloración rápida que permite diferenciar las diferentes células inflamatorias presentes en el extendido y principalmente permite reconocer el eosinófilo (figura No. 4), lo cual no es fácil con la coloración de Papanicolau.
Además nos permite valorar si se trata de una muestra tomada con técnica adecuada puesto que conteos de células epiteliales mayores a uno por ciento indican contaminación con secreción del árbol bronquial, lo cual implica un mayor número de neutrófilos en el recuento diferencial.
Figura No. 4 LBA de paciente con Neumonía Eosinofílica Crónica. Coloración de Diff Quik 40X.
El diferencial celular debe realizarse sobre un total de 300 a 500 células dependiendo de cuan celular sea el sedimento, en aquellos casos muy poco celulares podemos hacerlo con base en un total de 100 células; un número menor a 100 nos indica que se trata de una muestra no representativa.
Predominio celular de algunas entidades
El siguiente cuadro nos muestra el predominio celular que muestran algunas entidades:
| Linfocitosis: | Sarcoidosis Neumonitis de Hipersensibilidad Neumonitis por drogas TBC Virus |
| Neutrofilia: | Fibrosis Pulmonar Idiopática Asbestosis Enfermedades del Colágeno S.D.R.A. BOOP |
| Eosinofilia: | Neumonitis de Hipersensibilidad Neumonía Eosinofílica Enfermedad de Células de Langerhans |
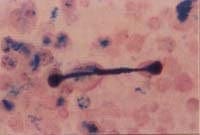
Otra ventaja del Diff Quik sobre el Papanicolau es que permite diagnosticar microorganismos como el Neumocistis Carini (figura No. 5), parásitos (figura No. 6), otros hongos y bacterias, pudiéndose complementar posteriormente con coloraciones especiales como el Grocott (figura No. 7) o como el Gram, principalmente cuando sospechamos bacterias filamentosas tipo Nocardia.
En ciertas circunstancias el aspecto macroscópico del sedimento se correlaciona muy bien con los hallazgos microscópicos, como en el caso de las hemorragias alveolares, en las cuales el sedimento de color pardo del LBA guarda estrecha relación con loas macrófagos pardos observados con la coloración de Diff Quik.
Podemos agregar que en estos casos, una coloración complementaria con azul de Prusia (figura No. 8) nos permite afirmar que la hemorragia es alveolar y no de otra causa, si el porcentaje de hemosiderófagos es mayor del 80 por ciento.
Figura No.8 LBA de paciente con LES e Infiltrado Alveolar Difuso. Coloración de Azul de Prusia 10X.
Un sedimento de color pardo con presencia macroscópica de hemosiderófagos también lo podemos observar en pacientes expuestos a asbesto, con la diferencia que en medio de los hemosiderófagos vamos a observar cuerpos ferruginososo (figura No. 9).
Figura No. 9 LBA de paciente expuesto a Asbesto. Coloración de Azul de Prusia 40X.
En conclusión, el LBA alcanza su mejor rendimiento en el diagnóstico de carcinoma bronquioloalveolar y en los procesos infecciosos, especialmente de inmunosuprimidos ; en enfermedad Infiltrativa difusa del pulmón, es una ayuda muy importante, siempre y cuando se realice una buena correlación clínico radiológica y patológica del caso a analizar.