Introduccion
Lo que justifica esta revisión es el resurgimiento de la tuberculosis (TB) en los últimos años. En 1993 la Organización Mundial de la Salud (OMS) declaró a la TB una emergencia de salud. En 1995 la OMS llama a la TB la principal infección aislada que causa la muerte en adultos y calcula que en esta década ocurrirán en todo el mundo 90 millones de casos nuevos y morirán 30 millones de personas, de los cuales una tercera parte corresponden a edades pediátricas.
Alrededor del 95% de los casos nuevos ocurrirán en países en vías de desarrollo1-3. En Colombia se notifican más de 10 mil casos nuevos por año y alrededor de 1.000 muertes lo que sugiere una prevalecía de 26,5 x 100.000 cifras muy inferiores a lo esperado, seguramente por el subdiagnóstico observado en nuestros centros de atención4-6.
La detección temprana por medio de la prueba de tuberculina (PT) facilitaría un abordaje oportuno, de igual manera la eficacia de la vacunación con BCG con valores de protección entre el 0 y 80 % lograría un cambio ostensible en los indicadores de morbilidad y de mortalidad. (Lea también: Alteraciones gastrointestinales de fibrosis quística)
*Jaime Morales De León. MD, Pediatra
Neumologo. U.de C- Profesor Asociado Lll
Realización e interpretación de la prueba de tuberculina (Pt)
La prueba tuberculina es un extracto de cultivos de M. tuberculosis que es muy útil para diferenciar individuos infectados y no infectados y por lo tanto considerada hoy “El estándar de oro”, el mejor método para detectar la infección tuberculosa7 en individuos asintomáticos
Koch, en el 1890 utilizó el término tuberculina para describir un líquido parduzco, transparente, obtenido de filtrado de los cultivos de Mycobacterium tuberculosis y que administrado en dosis diaria crecientes daba por resultado curación rápida de los casos leves de tuberculosis y mejoría lenta progresiva de los casos más graves8.
Las observaciones de las diferencias en las reacciones de los individuos con TBC o sin ella, a la tuberculina, dio por resultado el desarrollo de nuevos métodos para administrar antígenos entre ellos: Prueba cutánea de Von Pirquet, prueba cutánea deMoro, prueba conjuntival de Calmette y la prueba intracutánea de Mantoux8.
Fundamento Inmunológico de la prueba tuberculina
La prueba de tuberculina se basa en el hecho que infecciones por M. tuberculosis producen sensibilidad, ya que la tuberculosis es una enfermedad para la inmunología considerada un modelo clásico por excelencia donde se presentan las interacciones entre un microorganismos intracelular y los sistemas de defensa tanto innatos como adquiridos y de la relación entre la inmunidad mediada por células (CMI) y la hipersensibilidad celular retardada (HCR) donde una misma reacción inmunológica básica puede resultar en una respuesta protectora o en daño tisular.
El conocimiento acumulado sobre estos aspectos nos permite definir la TB, además de cualquier otra definición, como enfermedad inmunológica en la que:
- Están comprometidos todos los componentes del sistema inmune identificados hasta el momento.
- El daño tisular es causado por la respuesta inmune anti-microbiana, más que por un efecto directo de la micobacteria, o alguno de sus productos, sobre un tejido o célula en particular.
- En los pacientes con TB se encuentran alteraciones inmunológicas de diversa índole que pueden explicar muchos de los fenómenos clínicos observables en ellos9.
Práctica de la prueba tuberculina
Con la práctica de la PT se pone al individuo en contacto con los antígenos bacilares (AG) contenidos en la tuberculina, que han sido obtenidos de cultivos de M. tuberculosis que contiene diversos antígenos que son comunes a todas las especies del género Mycobacterium, por esto, la PT es poco específica.
Si no está infectado por el bacilo tuberculoso, no se produce ninguna reacción y el sujeto es catalogado como no-reactor o tuberculino negativo. Si la persona está infectada por el M. tuberculosis, los Ag. de la tuberculina estimulan los linfocitos T sensibilizados y desencadenan, en el lugar de contacto una reacción de hipersensibilidad celular retardada, que se manifiesta pasada 48 horas, por una zona de infiltración y eritema, a veces con vesiculación o necrosis que se trata de la PT o reacción tuberculina positiva.
Lo único queindica que una PT es positiva es la capacidad de responder del organismo frente a uno o a varios antígenos del M. tuberculosis como consecuencia del contacto natural o adquirido con el germen6, por lo tanto la prueba positiva no evalúa la inmunidad, sino el grado de hipersensibilidad celular retardada que está inducida y mantenida por bacilos vivos, o sus antígenos, localizados en cualquier punto del organismo del huésped.
Reactividad tuberculínica
En la mayoría de los niños la reactividad tuberculínica aparece por primera vez a las 3 a 6 semanas y en ocasiones hasta 3 meses después de la infección inicial. La reactividad tuberculínica causada por infección por M. tuberculosis continúa toda la vida de los individuos, incluso después de administrar quimioterapia preventiva.
No existe ningún método confiable para distinguir la las reacciones tuberculinicas causadas por vacunación con BCG de las causadas por infección natural.
La inmunidad mediada por células y la hipersensibilidad retardada (HCR), son fenómenos estrechamente relacionados que ocurren en el huésped como resultado de la activación de los linfocitos T. La HCR es una reacción inmunológica del huésped a la infección, pero no participa en la detección o destrucción del germen infeccioso; es responsable de la positividad de la prueba cutánea a la tuberculina. También la HCR es responsable de algunos efectos deletéreos de la tuberculosis como son, la caseosis y la cavitación10.
Por lo tanto, mientras la HCR se considera que tiene procesos en detrimento del huésped, la CMI ejerce acciones benéficas. El balance entre HCR y la CMI es diferente entre individuos y está genéticamente determinado. Lo anterior es importante para conocer, cómo un individuo responderá a una infección activa por M tuberculosis.
Técnica de la prueba de tuberculina
Dos preparaciones de tuberculina están actualmente aprobadas para su uso: La tuberculina original OT ( old Tuberculin) consistente en un cultivo de bacilos filtrados, esterilizado y concentrado por ebullición, y la PPD obtenido por Seibert en 1934 que es un derivado proteico purificado que es más puro que la OT, este material del lote, 49.608 fue designado PPD-S, adoptado en el 1952 por la OMS como la tuberculina estándar y está depositado en el instituto de suero de Copenhague (Dinamarca) que presenta una potencia biológica diferente de las demás tuberculinas.
Para evitar esto se fabricó un gran lote RT 23 de 670 gramos (33.000 millones de dosis) que utiliza como precipitante el ácido tricloroacético en lugar del sulfato amónico que utilizó Seibert, por lo que difiere del PPD-S en el contenido de polisacaridos y de ácido nucleicos.
La RT 23 es una preparación menos purificada que la PPD-S, esto se traduce en que las dosis bioequivalentes de ambas tuberculina son diferentes y en que la RT 23 pone de manifiesto la sensibilidad no específica (la inducida por micobacterias no tuberculosas o el BCG) de manera más efectiva que la PPD-S. Recientemente se dispone de otra tuberculina PPD, la CT-68, que ha sido estandarizada frente a la PPD-S, pero presenta diferencias en la actividad biológica6.
Dosis
La tuberculina es un producto sólido que se administra vehiculizada en una cantidad constante de líquido disolvente:0.1 ml. Se comprobó que la dosis mínima de OT, la dilución de 1:1.000 equivale a 0.000028 mg de PPD-0.1 ml, por lo que esta se consideró una unidad internacional (1 UT) y se le denominó primera potencia, mientras que 0.005 MG de PPD-0.1, corresponden a 250 UT se denominó segunda potencia.
Esta dosis se establecieron como máxima y mínima, viéndose que conforme se iba aumentando la dosis se conseguían más individuos reactores, alcanzándose el máximo de ellos con 250 UT. Por estudios epidemiológicos se comprobó que a las dosis mayores reaccionaban significativamente los habitante de zonas geográficas con mayor presencias de micobacterias no tuberculosas.
Con lo anterior se buscó una dosis idónea, es decir, la dosis más equilibrada entre sensibilidad y especificidad. Estas dosis es 5 UT, de la tuberculina PPD-S (Mantoux) Desde los estudios de Comstock et al11, se sabe que 2UT, de PPD-RT 23, son bioequivalentes a 5 UT de PPD-S, en Colombia y en muchos piases latinoamericanos se usa la tuberculina PPD-RT 23, que contiene 50.000 UT por mililitros diluída a 2UT, contenida en 0.1 ml.
Metodo de Mantoux
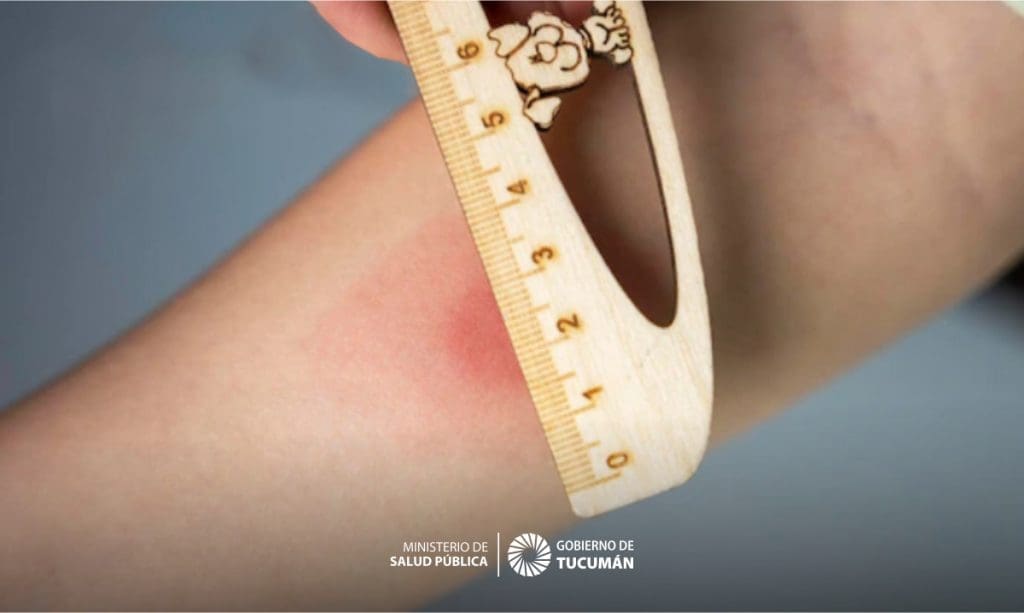
Se realiza por medio de inyección intradérmica de 5 UT en 0.1 ml de diluyente. La prueba es cuantitativa, se lee con el diámetro transverso de lainduración presente al cabo de las 48 a 72 horas; la vesiculación se considera como prueba positiva en cualquier situación más no así el eritema.
Casi el 90% de los pacientes que muestran una induración de 10 ml, como respuesta al PPD-S y prácticamente todas las de 15 ml están infectados; las induraciones de 5 a 9 ml deben considerarse sospechosas de tuberculosis en áreas de incidencias reducidas de micobacterias no tuberculosas, si la reacción es de 5 ml, se considera negativa.
Una PPD positiva en un niño a quien no se le ha aplicado BCG, significa que está infectado con el bacilo tuberculoso, pero si recibió la vacuna BCG, es de esperar una reacción positiva sin haber un modo de diferenciar, si esta es por la vacuna o la infección12.
En el caso de antecedente de aplicación de vacuna BCG, corroborado con cicatriz, se considera como positiva una induración de igual o mayor de 15 ml hasta por 3 a 5 años de aplicación de la vacuna. Una prueba de tuberculina no sensibiliza a una persona no infectada, pero puede aumentar la hipersensibilidad inducida tiempo atrás, por lo tanto un paciente con reacción dudosa, debe realizarse un refuerzo cuatro4 semanas más tarde, para evitar el efecto de refuerzo (booster) y posiblemente tenga una reacción positiva mayor de 10 ml.
Factores que pueden hacer que la prueba tuberculina sea negativa en niños
Existen diversos factores que permiten que un niño tenga una prueba de tuberculina negativa, incluyendo enfermedad general anergizante, tuberculosis sistémica grave (se observa en un 20%), infecciones vírales como sarampión, varicela, infección por VIH SIDA, desnutrición, terapéutica con inmunosupresores, administración reciente de vacunas con virus vivos, defecto en la conservación de PPD o en la técnica de aplicación.
Una reacción de Mantoux negativa nunca excluye la infección o la enfermedad tuberculosa. Aproximadamente el 10% de los niños inmunocompetentes con TB documentada por cultivo no reaccionan inicialmente a 5 UT de PPD13.
Las reacciones cutáneas de control para evaluar anergia indicadas en pacientes con inmunosupresión sospechada o comprobada y en aquellos con posible enfermedad diseminada grave disponible es el BCG test14.
Las causas de PPD falso positivo incluyen infección por micobacteria no tuberculosa o atípicas, alergia a los componentes del PPD, Vacuna previa con BCG (menos del 10% de los casos e interpretación incorrecta).
Todo lo anterior se considera que en paises en vía de desarrollo como Colombia con altas tasas de mortalidad y bajas prevalencias de micobacterium atípicos, el valor de esta prueba se aumenta haciendose aún más sensible y específica, actualmente es el único método disponible para realizar el diagnóstico de tuberculosis en ausencias de síntomas clínicos.
En nuestro país no se informa tasas de infección, aduciendo el uso masivo de BCG, lo que pudiere conllevar a falsos positivos y consecuentemente sobre diagnósticos al realizar la prueba de tuberculina.
Starke y cols, La Academia Americana de Pediatría, concluyen que la vacunación con BCG, no debe ser razón para negar la aplicación de esta prueba, ya que esta no modifica sustancialmente su interpretación15.
Método de punción multiple
Sus antígenos son PPD o tuberculina vieja(OT), algunos problemas con la prueba de punción múltiple limitan mucho su utilidad tales como que tienen una sensibilidad comunicada del 68 al 97% y una especificidad del 40 al 90% correlacionadas con una prueba de Mantoux de 10 mm o mayor, tiene además tasas variables y en algunas poblaciones, altas tasas de resultados falsos positivos y falsos negativos en comparación con la reacción de Mantoux, por lo tanto no es útil en poblaciones donde existe tasas elevadas de infección tuberculosa y donde se vacuna con BCG.
Indicaciones de la prueba de tuberculina
- Convivientes y contactos de enfermos tuberculosos e individuos infectados por VIH
- Individuos cuya Rx de tórax presenta signos sugerentes de TB no evolutiva
- Individuos con sospecha clínica y /o radiológica de padecer enfermedad tuberculosa
- Personal con grave exposición laboral al contagio tuberculoso: Médicos, y personal sanitario, policías, prisiones, y todo el personal de hospitales
- Personas en peligro que si están infectadas pueden desarrollar la enfermedad: Infecciones por VIH, usuario de drogas por vía parenteral, alcoholismo, diabetes isulinodependiente, enfermedades inmunosupresoras, desnutrición grave etc.
- Cuidadores y personas que trabajan en guarderías infantiles y que cuidan enfermos crónicos
- Marginados sociales, personal de prisiones, personas indigentes.
Inmunización de la tuberculosis con BCG
La vacuna BCG está constituida por una cepa viva atenuada de Mycobacterium Bovis, disponible desde 1921 y utilizada ampliamente en el mundo como vacuna contra la tuberculosis, de la cual se han desarrollado múltiples subcepas que difieren de la original desde el punto de vista morfológico, de virulencia y en sus propiedades inmunológicas; por ello al referirse a una vacuna de BCG se debe mencionar la cepa original (danesa, francesa, japonesa y otras).
Para producir inmunización en Colombia se utiliza la vacuna BCG liofilizada de la subcepa PASTEUR 1173, la cual le confiere mayor estabilidad con respecto a la vacuna líquida.
Eficacia
Su eficacia ha sido constantemente controvertida, ya que diversos estudios han mostrado eficacia variable desde 0 hasta 80%. No obstante, recientes investigaciones de la información disponible han podido establecer por medio de un metanálisis de 26 estudios, que existe una protección global del 50%, especialmente en niños y adolescentes. Y para las formas graves de tuberculosis con una eficacia entre el 85 y el 100%16.
Para explicar las diferencias en la eficacia en la vacuna de BCG y su amplia variabilidad, se han propuesto varias hipotesis:
1) diferencias en la potencia de las distintas cepas de BCG que se utilizan;
2) variaciones en la dosis de BCG utilizadas;
3) contacto previo con mycobacterias ambientales que pudieran interferir con el efecto de la vacuna BCG17.
Dada la variabilidad de la eficacia, la modificación de la respuesta a la tuberculina y los efectos secundarios, los estudios de costo-efectividad no justifican el uso masivo de la BCG en paises de baja prevalencia de tuberculosis, como Canadá y Estados Unidos18.
Vacunación
En estos países la BCG se justifica en niños tuberculino (-) con riesgo de contacto con tuberculosis o con poblaciones con riesgo. Los infectados con HIV asintomáticos pueden ser vacunados.
En países de alta prevalencia de tuberculosis (riesgo de infección anual mayor del 1%), está justificada la vacunación masiva a los niños (es el caso de Colombia). Para obtener la mayor cobertura posible se recomienda vacunar a todos nuestros niños desde la etapa de recién nacidos hasta los catorce años de edad, que es la época en que con mayor frecuencia se presenta infección tuberculosa en países en vía de desarrollo17. Por esto, no existe justificación alguna para no vacunar a nuestros niños, independiente del nivel socioeconómico.
Aunque su eficacia no sea muy alta, es deseable al poco uso del PPD y la profilaxis, y por lo tanto, no existe en la actualidad una mejor vacuna.
Administración
El mejor método es la administración por inyección intradérmica de 0.1ml en la región deltoidea. Debe evitarse la administración subcutánea, que se acompaña de más efectos secundarios locales y regionales.
Los recién nacidos normales deben recibir la mitad de la dosis. La vacuna está contraindicada en recién nacidos con peso menor a dos kilogramos, y de igual manera en procesos febriles, niños con inmunodeficiencia, enfermedades anergizantes, afecciones cutáneas graves, quemaduras, leucemias, linfomas y en pacientes con desnutrición avanzada, y además en embarazo.
Indicaciones
La administración de la vacuna BCG debe considerarse para niños no infectados que corren un riesgo inevitable de exposición, y para niños en los cuales han fracasado o no son factibles otros métodos de prevención y control, incluyendo el tratamiento preventivo con INH Isoñiacida.
La vacuna se administra en los siguientes casos: 1) lactantes y niños cuyas reacciones tuberculínicas son negativas y que viven en hogares con exposición repetida a pacientes no tratados o tratados parcialmente, con tuberculosis persistentemente positiva, o que poseen infección con Mycobacterium tuberculosis resistente a INH y a Rifampicina; 2) lactantes y niños pertenecientes a grupos donde existe una tasa excesiva de infecciones nuevas, donde los mecanismos de control y el tratamiento habitual han fracasado.
Efectos secundarios
Entre el 1 y el 10% de los vacunados desarrollan ulceración en el sitio de la vacuna, la cual mejora la mayoría de las veces en forma espontánea. La adenitis regional por BCG(mal llamada Becegeitis) se presenta en 0.1 a 4.3 casos por 100000 habitantes, y su aparición depende de varios factores tales como la administración de la vacuna en forma subcutánea, la edad del menor, la cepa de BCG y la dosis.
En general mejora espontáneamente en algunas semanas. Excepcionalmente se requiere de extirpación quirúrgica cuando la adenopatía presenta un diámetro mayor de tres centimetros y es única, además cuando el ganglio es fistulizado y tratamiento con INH y rifampicina.
La infección hematógena de la BCG (la verdadera Becegeitis) ocurre entre 0.1 por 100.000 dosis, siendo una complicación muy grave que ocurre en niños inmunosuprimidos y es extremadamente rara. Tiene alta mortalidad y requiere tratamiento antituberculosos completo.
En la ciudad de Cartagena de Indias, con una población total de 840.000 habitantes, de los cuales el 41 % está en el estrato 1 y 2, residenciados en la zona suroriental, considerado comunidad marginada, se ha reportado en los últimos cinco años según el DADIS (Departamento Administrativo Distrital de Salud) un aumento gradual de los casos de tuberculosis entre las edades de 15 a 54 años.
Estudio cohorte en grupos de alto riesgo de infección tuberculosa
Con base en lo anterior se realizó un estudio de cohorte con sujetos de dos grupos de alto riesgo de infección tuberculosa tanto en niños(150) como en adultos(150), que consultaron a entidades de asistencia social (HUC-HSP-HINFP) a los cuales se le evaluó la reacción a la prueba de tuberculina PPD RT23, documentándose antecedentes de vacunación con BCG, Combe (+) y estado socioeconómico, demostrando que para nuestro medio la PT dio un 20% de positividad para adultos y 6% de positividad para niños, lo cual establecería un bajo porcentaje de infección tuberculosa o sugeriría baja sensibilidad de la prueba.
Además, la cobertura vacunal entre adultos y niños en nuestro medio sigue siendo deficiente aún en los grupos de más alto riesgo. De la misma manera, la prueba de tuberculina no es influenciada en forma significativa por vacunación con BCG.
Es de notar en este trabajo que elmayor tiempo de exposición al Mycobacterium conduce a una mayor positividad en los resultados de la prueba, lo cual alertaría a los trabajadores de la salud a un mayor riesgo de conversión de la tasa de infección y aparición de la enfermedad, creando un problema de ocupación en salud19.
Bibliografía
1. Dolin PJ, Raviglione MC, Kochi A. Global tuberculosis incidence and mortality during 1991-2000. Bull world Health Organ, 1994;72(2):213-20
2. Guete AM, Jervis DS, Mendoza M. Tuberculosis y SIDA: temible asociación. Trib Med. 1998;97(5):195-204
3. Boletín Oficina Sanitaria Panamericana. Rasgos epidemiológicos de la tuberculosis en el mundo. 1995; 119(6):529
4. Starke JR. La tuberculosis en los niños. Clínica de Atención Primaria de Norteamérica 1996; 4:941-64
5. Text Book ( Tuberculosis). Academia Americana de Pediatría. 1994:495-516
6. Allcaide MJ, Allet MN, Albiñana C. Realización e interpretación de la prueba de tuberculina formación médica continua en atención primaria 1996;3
7. Greenberg P, LAX K, Schechter, Cleyde. Tuberculosis in House Staff Amerc Review Of Respiratory Dis. 1991: 143 (3): 490-5
8. Schein F, Huebner R. Prueba cutánea de la Tuberculina, en Tuberculosis Primera edición. Mc Graw Hill. Interamericana 1995; 79-95
9. García LF, Barrera LF, París SC, Vázquez GM, Patiño E, Zabaleta J, Rojas M. La tuberculosis una enfermedad Inmunológica. En Memorias II Congreso de la Asociación Lat del tórax ALAT. 2000;Vol(12):S52-5
10. Gutiérrez JM, Torres CA, Latorre P, Dennis R. Tuberculosis. Guías de Práctica Clínica Basada en la evidencia. Ascofame- ISS; 1998, Primera edición
11. Comstock E, LB Philip RN Win WA. A comparison in the United States of América of two Tuberculin. PPD-S and RT 23 Bull WMO 1964: 31:161-170
12. Frías NM, Cordero SA, Collado LB, Preciado SJ. Tuberculosis en pediatría: Nuevos retos ante un viejo problema en temas de pediatría Aso M.E X. de pediatría. Manual de infectología; ed McGRAW- Hill Interamericana 1996; 27-53
13. Peter G, Halsey N, Marcuse E, Pickering. Red Book Enfermedades Infecciosas en Pediatría. Tuberculosis..23ª ed. Panamericana, 1996: 490-511
14. Sharma Usha, Saxena Shankuntala. Evaluation of BCG test in the malnourished. Indian J Pediat. 1982; 49: 123-7.
15. Harries a.d maher d. nunn.p Practical and affordadable meassures for the protection of health care workkkers fron tuberculosis in low- income countries bull world health organ.1997; 75 (5): 477-489.
16. Colditz GA, Brewer TF, Berkey CS, et al. Efficaci of BCG vaccine in the prevention of tuberculosis. Meta-analyses of the published literature. JAMA 1994;271:698-702.
17. Ramos BR, Villalobos VH, Macías PM. Vacuna contra la tuberculosis. En.Temas de pediatría. INMUNIZACIONES. AsoMex de Ped. Ed Interamericana. Mc Graw Hill. 1995; 39-51.
18. Greenberg P D. Am. Rev. Resp. Dis; 1991: 143-48.
19. Escamilla JM, Morales D L. J E, López R I, Ahumada B L, Orozco R L, Tous VF, Scott JD. Evaluación de la reacción a la prueba de la tuberculina (PPD RT23) en dos grupos de alto riesgo, niños y trabajadores, de tres entidades de asistencia social (HUC-HSP-HINFP) en la Ciudad de Cartagena de Indias, Colombia.