Presentación de dos casos de secuestro pulmonar
Caso 1 de secuestro pulmonar
Recién nacido de 38 semanas de edad gestacional, producto del primer embarazo. Madre primigestante, con cuatro controles prenatales, que recibió una dosis de maduración pulmonar. En ecografía del tercer trimestre (34 semanas) se encontraron imágenes hipoecoicas en pulmón, con desviación del mediastino hacia el lado derecho.
Con la impresión diagnóstica de enfermedad adenomatoidea quística del feto, fue programada para cesárea. Nace niño de 2404 g de peso, talla de 46 cm, Apgar de 8 al minuto y 9 a los cinco minutos, frecuencia respiratoria de 56 por minuto, frecuencia cardíaca de 119 por minuto, tensión arterial de 55/39 y 97% de saturación oxígeno.
El niño evolucionó satisfactoriamente, sin ningún deterioro hemodinámico y sin dificultad respiratoria; con llanto fuerte, tolerando la vía oral y sin cianosis.
El único hallazgo al examen físico fue disminución de los ruidos respiratorios en el hemitórax izquierdo. No se le encontró ninguna otra malformación asociada. Los rayos X mostraron desplazamiento de la silueta cardiomediastínica hacia la derecha, con opacidad en base pulmonar izquierda y posterobasal en la proyección lateral (ver Figuras 1 y 2). (Ver: Factores asociados a complicaciones debidas a la realización de broncoscopias en pacientes pediátricos)
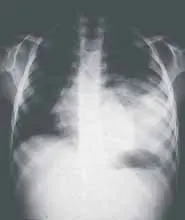
Figura 1. Radiografía de tórax proyección PA. Opacidad en base pulmonar izquierda y posterobasal. Secuestro intrapulmonar
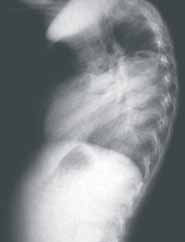
Figura 2. Radiografía de tórax. Proyección lateral
La tomografía computarizada de alta resolución del pulmón mostró imagen heterogénea, localizada en la base izquierda, de 6 por 7 cm, con algunos tabiques, compatible con malformación adenomatoidea quística grado II-III (ver Figura 3).
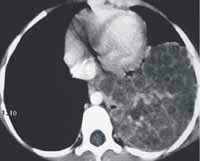
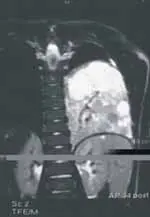
Figura 3. Tomografía computarizada de alta resolución. Corte transversal y corte coronal
En vista del diagnóstico imagenológico de malformación adenomatoidea quística grado II-III se decidió hacer angiorresonancia, ya que la evolución satisfactoria del niño no correpondía al cuadro clínico de la malformación adenomatoidea.
La angiorresonancia es reportada como secuestro alimentado por una arteria sistémica de alto flujo originada en la aorta abdominal; el drenaje venoso era infradiafragmático. En vista de los hallazgos se llevó a toracotomía posterolateral izquierda, el día 18 de vida, sin presentar ningún deterioro clínico durante este tiempo (ver Figura 4).
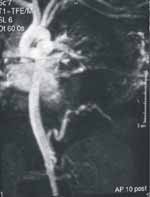
Figura 4. Angiorresonancia. Irrigación del secuestro pulmonar originada en la aorta abdominal.
En la cirugía se encontró secuestro pulmonar basal izquierdo de 14 x 12 x 10 cm, cubierto por pleura con pedículo vascular, con una arteria aorta abdominal, una vena subdiafragmática y con un bronquio. Posteriormente se le dio de alta en buenas condiciones generales.
Descripción macroscópica: segmento apical del lóbulo pulmonar de 5 x 3,5 x 2,5 centímetros, con superficie congestiva y con zonas quísticas en el extremo apical. Al corte se encuentra una zona de 3 cm de diámetro deformada por múltiples quistes ocupados por material mucoso blanco. Descripción microscópica: se observa distorsión anatómica por estructuras quísticas tapizadas por epitelio columnar, con marcada vasodilatación en la pared de los alvéolos. No hay malignidad. El diagnóstico fue secuestro intrapulmonar asociado con malformación adenomatoidea quística (ver Figura 5).
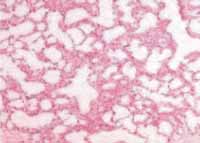
Figura 5. Lesiones quísticas caraterísticas de secuestro pulmonar
Caso 2 de secuestro pulmonar
Niño de género masculino, de seis años de edad. Fue remitido por neumonía basal izquierda con derrame pleural, la cual requirió tratamiento con oxacilina y ceftriaxona, sin respuesta satisfactoria. Tiene antecedentes de reflujo gastroesofágico hasta los 7 meses de edad, hernia umbilical y asma, desde hace tres años.
Tuvo un primer episodio de neumonía hace tres semanas, en tratamiento hasta el momento en que recae nuevamente de su dificultad respiratoria. En vista de la mala evolución del cuadro clínico, se hizo una tomografía computarizada, en la cual se observó una imagen costofrénica posterior izquierda de secuestro extrapulmonar, nutriéndose de una gran arteria anómala, la cual se origina de la aorta abdominal inmediatamente craneal al tronco celíaco.
El niño Ingresó con temperatura de 36.5º C, frecuencia cardíaca de 126 por minuto, saturación de oxígeno de 94%, disminución de los ruidos respiratorios en base pulmonar izquierda, matidez por percusión, disminución del frémito vocal en el hemotórax izquierdo y algunos estertores y roncus. Se tomó una resonancia magnética de tórax que mostró secuestro extralobar, con una arteria nutricia de la aorta craneal al tronco celíaco y drenaje venoso a la aurícula izquierda.
La angiorresonancia mostró gran masa quística multiloculada con cápsula gruesa bien definida, de 10 x 7 cm, localizada en los dos tercios caudales del hemitórax izquierdo y con epicentro en el surco costofrénico posterior, delimitada por el hemidiafragma y pared torácica posterolateral, desplazando el parénquima pulmonar adyacente. También, con una gran arteria anómala de gran calibre que nutre la masa descrita y el drenaje venoso hacia la aurícula izquierda.
Con el diagnóstico de secuestro extrapulmonar se lleva a cirugía y se le hace lobectomía segmentaría del lóbulo inferior izquierdo.
Descripción macroscópica
Segmento de pulmón de 10 x 7 x 6 cm, de superficie congestiva. Al corte hay múltiples cavidades abscedadas. Descripción microscópica: mucosa tapizada por epitelio pseudoestratificado con cilias, en medio de la cual se observan cavidades quísticas, tapizadas por epitelio cúbico a columnar, con material amorfo eosinofílico y abundantes macrófagos e infiltrado inflamatorio de mononucleares y polimorfonucleares. El diagnóstico fue secuestro extrapulmonar.
Discusión sobre los casos de secuestro pulmonar
Se define secuestro pulmonar como una masa de tejido pulmonar embrionaria y quística, no funcionante, aislada del pulmón normal, que recibe todo su aporte sanguíneo de un sistema arterial sistémico anómalo. Si bien la mayoría de los secuestros no comunican con las vías aéreas funcionantes, ello no siempre es así. Hay dos formas de secuestro pulmonar, intrapulmonar y extrapulmonar, aunque pueden coexistir simultáneamente (1, 2, 3, 4).
La teoría de Holder y Langston establece que el secuestro intralobar, es una malformación adenomatoidea congénita, o pulmón normal, con una suplencia arterial aberrante. Con el tiempo, los episodios recurrentes de inflamación, pueden destruir la conexión traqueobronquial, y ocasionar la pérdida del recubrimiento celular original de la lesión (4, 5).
Fisiopatología del secuestro pulmonar
El tejido pluripotencial del botón pulmonar adicional migra en dirección caudal con el pulmón que se está desarrollando normalmente. Éste recibe la irrigación sanguínea de los vasos que provienen de la aorta, que irrigan al intestino primitivo.
Durante el período del desarrollo embrionario temprano, el botón pulmonar accesorio forma el secuestro dentro del tejido pulmonar normal encerrado en la misma pleura, constituyendo la variante intrapulmonar. En el período de desarrollo embrionario tardío, se desarrolla el botón pulmonar accesorio, dando lugar a la variante extrapulmonar de secuestro pulmonar.
Frecuencia y mortalidad
Constituyen el 6% de todas las malformaciones pulmonares congénitas en Estados Unidos. En el Hospital Infantil San Vicente de Paúl se han informado hasta el momento tres casos.
Los secuestros intrapulmonares son más de 90% de los secuestros; 60% de éstos se encuentran en los segmentos posterobasales del lóbulo inferior izquierdo. Aproximadamente 98% ocurren en los lóbulos inferiores. La afectación bilateral es rara. Los secuestros extrapulmonares ocurren en el lado izquierdo en 95% de los casos; de éstos, 75% se encuentran entre el hemidiafragma izquierdo y el lóbulo inferior izquierdo (6).
Género y edad
En la forma extrapulmonar, los hombres se afectan aproximadamente cuatro veces más que las mujeres; en la intrapulmonar, la afectación es igual para hombres y mujeres.
Más de la mitad de los casos de secuestro intrapulmonar se diagnostican luego de la adolescencia, siendo menos comunes los síntomas en neonatos y lactantes. En el caso del secuestro extrapulmonar, más de la mitad de los casos se diagnostican cuando los pacientes son menores de un año (7). Muchas veces se diagnostica debido a las otras anomalías asociadas.
Secuestro intrapulmonar
En este tipo de secuestro el segmento intrapulmonar está rodeado por pleura visceral y no tiene separación pleural del resto del lóbulo; está en estrecho contacto con el tejido pulmonar normal.
En el secuestro extrapulmonar el segmento es más distal y está completamente separado del pulmón normal, cubierto por pleura propia. El secuestro puede asociarse con quiste broncogénico, quiste broncogástrico, quiste esofágico, malrotación intestinal, divertículo de Meckel y malformación adenomatoidea quística (en el mismo lado, contralateral o dentro del secuestro) (4,8).
El segmento secuestrado puede ser todo el pulmón o coexistir bilateralmente (9,10). En algunos niños, el lóbulo secuestrado asociado con tejido pulmonar normal tiene drenaje venoso anormal a la vena cava inferior, lo cual produce la imagen radiológica llamada síndrome de cimitarra (11).
Histológicamente, el lóbulo afectado es quístico, con alvéolos sin aire, epitelio respiratorio y cartílago irrigado por un sistema arterial.
Usualmente, el secuestro intrapulmonar no comunica con el árbol traquebronquial normal, pero llega a airearse por ventilación colateral alrededor del pulmón. Es así como las infecciones ocurren a través de una fístula entre el secuestro y la vía aérea o el tracto digestivo. El tejido patológico congénito puede ser contaminado por neumonitis contigua o por vía hemática, con formación de fístulas. La resolución de la infección usualmente es lenta e incompleta, por inadecuado drenaje bronquial (2,3).
Presentación clínica
La forma de presentación clínica es de neumonía recurrente y formación de abscesos dentro del secuestro y el pulmón adyacente.
Además de la infección, también se encuentran bronquiectasias y atelectasias, lo cual hace imperativa la resección temprana del secuestro intrapulmonar, aun si es asintomático. En algunos casos menos frecuentes puede asociarse con gérmenes como Aspergillus, principalmente en adultos y tuberculosis.
Otra manifestación clínica de presentación es tos crónica o recurrente. Al examen físico se auscultan signos de consolidación y puede encontrarse soplo sistólico o soplo continuo sobre el área afectada, lo cual está en relación con el flujo a través de la gran arteria que irriga el secuestro (12,13,14,15).
La irrigación sistémica de la anomalía usualmente proviene de la aorta abdominal en 85% de los casos y de la aorta torácica en 15%, siendo el sistema arterial más grande para este tipo de anomalía. Algunos informes han descrito irrigación por la arteria innominada, vasos coronarios, arterias intercostales (16-19), tronco celíaco, mamaria interna, subclavia y arterias renales (20).
El drenaje venoso usualmente es a la vena pulmonar inferior, pero puede ser a través de las venas ázigos y hemiázigos. Como resultado de esta irrigación vascular anómala puede ocurrir insuficiencia cardíac a de alto gasto por la fístula arteriovenosa o sangrado con hemoptisis masiva (21).
Secuestro extrapulmonar
El secuestro extrapulmonar frecuentemente se asocia hasta en el 55% de los casos con malformación adenomatoidea quística congénita, en especial la tipo II (22).
El segmento secuestrado se encuentra principalmente entre el lóbulo inferior y el diafragma, pero puede localizarse en la región paracardíaca (23); mediastino anterior o posterior o regiones infracardíaca; infradiafragmático o abdominal.
Las anomalías extrapulmonares son más comunes en el secuestro extralobar y se han documentado hasta en 59% de los casos, en contraste con el secuestro intralobar, el cual se asocia en sólo 10% de los casos con otros defectos.
Las malformaciones asociadas más comunes son: hernia diafragmática, enfermedad cardíaca congénita, defectos pericárdicos, fístula arteriovenosa, megacolon, anormalidades de tipo VACTERL, deformidades de la pared del tórax (pectus excavátum y carinátum), duplicación entérica y anomalías renales y cerebrales (3,24).
Se debe recordar que la hipoplasia pulmonar puede ser producida por la compresión del pulmón normal por un secuestro enorme o, más comúnmente, por el intestino herniado de una hernia diafragmática.
Diagnóstico del secuestro pulmonar
El diagnóstico postnatal radiológico depende del tamaño del tejido pulmonar secuestrado y de si hay infección. Si no hay comunicación entre el secuestro y el tejido pulmonar normal, la radiografía usualmente muestra opacidad densa, triangular o lesión en forma de balón cerca al diafragma; además, puede haber un nivel hidroaéreo en el segmento posterobasal del lóbulo inferior y puede tener una apariencia quística (25 – 27).
La densidad de la lesión muchas veces se aumenta con la infección secundaria y aparece como una consolidación uniforme. Cuando esta área persiste luego de terapia antibiótica, se debe considerar el secuestro como una posibilidad diagnóstica, particularmente si la lesión se encuentra ubicada posterobasalmente en el lóbulo inferior izquierdo.
La imagen doppler y la ecografía en tiempo real son métodos seguros para demostrar el origen sistémico o la irrigación sanguínea. Además, la ecografía hace posible el diagnóstico o la sospecha de enfermedad pulmonar quística congénita in útero.
El secuestro pulmonar debería ser considerado en todo neonato con masa abdominal superior o suprarrenal, principalmente si la masa ha sido detectada antenatalmente (2).
¿Cómo se ve en la ecografía?
Ecográficamente, el pulmón anormal aparece como una masa ecogénica intratorácica o intraabdominal. El 50% de los casos tiene derrame pleural asociado y en 50% de los casos se observa desviación mediastinal; también, puede ocurrir el hidrops.
El polihidramnios es una complicación frecuente. El secuestro extralobar ha sido más comúnmente diagnosticado que el intrapulmonar. La baja frecuencia de secuestro intrapulmonar fetal sugiere que algunos de estas lesiones pueden ser adquiridas luego del nacimiento, posiblemente como resultado de una infección (3).
La broncografía puede ser engañosa, pues la falta de captación en la entrada al bronquio no es exclusiva del secuestro; puede ser producida por otras causas, tal como tapón de moco, cuerpo extraño, atresia bronquial o error técnico.
La tomografía axial computarizada del tórax con contraste puede demostrar los vasos aberrantes en muchos casos, pero no puede ser demostrado el drenaje venoso y puede que no sean identificados los múltiples vasos pequeños que irrigan al secuestro.
La aortografía es el estudio que confirma el diagnóstico. La irrigación arterial y el drenaje venoso deberían ser dibujados en cada caso debido a lo impredecible de las conexiones vasculares (28).
Otras pruebas diagnósticas son: la resonancia magnética, el esofagograma con bario, la broncoscopia y la oclusión con balón (25).
Tratamiento del secuestro pulmonar
La cirugía es la piedra angular del tratamiento de los pacientes con malformación pulmonar, indicándose de forma precoz, ya que el niño es potencialmente susceptible a las infecciones recurrentes y la posibilidad de hemorragia de las anastomosis arteriovenosas (29).
Las lesiones extrapulmonares usualmente pueden ser extraídas sin alterar los lóbulos restantes. La otra condición para removerlo es cuando una masa mediastinal inferior y posterior se encuentra durante un estudio imagenológico y el secuestro no es considerado en el diagnóstico diferencial.
El secuestro intrapulmonar es resecado por lobectomía; ya que la resección segmentaria no es suficiente, porque el secuestro no está claramente delimitado. Es importante asumir que una o más arterias sistémicas del secuestro vienen de la aorta, por encima o debajo del diafragma. Muchas veces estos vasos son frágiles o se retraen debajo del diafragma, produciendo hemorragia (30).
Pronóstico del secuestro pulmonar
En ausencia de complicaciones perioperatorias, la resección quirúrgica del segmento anormal usualmente es curativa. El pronóstico es determinado, además, por cualquier anomalía asociada.
El secuestro extrapulmonar relacionado con la hipoplasia pulmonar es de pobre pronóstico, falleciendo la mayoría de los niños afectados en el período neonatal.
Complicaciones
En el caso del secuestro extralobar, las principales complicaciones son empiema pleural, hemotórax y hemoneumoperitoneo. Aunque son raros los cambios de metaplasia o cambios preneoplásicos, se han descrito algunos casos de carcinoma de células escamosas (31,32).
John Édgar Lopera Marín*, María de la Luz Valencia**, Wílliam Parra Cardeño***.
* Residente de Pediatria 3er año, Universidad de Antioquia.
** Peditra Neumóloga del HUSVP, Profesora de la Universidad de Antioquia
*** Pediatra Neumólogo del HUSVP, Profesor de la Univeresidad de Anttioquia
Bibliografía
1. O´Neill JA, Rowe MI, Grosfel J. Pediatric surgery. In: Alfred A. L. Respiratory problems related to the airway and lung; 5 ed.; St Louis; Mosby, 1998; 890-893.
2. Mc Colley SA, Konop R, Callahan CP. Pulmonary sequestration. Med J 2002; 3: 1-12.
3. Kendig EL, Edwin L. Disorders of the respiratory tract in children. In: Kending EL. Congenital malformations of the lower respiratory tract; 6 ed.; Philadelphia; WB Saunders Company, 1998; 311-313.
4. Greenough A., Clifford NR, Milner AD. Neonatal respiratory disorders. In: Greenough A. Abnormalities of lung growth and development, 5 ed.; Oxford; Arnold, 1996; 448-450.
5. Parra WP. Temas de pediatría: Malformaciones pulmonares congénitas. Nestlé. 1997. No. 151: 7-13.
6. Stocker JT. The respiratory tract. In: Stocker JT, Dehner LP. Pediatric Pathology, 3 ed.; Philadelphia; JB Lippincott, 1996; 71-76.
7. Ddell’Agnola C, Tadini B, Mosca F, Colnaghi M, Wesley J. Advantages of prenatal diagnosis and early surgery for congenital cystic disease of the lung. J Perinat Med. 1996; 24(6): 621-31.
8. Weitzman JJ, Brenna, LP. Bronchogastric fistula, pulmonary sequestration, malrotation of the intestine, and Meckel´s diverticulum: a new association. J Pediatr Surg 1998; 33 (11): 1655-7.
9. Iwai K, Shindo G, Hajikano J. Intralobar pulmonary seques-tration, with special reference to developmental pathology. Am Rev Respir Dis 1973; 107: 911.
10. Phelan PO, Landau LI, Olinsky A. Respiratory illness in children, 2 ed.; Boston; Blackwell Scientific Publications, 1982; 397-443.
11. Horcher E, Helmer F. Scimitar syndrome and associated pulmonary sequestration: a report of a successfully corrected case. Pediatr Surg. 1987; 21: 107-11.
12. Kadoyama C, Fujino M, Hasejima N, Kobayashi H, Takezama S, Yamato K. Intralobar pulmonary sequestration associated with asymptomatic aspergillosis. Kyobo Geka. 1996; 49(11): 959-62.
13. Park JY, Won JH, ParK JG, Kim CH, Jung TH, Jung MH. Aspergilloma within intralobar pulmonary sequestration. Korean J Intern Med. 1996; 11(2): 183-5.
14. Elia S, Alifano M, Gentile M, Somma P, D Armiento. Infection with Mycobacterium tuberculosis complicating a pulmonary sequestration. Ann Thorac Surg 1998; 66(2): 566-7.
15. Matsuo T, Hayashi A, Takamori S, Tayama K, Tamura K, Beppu T. Tuberculosis associated with pulmonary sequestration. Kurume Med J 1998; 45(2):215-7.
16. Grigoryants V, Sargent SK, Shorter NA. Extralobar pulmonary sequestration receiving its arterial supply from the innominate artery. Pediatr Radiol. 2000; 30(10): 696-8.
17. Serra-Batlles J, Roger N, Plaza V. Intralobar pulmonary sequestration depending of an intercostal. Arch Bronconeumol 1998; 34(6): 315.
18. Bertsch G, Markert T, Hahn D, Silber RE, Schanzenbacer P. Intralobar lung sequestration with systemic coronary arterial supply. Eur Radiol 1999; 9(7): 1324-6.
19. Sholler GF, Whight CM, Nunn GR. Pulmonary sequestration in a newborn mimicking cardiac disease: a trap for diagnosis. Austral Paediatric J 1985; 21:279-80.
20. Alivizatos P, Cheatle T, de-Leval M. Pulmonary sequestration complicated by anomalies of pulmonary venous return. J Pediatric Surg 1985; 20: 76-9.
21. Curros F, Brunelle F. Prenatal thoracoabdominal tumor mimick-ing pulmonary sequestration: a diagnosis dilemma. Eur Radiol 2001; 11(1): 167-70.
22. Conran RM, Stocker JT. Extralobar sequestration with frequently associated congenital cystic adenomatoid malformation, type 2: report of 50 cases. Pediatr Dev Pathol. 1999;2(5):454-63.
23. Carpentieri DF, Guttenberg M, Quinn TM. Subdiaphragmatic pulmonary sequestration: a case report with review of the literature. J Perinatol 2000; 20(1): 60 -2.
24. Da-Silva OP, Ramanan R, Romano W, Boncking A, Evans M. Nonimmune hydrops fetalis, pulmonary sequestration, and favorable neonatal outcome. Obstet Gynecol 1996; 88: 681-3.
25. Schwartz DS, Reyes-Mugica M, Keller MS. Imaging of surgical diseases of the newborn chest. Intrapleural mass lesions. Radiol Clin North Am 1999; 37(6): 1067-78.
26. Felker RE, Tonkin ILD. Imaging of pulmonary sequestration. AJR 1990; 154:241-249.
27. Rosado-de-Christenson ML, Frazier AA, Stocker JT, Templeton PA. Extralobar sequestration: Radiologic-pathologic correlation. RadioGraphics 1993; 13:425-441.
28. Chung JW, Park JH, Im JG, Chung MJ, Han MC, Ahn H. Spiral CT angiography of the thoracic aorta. Radiographics 96; 16(4): 811-24.
29. Garcia-Pena P, Lucaya J, Hendry GM, McAndrew PT, Duran C. Spontaneous involution of pulmonary sequestration in children: a report of two cases and review of the literatura. Pediatr Radiol 1998; 28(4): 266-70.
30. Buntain WL, Wooley MM, Mahour GH. Pulmonary sequestra-tion in children: a twenty-five year experience. Surgery. 1977; 81:413-20.
31. Halkic N, Cuenoud PF, Corthesy ME, Ksontini R, Boumgac M. Pulmonary sequestration: a review of 26 cases. Eur J Cardiothorac Surg 1998; 14:127-33.
32. Bell-Thompson J, Missier P, Sommers SC. Lung cacinoma arising in bronchopulmonary sequestration. Cancer 1979; 44:334-339.