Introducción
El tromboembolismo pulmonar (TEP), es una patología de alta incidencia en nuestro medio. Los deletéreos, cambios hemodinámicos que se desarrollan una vez se ha instaurado la embolia, determinan las graves y agudas complicaciones que este evento enmarca. El entendimiento de dichos cambios fisiopatológicos facilitará la aproximación diagnóstica del evento embólico y la instauración de la terapia adecuada lo antes posible. Este documento pretende solamente hacer una revisión a las actuales bases fisiopatológicas del evento embólico pulmonar. (Lea también: Neumonía y neumonía lobar)
Hector Fabio Sanchez G.* Oscar Saenz**
* Residente I Año Medicina Interna Fundacion Universitaria San Martin Hospital Santa Clara
** Médico Neumólogo. Coordinador Dpto. Fisiología pulmonar Hospital Santa Clara
Modelo circulatorio
Desde hace ya varios años se entiende que el sistema circulatorio es un conducto cilíndrico abierto, con un gasto cardíaco definido como un gradiente de presión contra una resistencia periférica. El sistema circulatorio consiste en una bomba compuesta por un corazón derecho (bomba derecha) que se enlaza con el corazón izquierdo.
Como consecuencia de este enlace entre el corazón izquierdo y derecho el gasto cardíaco no puede exceder el retorno venoso y viceversa.
En otras palabras el gasto cardíaco izquierdo no puede exceder el gasto cardíaco derecho lo cual permite conceptuar ambas bombas como una sola unidad hidráulica. La bomba hidráulica funciona inicialmente a partir del volumen de la capacitancia venosa el cual es entregado al sistema arterial.
Figura 1. Relaciones entre la presión, la resistencia y el flujo sanguíneo.
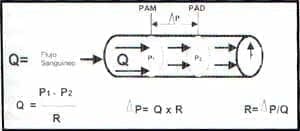 Se reconoce que el gradiente de presión para el retorno venoso corresponde a la la relación de la presión en la capacitancia venosa menos la presión de la aurícula derecha ( RV= PVC – PAD). Se establece así el papel fundamental de la aurícula derecha como enlace entre el sistema venoso y la función hidráulica del corazón.
Se reconoce que el gradiente de presión para el retorno venoso corresponde a la la relación de la presión en la capacitancia venosa menos la presión de la aurícula derecha ( RV= PVC – PAD). Se establece así el papel fundamental de la aurícula derecha como enlace entre el sistema venoso y la función hidráulica del corazón.
La Presión venosa central está dada en función del volumen venoso y el tono vascular, haciendo que la aurícula derecha se deba esforzar para mantener la presión de retorno venoso. La presión de la aurícula derecha no solo provee información acerca de la presión en el corazón derecho sino una medida de la presión en la capacitancia venosa.
Así, el sistema circulatorio puede ser definido como un sistema tri-compartimental; una capacitancia que provee volumen a las bombas hidráulicas que generan flujo al sistema aterial. Cualquier anormalidad hemodinámica puede ser generada por daños de una o más de estas variables.
Los similares de la capacitancia venosa, la bomba hidráulica y el sistema de impedancia arterial son la presión en la aurícula derecha, el gasto cardíaco y la resistencia vascular periférica respectivamente.
Fisiopatología del tromboembolismo pulmonar TEP
Mecanismo de la falla cardíaca
Cuando se presenta la obstrucción de las arterias pulmonares por embolia se afectan:
1) El tejido pulmonar,
2) La circulación pulmonar, y
3) La función del corazón derecho e izquierdo.
El grado de compromiso cardiopulmonar se correlaciona con la severidad de la oclusión producida por el émbolo y con el grado de enfermedad de base del paciente.
La severidad de compromiso hemodinámico que ocurre con el embolismo pulmonar agudo está en correlación con la magnitud de la obstrucción de los vasos pulmonares en pacientes sin enfermedad cardiopulmonar previa.
De otra parte, en personas con enfermedad cardiopulmonar subyacente, la inestabilidad hemodinámica severa puede ocurrir con obstrucciones que no sobrepasan el 50% de la vascularización pulmonar.
El tromboembolismo pulmonar TEP trae consigo una consecuencia hemodinámica inicial, la cual consiste en una reducción del área del lecho vascular pulmonar y un aumento en la resistencia al flujo de sangre a través de los pulmones.
Si el trabajo cardíaco permanece constante o aumentado, se eleva la presión arterial pulmonar. El mantenimiento del flujo a través de este lecho vascular dependerá de la capacidad del ventrículo derecho de bombear en contra de esta sobrecarga adicional. Si el ventrículo derecho no logra vencer dicha resistencia entonces se produce la falla del ventrículo derecho.
La falla cardíaca por tromboembolismo pulmonar TEP se produce por combinación del incremento de la tensión sobre la pared ventricular derecha, y de la isquemia cardíaca que compromete la función del ventrículo derecho, asociada a la disminución del gasto cardíaco en el ventrículo izquierdo.
Se ha demostrado que el aumento en la presión de la arteria pulmonar se relaciona con la severidad del embolismo. En personas sanas, la hipertensión pulmonar severa generalmente no ocurre hasta que el 50% del lecho vascular pulmonar se ocluye.
Hipertensión pulmonar progresiva
Con más del 50% de oclusión, se produce hipertensión pulmonar progresiva y aumento del trabajo ventricular derecho. Si coexiste la enfermedad cardíaca o pulmonar y ya han dañado la capacidad de la reserva vascular pulmonar; una cantidad relativamente más pequeña de oclusión vascular produce hipertensión arterial pulmonar mayor, y la disfunción ventricular derecha se instaura con mayor facilidad.
A menudo, la presión arterial pulmonar media en pacientes con enfermedad cardiopulmonar previa excede los valores más altos observados en pacientes libres de enfermedad cardiopulmonar anterior lo cual hace pensar en la presencia de hipertrofia del ventrículo derecho pre-existente.
En individuos normales, el ventrículo derecho es una cámara delgada que no está preparada para desarrollar presiones altas y realizar trabajo de alta-intensidad durante períodos extendidos de tiempo, además, hay límites en la habilidad del ventrículo derecho para compensar la oclusión embolica.
En pacientes sin enfermedad cardiopulmonar preexistente, la máxima presión arterial pulmonar que puede desarrollarse y puede mantenerse es de aproximadamente 40 mm Hg
Dada la relación reciproca entre la presión de llenado del ventrículo derecho y el volumen vascular venoso, la presión de llenado del ventrículo derecho podría aumentar, ocasionando aumento en su carga de trabajo.
Inicialmente se inicia un mecanismo compensatorio orientado a mantener el gasto cardíaco, dado por la combinación de aumento en los niveles de catecolaminas, ocasionando taquicardia y utilización de la ley de starling. Esto incrementa la presión del ventrículo derecho.
Todo lo anterior incrementa el consumo de oxígeno por parte del ventrículo derecho, predisponiendo a la isquemia. Con el incremento de la carga del ventrículo derecho y la tensión en su pared, se deprime la función sistólica y se produce una caída del gasto cardíaco. Si esta carga de presión se sostiene, la falla ventricular derecha ocurre, y el desarrollo de cor pulmonale generalmente sobreviene.
Figura 2. El diagrama demuestra el efecto del aumento del volumen del ventrículo derecho (VD) sobre la relación presión-volumen diastólicos (llenado) del ventrículo izquierdo (VI),
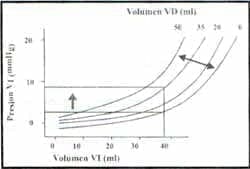 Note que el aumento del volumen del VD disminuye la compliance diastólica del VI, de tal modo que se requiere una mayor presión de llenado para generar un volumen constante de fin de diástole (Taylor et al. Dependence of ventricular distensibylity on filling the opposite ventricle. Am J Physiol 1967; 213:711-15)
Note que el aumento del volumen del VD disminuye la compliance diastólica del VI, de tal modo que se requiere una mayor presión de llenado para generar un volumen constante de fin de diástole (Taylor et al. Dependence of ventricular distensibylity on filling the opposite ventricle. Am J Physiol 1967; 213:711-15)
Bajo condiciones de tensión del ventrículo derecho, los requerimientos de oxígeno del músculo ventricular derecho aumentan, y el aporte de su oxígeno por la pobre perfusión coronaria se torna crítica.
Por consiguiente, si la presión arterial sistémica se cae (como se comenta mas adelante), el ventrículo derecho entra en isquemia llevando a una caída importante en el gasto cardíaco y posteriormente a la muerte debido a arritmias o colapso derecho.
La función ventricular Izquierda es totalmente dependiente de la función ventricular derecha en este escenario. Los datos animales indican que la supervivencia puede ser mejorada por agentes que mantengan la presión arterial sistémica y, por consiguiente, mejoren la perfusión coronaria al ventrículo derecho, el cual se encuentra en ese momento cargado excesivamente. Interesantemente, la presión sanguínea sistémica se mantiene por vasoconstricción.
Postcarga desigual
Se conoce que un incremento mayor del 20% de la precarga disminuye el gasto cardíaco y podría elevar desproporcionadamente el volumen de fin de sístole comparado con el volumen de fin de diástole. El concepto de postcarga desigual viene siendo utilizado para describir el fenómeno de incremento del volumen de trabajo del ventrículo derecho.
Como consecuencia de esta desigualdad, la precarga del ventrículo izquierdo puede disminuir, dado el enlace ventricular ya descrito. Se ha demostrado que el creciente volumen ventricular derecho y la disminución de la distensibilidad del ventrículo izquierdo por desviación del septum interventricular alteran la precarga del ventrículo izquierdo.
Esto quiere decir que el TEP puede dañar la función del ventrículo izquierdo independientemente de los mecanismos de cambio en la precarga. Una disminución mayor del flujo del ventrículo izquierdo resulta en hipotensión sistémica.
La presión de perfusión coronaria del ventrículo derecho depende del gradiente entre la PAM y la presión subendocardíaca del ventrículo derecho. La disminución de la PAM se asocia con incremento en la presión de fin de diástole del ventrículo derecho afectando directamente la perfusión subendocárdica y el aporte de oxígeno.
El incremento en la demanda de oxígeno se asocia con elevación de la tensión en la pared del ventrículo y se relaciona con una disminución en el aporte de oxigeno lo que precipita la presencia de isquemia y finalmente causa la falla del ventrículo derecho.
Se ha demostrado que el impacto del material embólico sobre el flujo de salida de la vasculatura pulmonar, precipita un incremento en la resistencia vascular sistémica. La disminución o el incremento en la RVS está relacionada con la obstrucción mecánica y el estado cardiopulmonar previo.
Otros factores que favorecen el incremento de la RVS
Otros factores han sido considerados al contribuir al incremento de la RVS incluyendo reflejos neurales, reflejos humorales, acción de las plaquetas, trombina, péptidos vaso activos, histamina e hipoxia arterial sistémica.
El papel de los mecanismos reflejos y humorales en la respuesta hemodinámica después de la embolia ha recibido una gran atención. La agregación plaquetaria acompañada de la descarga de varios mediadores vaso activos probablemente contribuyen al proceso vaso constrictivo pulmonar.
Estos mecanismos reflejos y humorales se pueden considerar para el serio grado de compromiso hemodinámico encontrado en algunos pacientes después de lo que parece haber sido un evento de embolia submasiva. El incremento agudo de la resistencia vascular sistémica aumenta la presión y produce efectos múltiples sobre la función del ventrículo izquierdo.
Es importante anotar que la severidad de compromiso hemodinámico no puede ser calibrada por el grado de hipertensión pulmonar.
Como el ventrículo derecho falla y el gasto cardíaco cae, la presión arterial pulmonar se cae a menudo, a pesar de la presencia de una resistencia pulmonar vasculares sumamente alta. Por consiguiente, la presión arterial pulmonar es un inadecuado y potencialmente engañoso marcador de la severidad de la obstrucción embólica.
Alteraciones en el intercambio de gases
Las anormalidades del intercambio gaseoso en el ámbito pulmonar son una consecuencia inevitable de embolización pulmonar. Es probable que la etiología de la anormalidad del intercambio gaseoso sea compleja y multifactorial, y puede diferir de un paciente a otro.
Las anormalidades del intercambio de gases en pacientes con TEP son complejas y dependen del tamaño y características del material embólico, de la extensión de la oclusión, del estado cardiopulmonar previo del paciente, y del tiempo transcurrido desde la embolización.
La hipoxemia se atribuye a:
1 Aumento del espacio muerto alveolar.
2 Incremento del corto circuito de derecha a izquierda.
3 Desequilibrio entre ventilación / perfusión.
4 Bajo nivel de oxígeno venoso mezclado.
Los anteriores mecanismos son propuestos para considerar la mayor hipoxia e hipercarbia encontradas antes y después del tratamiento. Un aumento en el espacio muerto alveolar es una consecuencia inevitable del embolismo pulmonar.
El cortocircuito de derecha-a-izquierda, una alteración en la relación ventilación-perfusión y en ciertos pacientes, una caída en la tensión de oxígeno de la sangre venosa, han tenido un papel en el proceso del intercambio gaseoso anormal conduciendo a la hipoxemia que sigue a la embolia pulmonar.
Etiología de las alteraciones fisiológicas
La etiología de estas alteraciones fisiológicas no se ha definido claramente, pero existen varias hipótesis:
1) Áreas pulmonares con baja relación ventilación-perfusión
Las pueden desarrollar debido a la sobre perfusión de regiones pulmonares no embolizadas. Las bajas relaciones de ventilación / perfusión se pueden desarrollar como consecuencia de la redistribución de sangre lejos del área embolizada, resultando en una sobre perfusión de las áreas pulmonares no embolizadas y atelectasias que inicialmente se desarrollan distalmente a la obstrucción embólica que todavía persisten después de la disolución temprana del embolismo y la reperfusión resultante.
2) Las atelectasias
Las atelectasias se pueden desarrollar en áreas distales a la obstrucción embólica y con la posterior disolución o con la migración distal del material embólico, hay reperfusion de estas áreas pulmonares. La inversión de la hipoxemia postembólica con ventilación con presión positiva apoya la creencia a esta teoría.
Las atelectasias pueden tener muchas causas. Las atelectasias hemorrágicas parecen ser el resultado de la pérdida de surfactantante que ocurre cuando el flujo de sangre de la arteria pulmonar es ocluído. Un fenómeno de “movimiento de aire” puede presentarse en la hipoperfusión pulmonar regional y ser la causa de la hipocapnia regional que a su vez induce constricción bronquiolar y neumoconstricción y llevar adicionalmente a atelectasias, adicionalmente el material embólico es cubierto de plaquetas y esto se ha propuesto como una causa de atelectasias promoviendo la neumoconstricción y la pérdida de surfactante.
3) Edema pulmonar post-embólico
En una variedad de modelos de experimentación animal, el edema pulmonar post-embólico ha demostrado jugar un papel importante en el desarrollo de hipoxemia, pero estos resultados son difíciles de relacionar a los humanos.
Otra posibilidad que debe ser considerada es que, con el desarrollo de hipertensión pulmonar, la sobrecarga ventricular derecha, y una elevación de la presión auricular derecha le siguen a la embolia pulmonar; allí se puede desarrollar una desviación del flujo a través de un foramen ovale persistente. Aproximadamente el 15% de la población normal tienen un foramen ovale persistente, por lo cual este mecanismo debe tomarse en cuenta seriamente.
Enfermedad pulmonar vascular
La enfermedad Pulmonar vascular generalmente se define como un estrechamiento anatómico de la vascularización pulmonar. En un sentido más amplio puede definirse también como un cambio en la impedancia vascular pulmonar en ciertas regiones, que proviene de las anomalías en el lumen o las paredes de vasos pulmonares.
Existen diferentes situaciones clínicas que causan enfermedad vascular pulmonar, donde el intercambio de gases puede evaluarse utilizando la técnica de eliminación múltiple de gas inerte, MIGET. La embolia pulmonar, la oclusión unilateral de la arteria pulmonar, y la policitemia son algunas de las enfermedades que producen dichos cambios.
Como ya se ha mencionado en este documento, la falla cardíaca que ocurre en estas condiciones tiende a acentuar las perturbaciones en el intercambio de gases como resultado de la interacción entre los factores intra pulmonares y extra pulmonares que determinan valores de Pao2.
Sin embargo, la mayoría de las enfermedades cardíacas primarias ocurren en pacientes con pulmones previamente normales. Se concluye entonces que un cambio en el gasto cardíaco en la ausencia de cualquier anormalidad pulmonar asociada, puede ser uno de los factores determinantes en las alteraciones de intercambio de gases.
Consecuencias de las interacciones corazón- pulmón
Cuando se ocluye una o más de las arterias pulmonares, las consecuencias fisiopatológicas dependerán claramente de la duración y magnitud de la interrupción aguda del flujo de sangre en el lecho vascular pulmonar. Las consecuencias hemodinámicas son influenciadas por dos factores principales:
1) El aumento en resistencia vascular pulmonar.
2) El estado cardiovascular previo del paciente.
Hemos ya mencionado que en pacientes sin enfermedad cardiovascular previa, el ventrículo derecho con una pared delgada puede fallar como producto del sobre esfuerzo, y por consiguiente el gasto cardíaco puede caer. En muchas otras situaciones clínicas sin embargo, el gasto cardíaco permanece en un rango normal o incluso se eleva.
Para el caso del pulmón, aparte de producirse áreas ventiladas y no prefundidas, la embolia puede llevar a algún grado de bronco constricción y atelectasias, con una redistribución de la ventilación alveolar y a un incremento de la vaso reactividad pulmonar, posiblemente debido a hipoxemia, produciendo la descarga de mediadores humorales, o una dilatación refleja de los vasos obstruídos.
Hipoxemia
En muchos casos la hipoxemia es la única manifestación obvia de la interacción compleja entre los efectos de embolia y las respuestas adaptativas del corazón y los pulmones.
La presencia de factores como la desviación intra pulmonar (shunt), las alteraciones de ventilación – perfusión, y la limitación de difusión de oxígeno en casos individuales, sólo ha empezado recientemente a ser clarificado.
Esto es principalmente debido al uso de la técnica de eliminación múltiple de gas inerte, MIGET en pacientes en los cuales se demostró embolia pulmonar mediante angiografía. Aunque sólo unos pocos estudios se han llevado a cabo con el método de gas inerte, hay un paralelo entre el patrón de anormalidades de intercambio de gas y el curso de la enfermedad.
En la fase aguda de la enfermedad (primeras 48 horas posteriores al episodio embolico), la reducción aguda del lecho vascular pulmonar induce desórdenes funcionales en los alvéolos de áreas ocluidas así como en el resto de las áreas que aún se encuentran ventiladas y prefundidas en el pulmón.
El intercambio de gases finalmente depende de una combinación de dos mecanismos:
1) Redistribución mecánica del flujo sanguíneo pulmonar desde las áreas con vasos obstruídos a las áreas con vasos no ocluidos.
2) Redistribución de la ventilación alveolar mediada por bronco constricción o atelectasias en las áreas ocluídas.
Sin embargo, los estudios de gases inertes en pacientes con ventilación espontánea tienden a mostrar que no existe un patrón de distribución típico de la ventilación – perfusión luego del embolismo pulmonar.
En recientes estudios se ha encontrado que dichos patrones de distribución dependen primordialmente de cambios en el gasto cardíaco.
Existe una relación inversa entre el flujo sanguíneo que perfunde áreas bien ventiladas y los valores promedio de la relación ventilación- perfusión lo cual demuestra que ante la oclusión aguda la redistribución de flujo a las áreas que aun se encuentran con una adecuada ventilación – perfusión está determinada por cambios en el gasto cardíaco unido a otros factores como aumento de la ventilación, redistribución de la ventilación alveolar hacia áreas no embolizadas y vaso reactividad pulmonar.
Obstrucción vascular
La obstrucción vascular crea zonas en las cuales el alvéolo se encuentra ventilado pero no perfundido. Estos cambios crean aumento en el espacio muerto anatómico. Sin embargo, en la embolia pulmonar el porcentaje de ventilación total que efectivamente produce intercambio de gases cae con el incremento de la obstrucción vascular pulmonar.
La relación V/Q de esas áreas es teóricamente infinita, pero en la práctica en los estudios con técnica de eliminación de gases inertes se define como una relación V/Q por encima de 100. En algunas áreas existe una obstrucción vascular incompleta, lo cual reduce la perfusión y por eso se incrementa la relación V/Q.
Un significativo incremento en la ventilación ha sido medido con relaciones V/Q altas ( V/Q mayor de 10) en dichas áreas por medio de estudios de gases inertes. Estos estudios han demostrado que existe una buena correlación entre la obstrucción vascular pulmonar cuantificada por angiografía y el espacio muerto total.
Figura 3.c en un paciente con embolismo pulmonar.
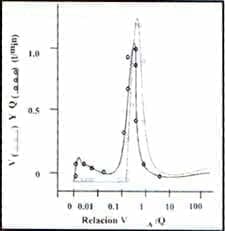 El porcentaje de obstrucción vascular fue del 30% y la medición de gas inerte en el espacio muerto fue de 56%. Este fue un modelo de perfusión y distribución bimodal ( puntos negros) con áreas con proporción V/Q baja debido al gasto cardíaco alto. La PaO2 en el rango normal y la hipoxemia eran el resultado de este V/Q bajo.
El porcentaje de obstrucción vascular fue del 30% y la medición de gas inerte en el espacio muerto fue de 56%. Este fue un modelo de perfusión y distribución bimodal ( puntos negros) con áreas con proporción V/Q baja debido al gasto cardíaco alto. La PaO2 en el rango normal y la hipoxemia eran el resultado de este V/Q bajo.
Figura 4. Distribución Ventilación perfusión en otro paciente con embolismo pulmonar.
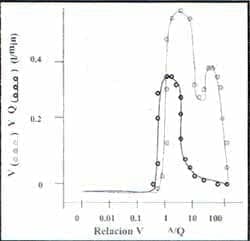 El porcentaje de obstrucción vascular fue del 65% y la medición de gas inerte en el espacio muerto fue de 47%. El flujo de la sangre (círculos cerrados) y la ventilación (círculos abiertos) son distribuídos en áreas con proporciones de V/Q altas debido a un gasto cardíaco bajo y una ventilación minuto aumentada. La PvO2 mixto es baja. La Hipoxemia provino de la PvO2 baja y las desigualdades del V/Q.
El porcentaje de obstrucción vascular fue del 65% y la medición de gas inerte en el espacio muerto fue de 47%. El flujo de la sangre (círculos cerrados) y la ventilación (círculos abiertos) son distribuídos en áreas con proporciones de V/Q altas debido a un gasto cardíaco bajo y una ventilación minuto aumentada. La PvO2 mixto es baja. La Hipoxemia provino de la PvO2 baja y las desigualdades del V/Q.
Papel de la severidad de la obstrucción
Sin enfermedad cardiopulmonar previa
En esta población las manifestaciones clínicas y fisiológicas de la enfermedad son directamente proporcionales al tamaño del embolismo. La correlación entre el grado de obstrucción angiográfica y la presión media de la arteria pulmonar, la presión en la aurícula derecha, la presión arterial de Oxígeno y el pulso.
En ausencia de cuantificación angiográfica, se ha sugerido que una resistencia vascular pulmonar de más de 5000 dinas por mm esta asociada con obstrucciones mayores del 50%. El descenso de la presión arterial de oxígeno ocurre con obstrucciones pequeñas como del 13%, usualmente esta es la única manifestación clínica cuando la obstrucción es menor del 25%.
La hipertensión de la arteria pulmonar es la segunda manifestación mas frecuentemente encontrada y produce manifestaciones solo cuando la obstrucción está por encima del 25 al 30%.
A pesar de un embolismo masivo con obstrucción mayor del 50%, los pacientes sin enfermedad cardiopulmonar previa son incapaces de generar una presión media de la arteria pulmonar mayor de 40 mmHg, cuando esto aparece es la máxima presión que un ventrículo sano puede generar.
Un embolismo masivo o un incremento de los efectos por embolismos recurrentes que generen una obstrucción mayor del 75% puede necesitar que el ventrículo derecho necesite una presión mayor de 40 mmHg y por consecuencia se establezca la falla cardíaca del ventrículo derecho.
Todo lo anterior sugiere que hallazgos de una presión media de la arteria pulmonar por encima de 30 o 40 mmHg pueden ser consideradas como hipertensión pulmonar severa en pacientes que no tienen enfermedad cardiopulmonar previa.
Presión de la aurícula derecha mayor
De igual forma hallazgos de una presión de la aurícula derecha mayor a 10 mmHg en asocio con elevaciones de la Presión media de la arteria pulmonar antes descritas son indicativas de obstrucción de mas del 50% de la vasculatura pulmonar y cifras menores de 10 mmHg indican obstrucciones del 25% aprox. Con relación al gasto cardíaco una disminución del gasto cardíaco en este tipo de pacientes es inusual sin obstrucciones mayores del 50% de la vascularización.
La insuficiencia de todos los mecanismos compensatorios resulta en falla cardíaca que se caracteriza por dilatación del ventrículo derecho, y en un incremento de la presión media de la arteria pulmonar lo cual a su vez se asocia con incremento de la presión de la aurícula derecha y a una respuesta crono trópica predominante.
En la medida en que la presión sanguínea es un producto de la relación entre el gasto cardíaco y la resistencia vascular sistémica, puede presentarse hipotensión cuando la vasoconstricción sistémica es inadecuada para generar presión en respuesta a una disminución del flujo.
Con enfermedad cardiopulmonar previa
Los pacientes con enfermedad cardiopulmonar previa presentan un mayor grado de manifestaciones con un menor grado de obstrucción de la vascularización pulmonar. En estos pacientes el grado de incremento de la presión media de la arteria pulmonar es desproporcionada frente al grado de obstrucción hallado en la angiografía pulmonar cuando se compara con los hallazgos de pacientes sin enfermedad cardiopulmonar previa.
En este grupo de pacientes los valores predictivos de la presión arterial de oxígeno, la presión de la aurícula derecha y la presión media de la arteria pulmonar se pierden debido probablemente a una disminución del umbral de vasoconstricción así como el estado funcional previo del ventrículo derecho.
Finalmente, en pacientes con enfermedad cardiopulmonar previa se establece que la relación entre la presión media de la arteria pulmonar y el porcentaje de obstrucción angiográfica pulmonar puede se propuesta para distinguir entre las instancias en que el TEP es la causa primaria de la inestabilidad hemodinámica Vs. las instancias en que la enfermedad cardiopulmonar previa esta dominando en dicha inestabilidad.
Una relación mayor o igual a 1 es un hallazgo consistente para sugerir que la gran hipertensión pulmonar es resultado de la obstrucción de la vascularización pulmonar.
Sin tener en cuenta el mecanismo inicial involucrado en las alteraciones del intercambio de gas que siguen a la embolia pulmonar, ciertos reflejos fisiológicos pueden explicar en parte la normalización relativamente rápida de intercambio de gas después del evento embólico.
Estos mecanismos incluyen bronco constricción hipocápnica y vasoconstricción hipóxica, las cuales tienden a reducir la ventilación en las áreas pulmonares con alta relación ventilación-perfusión y aumentar la perfusión a las áreas pulmonares con baja relación ventilación-perfusión respectivamente.
El intercambio de gas también puede ser afectado por factores no pulmonares
En presencia de un shunt y relación ventilación-perfusión desigual, la influencia de una baja PO2 mixto-venoso sobre la PO2 arterial pueden ser considerables.
Una baja PO2 mixto-venoso pueden producir una caída del gasto cardíaco o una incapacidad del gasto cardíaco para satisfacer la demanda metabólica aumentada. Aunque esto es raro en pacientes que están libres de enfermedad cardíaca previa, una seria reducción en el gasto cardíaco frecuentemente ocurre después de la embolia pulmonar en pacientes con enfermedad del corazón.
Infarto pulmonar
Una consecuencia pulmonar potencial de obstrucción embólica es el infarto pulmonar, es decir, la muerte del tejido distal a la obstrucción vascular. Puesto que el pulmón recibe el suministro oxígeno de la circulación bronquial, la circulación arterial pulmonar, y oxígeno alveolar, el infarto pulmonar es una consecuencia rara del embolismo.
Es más, los recientes estudios han sugerido que una fuente adicional de oxígeno puede provenir de manera retrógrada de la perfusión del lado venoso pulmonar de la circulación. Debido a las múltiples fuentes de suministro de oxígeno, el deterioro de flujo arterial pulmonar no produce generalmente isquemia del parenquima pulmonar.
Sin embargo, si la isquemia y el infarto ocurren, probablemente se desarrollen en la periferia del pulmón, donde la circulación bronquial tiene una influencia reducida y es probable que la broncocontricción post-embólica ocurra. Esto probablemente explica por qué los infartos probablemente ocurren con embolias periféricas pequeñas que con obstrucciones centrales grandes.
El infarto pulmonar probablemente se presenta mas en pacientes con insuficiencia ventricular izquierda subyacente o con enfermedad pulmonar obstructiva crónica, dos situaciones clínicas que potencialmente podrían comprometer el suministro de oxígeno al tejido pulmonar.
Bibliografía
• Kenneth E. Wood. Major Pulmonary Embolism. Review of Pathophysiologic Approach to the Golden Hour of Hemodynamically Significant Pulmonary Embolism. Review. CHEST. 2002; 121/ 3 / March, .
• J. T. Sylvester, H.S. Goldberg. The Role of the Vasculature in the Regulation of Cardiac Output. Clinics in Chest Medicine. 1983; Vol. 4, Nº 2, May
• John T. Reeves and Lewis J, Rubin. The Pulmonary Circulation. Clinics in Chest Medicine.
• Gerard Manier, Yves Castaing. Gas exchange abnormalities in pulmonary vascular and cardiac disease. Thorax 1994; 1169-1174.
• Anthony M. Consentino. Cardio thoracic interrelationships in clinical practice. Futura Publishing Company, Inc. 1997.
• Torbicki A. Guidelines on diagnosis and management of acute pulmonary embolism. Task Force Report. The European Society of Cardiology. European Heart Journal 2000; 21, 1301 – 1336.
• C. Gregory Elliott. Chest Radiographs in Acute Pulmonary Embolism. Results from International Cooperative Pulmonary Embolism Registry. CHEST 2000; 118: 33 – 38
• Carlos M. Luna, Fernando Palizas. Neumonología Critica. Medicina Respiratoria en Terapia Intensiva. Medical Books. 2001.