Lo que es tan mágico acerca de la edad de inicio de la pubertad en los humanos, que actualmente se establece en aproximadamente 11 años de edad, es ¿por qué no a los 6 o a los 16? De hecho, abordando esta cuestión desde la perspectiva de la biología evolutiva, se sugiere que la pubertad, definida por la edad en la menarquia en las niñas, fue anterior en tiempos neolíticos y se retrasó durante la Revolución Industrial, antes de volver en los últimos dos siglos a la edad actual.
La vida más corta y la necesidad de alcanzar la capacidad reproductiva parecen haber sido las influencias predominantes en la edad de la menarquia hacen miles de años, mientras que las más recientes fluctuaciones en la edad de inicio de la pubertad se han atribuido a la mala nutrición seguida de una mejora social. ¿Cómo se puede explicar la causa subyacente del inicio temprano de la pubertad en una niña traída a la clínica a los 5 años de edad, en quien se excluye la acción del medio ambiente y la posibilidad de obesidad, a la cual se atribuye pubertad precoz en la población infantil?11,12
El inicio de la pubertad está ilustrado vívidamente
El inicio de la pubertad está ilustrado vívidamente por el informe en la mutación con pérdida de la función de un gen en una familia entera.
Los autores tuvieron acceso a 40 miembros de 15 familias en las que los probandos afectados tenían pubertad precoz central; es decir, reactivación prematura del generador de impulsos GnRH que subraya el inicio de la pubertad normal.13 En la aplicación de la secuenciación de todo el genoma en múltiples familias afectadas, adecuadamente fenotipado para la pubertad precoz central, los autores identificaron mutaciones deletéreas en un gen impreso paternalmente expresado, MKRN3. (Los genes impresos tienen un «sesgo sexual» en el que se expresan solo desde el cromosoma materno o el paterno; algunos genes están impresos paternalmente, mientras que otros son maternos.)
El gen MKRN3 codifica makorin RINGfinger protein 3, que está involucrada con la ubiquitinación y la señal celular. La familia de proteínas makorin se expresa abundantemente en el cerebro en desarrollo, incluyendo el núcleo arcuado, donde hay un repositorio de genes cuya expresión es relevante.
La expresión de MKRN3 en ratones de ambos sexos fue más alta en el día postnatal 10 y luego declinó hasta alcanzar un nadir precisamente en consonancia con el inicio de la pubertad.
Es también en este punto que la expresión de genes considerados centrales para la activación de la pubertad (por ejemplo, las kisspeptinas y la neuroquinina B) comienza a aumentar.14
Los autores mostraron que la expresión de MKRN3 en ratones de ambos sexos:
Era más alta en el día postnatal 10 y luego declinó para alcanzar un nadir precisamente en consonancia con mutaciones de pérdida de función en un gen impreso 6. El inicio de la pubertad está también en este punto en que la expresión de genes considerados centrales para la activación de la pubertad (por ejemplo, las kisspeptinas y la neuroquinina B) comienza a aumentar.14 (Lea También: Antagonista de Receptores de Neuroquinina para los SVM )
Se sabe más sobre por qué puede retrasarse la pubertad o por qué comienza precozmente. Cualquier proceso de enfermedad crónica, como malnutrición grave o una enfermedad sistémica como la fibrosis quística, retrasará o detendrá la progresión de la pubertad.
Más específicamente, el eje hipotálamo-hipófisis-gónada, puede albergar defectos específicos en la producción de hormonas que son el resultado de mutaciones conocidas: hipogonadismo hipogonadotrópico causado por mutaciones de pérdida de función que afectan al receptor acoplado de proteína G KISS1R (también conocido como GPR54) y aquellas que implican el resultado de neuroquinina B y el fallo del patrón de secreción normal pulsátil de GnRH necesaria para estimular la producción de gonadotropinas y, posteriormente, la secreción de esteroides gonadales.
El descubrimiento del efecto de las mutaciones en MKRN3 en humanos y de un papel sugerido para su ortólogo de ratón en el núcleo arcuado parecen cimentar la idea de que la pubertad comienza solo con la liberación de un mecanismo de restricción en el generador de pulsos GnRH, que a su vez libera el freno en la pubertad (figura 2).
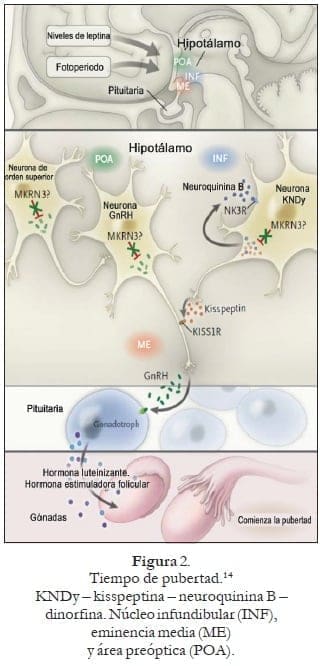
Una liberación de este mecanismo de restricción probablemente también explica por qué el daño intracraneal en condiciones tan diversas como traumatismo craneal e hidrocefalia y los efectos de la irradiación craneal pueden llevar a la pubertad precoz.
Aunque el hallazgo de una causa genética para la pubertad precoz central es una contribución significativa para comprender mejor la pubertad humana, falta una explicación sobre por qué la pubertad comienza aproximadamente en el momento de la unión de la primera y segunda décadas de la vida humana.
Cómo MKRN3 es un ejemplo de un freno neurobiológico que interactúa con otros actores importantes de la pubertad, como Kisspeptina GnRH, Leptina y una gran cantidad de neurotransmisores (excitatorios e inhibitorios), seguirá en la mente de los expertos en pubertad.
Un evento fundamental en el inicio de la pubertad en los mamíferos es la reanudación de la liberación pulsátil de la hormona liberadora de gonadotropina (GnRH) de las neuronas del hipotálamo. Influencias conocidas en el momento del inicio de la pubertad en mamíferos incluyen el fotoperíodo, los niveles de leptina y el aumento de expresión de neuroquinina B, kisspeptina y sus receptores (NK3R y KISS1R, respectivamente), que implican a MKRN3, una proteína que se cree que media la ubiquitinación, en el inicio de la pubertad. En contraste con la kisspeptina y la neuroquinina B, que estimula el comienzo de la pubertad. MKRN3 parece inhibir la pubertad: Abreu et al. mostraron que las mutaciones en MKRN3 predicen la pérdida de la función de la proteína que causa la pubertad precoz central.
Pubertad retardada
La pubertad tardía se define como la ausencia de agrandamiento testicular en los niños o el desarrollo de los senos en las niñas a una edad que es 2 a 2,5 SD más tardía que la media de la población (tradicionalmente, la edad de 14 años en los niños y 13 años en las niñas).15
La pubertad tardía en los niños generalmente representa un extremo del espectro normal del momento puberal, un patrón de desarrollo denominado retraso constitucional del crecimiento y de la pubertad (CDGP, por sus siglas en inglés). En una serie grande, aproximadamente el 65% de los niños y el 30% de las niñas con pubertad tardía tenían CDGP.16
El diagnóstico diferencial de CDGP se puede dividir en tres categorías principales7:
hipogonadismo hipergonadotrópico (caracterizado por niveles elevados de hormona luteinizante y FSH debido a la falta de retroalimentación negativa de las gónadas), hipogonadismo hipogonadotrópico permanente (caracterizado por niveles bajos de hormona luteinizante y FSH debido a trastornos hipotalámicos o hipofisarios) e hipogonadismo hipogonadotrópico transitorio (hipogonadismo hipogonadotrópico funcional), en el que el retraso puberal es causado por la maduración retardada del eje hipotálamo-hipofis-gonadal HHG secundaria a una condición subyacente.
La causa de la CDGP es desconocida, pero tiene una base genética sólida. Se ha estimado que 50 a 80% de la variación en el momento de la pubertad en humanos se debe a factores genéticos,8 y 50 a 75% de los pacientes con CDGP tienen antecedentes familiares de pubertad retrasada.
La investigación de pacientes con el síndrome de Kallmann y el hipogonadismo hipogonadotrópico aislado ha llevado a la identificación de genes que desempeñan un papel crítico en el desarrollo y la regulación del eje HHG, pero las mutaciones que se han identificado en dichos genes no causan CDGP, excepto en casos poco frecuentes.17
Referencias
- 1. Baptista, Carla. Leptin. Acta médica portuguesa 2002; 15(4)281-5.
- 2. Coppari, Roberto, and Christian Bjørbæk. Leptin revisited: its mechanism of action and potential for treating diabetes. Nat Rev Drug Discov. 2012;11(9):692-708.
- 3. Tovar Rodríguez, José María, and Aquiles Ayala Ruiz. Función gonadorreguladora de la leptina. Revista del Hospital Juárez de México 2017;71(3):111-9.
- 4. Hileman SM, Pierroz DD, Flier JS. Leptin, nutrition and reproduction: timing is everything. J Clin Endocrinol Metab 2000; 85(2):804-7.
- 5. Murcia, J. García, et al. Puberty and melatonin. Anales españoles de pediatría 2002;57(2):121-6.
- 6. Navarro VM, Castellano JM, Fern andez-Fernandez R, et al. Developmental and hormonally regulated messenger ribonucleic acid expression of KiSS-1 and its putative receptor, GPR54, in rat hypothalamus and potent luteinizing hormone-releasing activity of KiSS-1 peptide. Endocrinology 2004;145:4565.
- 7. Livadas, Sarantis, and George P. Chrousos. Control of the onset of puberty. Current opinion in pediatrics 2016;28(4):551-8.
- 8. Cortes, Manuel E., et al. The role of kisspeptin in the onset of puberty and in the ovulatory mechanism: a mini-review. Journal of pediatric and adolescent gynecology 2015;28(5):286-91.
- 9. Garcia, James P., et al. Kisspeptin and neurokinin B signaling network underlies the pubertal increase in GnRH release in female rhesus monkeys. Endocrinology 2017;158(10): 3269-80.
- 10. Abreu, Ana Paula, et al. A new pathway in the control of the initiation of puberty: the MKRN3 gene. Journal of molecular endocrinology 2015;54(3):R131-R139.
- 11. Cousminer DL, Berry DJ, Timpson NJ et al. Genome-wide association and longitudinal analyses reveal genetic loci linking height growth, pubertal timing and childhood adiposity. Hum Mol Genet 2013 March 21 (Epub ahead of print).
Bibliografía
- 12. Abreu AP, Dauber A, Macedo DB, et al. Central precocious puberty caused by mutations in the imprinted gene MKRN3. N Engl J Med 2013;368:2467-75.
- 13. George JT, Seminara SB. Kisspeptin and the hypothalamic control of reproduction: lessons from the human. Endocrinology 2012;153:5130-6.
- 14. Hughes IA. Releasing the brake on puberty. N Engl J Med 2013;368(26):2513-5.
- 15. Sedlmeyer IL, Palmert MR. Delayed puberty: analysis of a large case series from an academic center. J Clin Endocrinol Metab 2002;87:1613-20.
- 16. Gajdos ZK, Butler JL, Henderson KD, et al. Association studies of common variants in 10 hypogonadotropic hypogonadism genes with age at menarche. J Clin Endocrinol Metab 2008;93:4290-8.
- 17. Vaaralahti K, Wehkalampi K, Tommiska J, Laitinen EM, Dunkel L, Raivio T. The role of gene defects underlying solated hypogonadotropic hypogonadism in patients with constitutional delay of growth and puberty. Fertil Steril 2011;95:2756-8.