The Women’s Health Initiative Steering Committee.
La terapia estrogénica ha estado disponible para las mujeres postmenopáusicas por más de 60 años. Los beneficios comprobados incluyen el alivio de los síntomas vasomotores. La atrofia vaginal y la prevención y tratamiento de osteoporosis.
Los estudios observacionales primariamente percibieron que las preparaciones de estrógenos sin oposición habían sugerido una reducción del 30 al 50% en eventos coronarios1-3 y de un 8 al 30% de aumento en el cáncer de mama cuando su uso se extendía4-6.
El estudio clínico de terapia hormonal Women‘s Health Initiative, WHI,
El estudio clínico de terapia hormonal Women‘s Health Initiative, WHI, fue diseñado en 1991-1992 usando la evidencia acumulada disponible en esa época7.
Dos ensayos paralelos de terapia hormonal, aleatorizados y controlados con placebo se tuvieron en cuenta para determinar si los estrógenos equinos conjugados, EEC, solos (para mujeres con histerectomía previa) o en combinación con progestinas (acetato de medroxiprogesterona, AMP) podrían reducir los eventos cardiovasculares en la mayoría de las mujeres postmenopáusicas sanas.
El estudio WHI de estrógenosprogestágenos fue suspendido en julio del 2002, después de un promedio de 5.2 años de seguimiento, porque los riesgos para la salud de las pacientes excedía el de los beneficios: la enfermedad cardíaca coronaria, ECC. El accidente cerebral trombótico y la enfermedad tromboembólica venosa se aumentaron en las mujeres asignadas al grupo de la terapia activa con estrógenos más progestinas.
El cáncer de mama también se incrementó, pero el cáncer colorectal, las fracturas de cadera y otras fracturas se redujeron. La falta de beneficios para la ECV fue confirmada por el estudio Heart and Estrogen/progestin Replacement Study (HERS), que también probó los EEC más MPA en mujeres con enfermedad arterial coronaria de base9.
A pesar de la suspensión prematura del estudio WHI estrógenos más progestinas:
El brazo del WHI-estrógenos solos se continuó con un permanente monitoreo por parte de un comité independiente de monitoreo de datos y seguridad (DSMB) debido a que los riesgos y beneficios no habían sido adecuadamente determinados.
En febrero del 2004 el National Institute of Health (NIH) decidió terminar la fase de intervención del estudio de estrógenos solos. Antes de la terminación programada para octubre del 2004 a marzo del 2005.
Este reporte presenta los resultados del ensayo de estrógenos solos usando los datos disponibles hasta febrero 29 del 2004, antes de notificar a los participantes de la decisión en marzo 1 del 2004. Informes detallados posteriores incluirán resultados adicionales entre el seguimiento rutinario de las participantes y el día de terminación del estudio. Un estudio anexo de demencia y función cognitiva será reportado por separado.
Dos componentes adicionales del WHI que estudian el efecto de un patrón de dieta baja en grasa e independientemente los efectos de suplementos de calcio más vitamina D están en proceso.
Métodos
Población de estudio y aleatorización
Los detalles de criterios de aleatorización y métodos de recolección de pacientes fueron ya publicados 7,10. Brevemente, la mayoría de las participantes se convocaron por medio de una campaña directa por correo dirigida a las mujeres elegibles. En adición a campañas de anuncios locales y nacionales en los medios.
Las mujeres elegidas tenían edades entre 50 y 79 años al inicio del tamizaje, habían sido histerectomizadas (de este modo consideradas postmenopáusicas para el propósito del reclutamiento), y debían haber residido durante tres años en el área.
Las exclusiones mayores fueron relacionadas con riesgos competentes (cualquier condición médica asociada con una predicción de supervivencia de tres años), seguridad (p. ej. cáncer de mama previo u otros cánceres en los últimos 10 años. Con excepción del cáncer de piel diferente al melanoma), problemas de adhesión y retención (p. ej. alcoholismo, demencia y problemas de motilidad) o a juicio clínico del prestador de salud de la participante de continuar la terapia hormonal en mujeres osteoporóticas sintomáticas.
Se requirió un período de lavado de tres meses para aquellas mujeres que usaban terapia hormonal al tamizaje inicial. Antes del informe del HERS en 199711 el cual cambió los criterios de eligibilidad, 171 mujeres con historia de tromboembolismo venoso (TEV) fueron reclutadas.
Los protocolos de consentimiento fueron aprobados por el comité institucional de cada participante (ver al final del artículo) y todas las mujeres dieron un consentimiento escrito.
Las mujeres elegibles se aleatorizaron a recibir 0.625 mg/día de EEC (Premarin, Wyeth, St Davids, Pa) o a placebo, en iguales proporciones.
La aleatorización computarizada y los procedimientos ciegos ya se han descrito12. Un pequeño balance en el número de mujeres en cada grupo fue la consecuencia de un cambio en el protocolo inicial eliminando la intervención de estrógenos solos en mujeres con útero8.
Seguimiento y recolección de datos
Las participantes del estudio fueron contactadas por teléfono seis semanas después de la aleatorización para averiguar por síntomas y reafirmar la adherencia al tratamiento. Cada seis meses se hizo el seguimiento por teléfono o por visitas clínicas, con visitas clínicas exigidas cada año.
En cada contacto se comprobó adherencia al tratamiento, y se obtuvo información de síntomas, problemas de seguridad y objetivos. Se practicaron electrocardiogramas de base en las visitas de los años 3, 6 y 9.
Se requirieron mamografías y examen de senos anuales; la medicación se suspendía si esas medidas de seguridad no se realizaban o los resultados no podían ser verificados. Las participantes se siguieron desde su ingreso hasta la muerte, pérdida en el seguimiento o al tiempo de la pérdida de contacto a pesar de la adherencia a la medicación del estudio.
Se midieron lípidos de base al año en especímenes de sangre en ayunas en una submuestra aleatorizada del 8.6% de las mujeres. Los métodos de la colección de las submuestras y el manejo y la calidad ya se han publicado12.
Continuidad y suspensión de la medicación en el estudio
Durante el ensayo los síntomas intolerables tales como mastodinia se manejaron reduciendo el número de días en la semana en que se tomó la medicación. La participante y el personal participante en el estudio desconocían el proceso cuando se hicieron esos ajustes.
La medicación del estudio se suspendió en participantes que experimentaron un infarto del miocardio (IM), ACV, fractura o una injuria que requiera hospitalización, cirugía en que se emplee anestesia. Cualquier enfermedad que termine en inmovilización por más de una semana, cualquier otra enfermedad grave en la cual el uso de hormonas se considerara inapropiada.
La decisión de reiniciar la medicación del estudio después de un IM o ACV fue dejado a discreción del centro hospitalario, de la participante y de su médico.
La medicación del estudio fue definitivamente descontinuada en mujeres que desarrollaron cáncer de mama, trombosis venosa profunda (TVP), o embolismo pulmonar, (EP), melanoma maligno; meningioma, triglicéridos en niveles mayores de 1000 mg/dL (11.3 mmol/L); o quienes fueron formulados por su personal de salud con estrógenos, testosterona o modulador selectivo de estrógenos.
Determinación de objetivos
Los objetivos a ser evaluados fueron extraídos de las historias clínicas por médicos asignados para cada centro médico, quienes fueron ciegos a la asignación de tratamiento y a los síntomas relacionados con la medicación del estudio.
La adjudicación final de la clave de los objetivos cardiovascular y cáncer, también como el de fractura de cadera y muertes se realizó centralmente por médicos del WHI, neurólogos o cancerólogos.
Los resultados a nivel central fueron informados a medida que estaban disponibles, junto con eventos adjudicados localmente. Incluidos cuando la adjudicación central no había sido completada.
Los resultados adjudicados centralmente estuvieron disponibles en un 95.7% para eventos C, 92.4% para ECV, 91.8% para casos de TE, 97.2% para cáncer de mama, 99.2% para cánceres colorectales, 89.2% para fracturas de cadera, y 80.3% para muertes.
Las definiciones detalladas de los objetivos y los métodos de verificación, documentación y clasificación de los objetivos ya han sido publicadas13.
Enfermedad cardiovascular.
La enfermedad cardíaca coronaria se definió como IM agudo cuando requería un día de hospitalización, IM silenciosa determinada por series de electrocardiogramas tomados cada 3 años, o muerte debido a una ECV.
El ACV se definió como el inicio rápido de un déficit neurológico de más de 24 horas de duración. Apoyado por imágenes en la mayoría de los casos (89.8% tenían estudios de tomografía computarizada/ resonancia nuclear disponibles).
El tromboembolismo venoso fue definido como embolismo pulmonar, EP, o trombosis venosa profunda, TVP, y requirió síntomas clínicos apoyados por estudios diagnósticos relevantes.
Los eventos totales de ECV incluyen enfermedad cardíaca coronaria, (ECC), ACV, TVP, angina que requiera hospitalización, procedimientos de recanalización coronaria, falla cardíaca congestiva, enfermedad arterial carótida, y enfermedad vascular periférica.
Cáncer.
Todos los cánceres diferentes a los cánceres de piel, con excepción del melanoma, fueron confirmados por informe de patología, disponible en un 98.2% para cánceres invasivos de mama, 95.0% de cánceres colorrectales, y 80.6% para otros cánceres.
Fracturas.
Todas las fracturas clínicas reportadas diferentes a las de costilla, esternón, cráneo / cara, dedos de manos y pies, y vértebras cervicales, fueron verificadas por visión radiológica, RNM o informes quirúrgicos; los investigadores del WHI no obtuvieron Rx de columna para verificar las fracturas vertebrales subclínicas.
Índice global.
El índice global de riesgos y beneficios se definió para cada mujer al momento del primer evento entre los objetivos monitoreados (ECV, ACV, TE, cáncer de mama, cáncer colorrectal, fracturas de cadera, y muerte)14 .
Poder estadístico y análisis
El diseño del estudio asumió que 12.375 mujeres necesitarían ser aleatorizadas para alcanzar un poder del 81% para detectar una reducción del 21% en las tasas de ECV, para un seguimiento proyectado a 9 años en promedio.
Este tamaño de muestra podría proveer 65% de poder estadístico para detectar una reducción del 20% en las tasas de fracturas de cadera.
Un seguimiento adicional de 5 años fue planeado para alcanzar un poder del 79% para detectar un 22% de aumento de las tasas de cáncer de mama7. Los cálculos basados en el tamaño de la muestra observada y la edad de distribución daba un poder estimado de 72%, 55% y 71% para ECV, fractura de cadera y cáncer de mama respectivamente12.
La falta de adherencia a la medicación del estudio se sumó a cada año de seguimiento como la proporción acumulativa de las pacientes aleatorizadas que habían suspendido la medicación (dropouts) y similarmente la proporción de mujeres que comenzaban a tomar la medicación de hormonas menopáusicas a través de la prescripción de su profesional de salud (pro-ins), después de excluir las muertes anteriores.
Las participantes se clasificaron por su más reciente estatus con miras a la medicación del estudio (hállase suspendido o no). Aquellas mujeres que temporalmente suspendieron el estudio, la medicación del estudio, se consideraron adherentes en este análisis.
Las comparaciones de las tasas de eventos se basaron en el principio de “intento de tratar” usando métodos de falla de tiempo.
Para un objetivo determinado, el tiempo del evento se definió como el número de días entre la aleatorización y el primer diagnóstico postaleatorización del evento designado. Para los IMs silenciosos, la fecha del electrocardiograma de seguimiento fue usada como la fecha del evento.
El tiempo de seguimiento fue censado al tiempo del último contacto o muerte documentados.
Las comparaciones de los objetivos primarios son presentadas como riesgos de peligros (HR) y los intervalos de confidencia del 95% (ICs) del análisis proporcional de riesgo de Cox15, estratificados por edad, enfermedad anterior, y estatus de aleatorización en el ensayo de dieta baja en grasa.
La tasa de riesgo acumulativo se estimó por el método de Kaplan-Meier para cada objetivo designado.
Dos formas de índice de confidencia (IC) de variabilidad fueron calculados y, como tal, son comparables con la mayoría de otros informes de estudios de terapia hormonal.
Para reconocer múltiples temas medidos, se calcularon ICs usando métodos de secuencia de grupos y para objetivos secundarios una corrección de Bonferroni basada en el plan de monitoría de los datos y seguridad (ver abajo). Debido a que el ensayo estuvo cerca de la terminación, como había sido planeado, el impacto del ajuste de secuencia de grupo en la amplitud del ICs es pequeño.
La corrección de Bonferroni refleja el diseño y las prioridades de monitoría del estudio y por lo tanto puede ser menos relevante para la interpretación de los resultados del mismo.
A menos que se indicara otra cosa, todos los ICs y valores p son nominales. El análisis estadístico fue realizado usando la versión 9.0 SAS (SAS Institute, Cary, NC) y la significancia fue establecida al nivel 0.5 por aproximadamente un factor en esas series. El análisis de sensibilidad fue dirigido a explorar el posible impacto en la falta de adherencia a los medicamentos del estudio.
En ese “anales complier” la asignación a la aleatorización se conservó pero el seguimiento para una mujer fue censado seis meses después de que ella fuese considerada no adherente (definida como si tomara el 80% de las píldoras recetadas para el estudio).
Datos y monitoría de seguridad.
Los enlaces de monitoría estadística se basaron en los procedimientos secuenciales de grupo de O‘Brien-Flemeing16, con enlaces asimétricos para beneficios (0.025 nivel mayor de enlace para ECV) y adversidades (0.05 nivel menor de enlace). Los enlaces para efectos adversos para monitoría a los 6 meses de objetivos como ECV, ACV, ET, fracturas de cadera, cáncer colorectal, y muertes por causas diferentes a las enfermedades monitorizadas incorporadas a la corrección de Bonferroni.
La corrección de Bonferroni no se aplicó a cáncer de mama porque éste fue el objetivo primario de seguridad. Se consideró la suspensión temprana si un enlace con una enfermedad específica se cruzaba y el índice global era soporte para la dirección total de los efectos de los EEC.
Resultados
Monitoría del ensayo y terminación temprana
A principios del 2000 y de nuevo en el 2001, después de revisar los datos del estudio de los estrógenos solos y los estrógenos más progestinas, el comité de seguridad (DSMB) recomendó que se informara a las participantes en ambos estudios, de un aumento temprano de las tasas de enfermedad cardíaca, ACVs, y coágulos sanguíneos en las mujeres que tomaban las píldoras con hormonas activas.
En el 2002, con la suspensión temprana del ensayo de estrógenos más progestinas, las participantes en el ensayo de estrógenos solos se informaron del no aumento de las tasas de cáncer de mama en las mujeres que en ese momento tomaban EEC. La DSMB continuó monitorizando muy de cerca el brazo de estrógenos solos.
Los revisores del DSMB de los datos del análisis interno planeado para agosto del 2003, más un análisis no planeado usando los datos desde noviembre 30 de 2003, no llegaron a una recomendación de consenso.
Ninguno de los enlaces predefinidos para suspenderlo se habían cruzado, aunque el ACV se fue aproximando como el efecto adverso.
En febrero 2 de 2004, siguiendo la revisión con revisores adicionales:
El NIH decidió suspender la fase de intervención del estudio. El NIH concluyó que se había completado un período de seguimiento de casi 7 años y que el EEC no parecía afectar el riesgo de ECV, el objetivo primario del estudio.
Además el NIH encontró un riesgo aumentado de ACV que fue igual al reportado en el estudio de estrógenos más progestinas.
Reconociendo el riesgo de ACV y que no se podría demostrar cardioprotección o riesgo de cáncer de mama en el período de intervención restante. El NIH consideró inaceptable exponer a mujeres sanas en un ensayo de prevención, a este riesgo17.
En marzo 1 de 2004 las participantes fueron informadas sobre la terminación del estudio y se les advirtió que descontinuarán la medicación asignada.
Los datos disponibles hasta febrero de 2004 por recolección rutinaria se incluyeron en este informe.
Características basales
Entre 1993 y 1998, un total de 10.739 mujeres fueron aleatorizadas en el brazo de estrógenos solos. Las características demográficas, historia clínica, y el comportamiento de salud de esas mujeres se han descrito con detalles18.
En general, las participantes en el estudio fueron sanas y a un riesgo promedio de ECV y cáncer de mama, aunque 441(4.1%) con IM previo y revascularización coronaria fueron enroladas.
Los grupos de intervención fueron bien balanceados basalmente sobre factores de características demográficas y riesgo de enfermedad.
Seguimiento, adherencia y pérdida del doble ciego
Se conoce el estatus vital de 10.276 (94.8%) de las participantes aleatorizadas, incluyendo 580 (5.4%) que se sabía habían muerto. En un promedio de 6.8 años de seguimiento (rango 5.7-10.7 años).
Solo 563 mujeres (5.2%) se cancelaron, y fueron consideradas como pérdidas para el seguimiento o habían suspendido proveyendo información de los objetivos por más de 18 meses
Al momento de la terminación del estudio, el 53.8% de las mujeres habían suspendido la toma de la medicación del estudio. Las tasas de suspensión excedía las diseñadas en el proyecto, particularmente las más tempranas. Pero no difería significativa de la asignación por aleatorización y fueron estables después del año, aun con la terminación del ensayo de estrógenos más progestinas.
Algunas mujeres iniciaron hormonas por medio de su médico personal: 5.7% en el grupo de las mujeres con EEC y 9.1% en el grupo de placebo con un seguimiento de hasta 6 años. Las tasas de suspensión en el grupo placebo también fueron mayores que las esperadas.
Las razones para el inicio de hormonas, fuera del estudio, no se determinaron. La pérdida de la condición ciega del ginecólogo a la aleatorización del estudio fue poco frecuente, ocurriendo solo en 100 mujeres en el grupo de EEC y 83 en el grupo placebo.
Por el protocolo, la asignación a tratamiento no fue revelado a otros miembros del grupo o a participantes del estudio.
Objetivo intermedio de enfermedad cardiovascular (ECV)
Niveles de lípidos en sangre en ayunas en una submuestra de mujeres al inicio y al año, mostró una mayor reducción de colesterol LDL (–13.7% vs. 10%, p 0.001) y un mayor incremento en el colesterol HDL (15.1% vs. 1.1%), p 0.001) en el grupo EEC comparado con el grupo placebo.
Las reducciones del colesterol total desde el inicio a un año fueron comparables (–2.3% vs. –1.4%, p 0.41). Un mayor aumento en niveles de triglicéridos a un año, se observó en el grupo de EEC que en el grupo placebo (25% vs. 3.0%, p 0.001).
La presión sanguínea sistólica a un año fue mayor que el promedio (SE) de 1.1 (0.4) mm Hg en mujeres tomando EEC que en mujeres tomando placebo (p 0.003) y permace elevada a través del seguimiento. La presión diastólica no difiere entre los grupos del estudio (no se muestran los datos).
Resultados clínicos de enfermedad cardiovascular
El objetivo primario de este estudio fue la tasa de ECV. La tasa observada de 51 por 10.000 personas año fue 15% menor que lo proyectado en el diseño. No se observó diferencia significativa en la tasa de ECV comparada con la del placebo (49 vs. 54 por 10.000 personas-año; 9.0% de reducción).
Esos datos descartan una reducción en las tasas de ECV de más del 25% durante el período del ensayo.
La incidencia de ACV se incrementó en un 39% en el grupo de EEC (44 vs. 32 por 10 000 personas-año; z –2.72, p 0.007), el cual fue cruzado con el efecto adverso, enlace monitorizado para el catorceavo análisis interino planeado (definido como z –2.69).
El riesgo de TEV, incluyendo tromboembolismo venoso profundo, TVP, y tromboembolismo pulmonar, para las mujeres tomando EEC (28 vs. 21 por 10.000 personas-año, tuvo un 33% de aumento, aunque solamente el TVP tuvo significancia estadística (p 0.03). El total de eventos cardiovasculares, incluyendo el ACV, fueron 12% mayores en las mujeres que tomaron EEC (225 vs. 201 por personas-año; p 0.02).
Cáncer
El cáncer invasivo de mama, objetivo primario de seguridad para este estudio, fue diagnosticado a una tasa de 23% inferior en el grupo de EEC que en el grupo placebo (26 vs. 33 personas-año, y esta comparación tiene una muy estrecha no significancia estadística (p 0.06).
No se encontraron diferencias significativas en cáncer colorectal para EEC vs. placebo (17 vs. 16 por 10.000 personas-año); o de cáncer total (103 vs. 110 personas-año).
Fracturas
El uso de EEC reduce la tasa de fracturas de 30% a 39%. La tasa de fracturas de cadera fue de 11 vs. 17 por 10 000 personas-año (p 0.01); las fracturas vertebrales clínicas 11 vs. 17 por 10 000 personas-año (p 0.02); y el total de fracturas osteoporóticas, 139 vs. 195 por 10.000 personas-año (p 0.001).
Resumen de mediciones
El índice global de riesgos y beneficios se balanceó en general (RR, 1.01; IC 95%, 0.91-1.12).
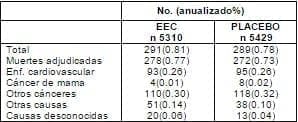
De las 580 muertes reportadas, 94.8% habían sido adjudicadas. El uso de EEC no afectó significativamente la tasa global de mortalidad o causa de mortalidad específica (tabla 1).
Tabla 1. Causas de muerte.
Tendencias en el tiempo
Las diferencias en los riesgos acumulativos para ACV y en menor grado las fracturas de cadera comienzan a emerger temprano en el período de intervención y persisten a través del seguimiento.
Las tasas de riesgo acumulativo para cáncer de mama comienzan a separarse a los 2 años. Figuras similares para el índice global y las muertes, reafirma la comparabilidad de esas tasas entre los grupos de tratamiento.
Los test de tendencia en el tiempo, desde la aleatorización, se computaron para todos los objetivos monitorizados y compuestos usando el modelo de riesgos proporcionales de Cox, con un tratamiento de interacción a término de tiempo dependiente.
La enfermedad coronaria fue el único objetivo con tendencia estadísticamente significativa (p 0.02) de riesgo ligeramente elevado en el período de seguimiento temprano, pero ésta disminuye con el tiempo (año 1, 1.16; año 2, 1.20; año 3, 0.89; año 4, 0.79; año 5, 1.28; año 6, 1.24; y año 7, 0.42).
Análisis posterior
Se hizo análisis exploratorio para determinar si las características seleccionadas de los participantes modificaban los efectos de los EEC sobre las tasas de eventos de los objetivos clínicos.
No hubo interacción significativa entre EEC y raza, etnicidad, índice de masa corporal en el riesgo de ECV, ACV, TEV, cáncer de mama, cáncer colorectal, fracturas de cadera o fracturas osteoporóticas totales (no se muestran los datos).
De particular interés para todos los objetivos fue la edad de ingreso.
El único tratamiento de interacción de la edad que alcanzó significancia estadística fue para cáncer colorectal (p 0.048), por el cual el aumento de la edad se asoció a aumento del riesgo con el uso de EEC.
El efecto de enfermedad anterior en la tasa de eventos cardiovasculares también se evaluó.
Entre las 441 mujeres enlistadas con previo IM o procedimiento de revascularización, el efecto de EEC relativo al placebo (33 vs. 31; RR 1.04; IC 95%, 0.63-1.71) no difiere significativamente del efecto de EEC en mujeres sin ECV documentada (1.43 vs. 1.62; RR 0.91; IC 95 %, 0.73-1.14) (p 0.55). De forma similar, en 168 mujeres con ACV previo, el RR para ACV subsecuente (6 vs. 6; RR 1.67; IC 95%, 0.52- 5.36) no difiere del RR en mujeres sin historia de ACV (152 vs. 112; RR 1.39; IC, 1.09-1.78) (p 0.77). Descartando las pocas participantes con historia de TE no se alteró sustancialmente el riesgo de peligro para EP (47 vs. 37; RR 1.31; IC 95%, 0.85-2.01) como para ser una indicación del impacto potencial de la falta de adherencia a la medicación asignada en el estudio.
Comparado con el análisis primario de “intento de tratar”, los modelos estimaron riesgos mayores de ACV (RR 1.74), embolismo pulmonar EP (RR 1.99), mortalidad total (RR 1.26), fractura de cadera (RR 0.48) y cáncer colorectal (RR 0.92). Los RRs para ECV (RR 0.89) y el índice global (RR, 1.06) no cambiaron esencialmente.
Comentario
El estudio WHI-Estrógenos solos, es un estudio a gran escala, aleatorizado doble ciego, controlado con placebo, designado para probar los efectos de la terapia hormonal postmenopáusica más comúnmente usada en los Estados Unidos, sobre la incidencia de enfermedad crónica en una población adversa de, en la mayoría, mujeres jóvenes entre 50 y 79 años.
Como fue concebido, el estudio tenía poder adecuado para detectar efectos moderados en ECV, fracturas de cadera, y, con seguimiento a largo término, cáncer de mama. Entre las mujeres a través del amplio rango de edad, relevante para la hipótesis de prevención. Este ensayo demostró que el riesgo de ECV o su posible asociación se debe al azar.
Estos resultados de los efectos de los EEC sobre la ECV difieren de los dos estudios previos de estrógenos más progestinas.
En ambos, el WHI25 estrógenos-progestinas y el HERS26, el riesgo de ECV fue significativamente elevado en el primer año de tratamiento y la tasa acumulativa del efecto de los estrógenos más progestinas nunca fue favorable.
En el estudio actual se observó un muy pequeño, no significativo Y aumento en el primer año de la exposición a EEC, pero los efectos acumulativos sugieren un posible leve beneficio por el uso a largo plazo.
Explicaciones potenciales para la discrepancia en los resultados incluyen el papel de las progestinas, las diferencias en la población del estudio en los factores de riesgos de base12, la duración de la intervención y el seguimiento, y el papel del azar.
Los efectos adversos observados de los EEC sobre el riesgo de ACV:
Son consistentes con los riesgos reportados por los estudios de estrógenos y progestinas del WHI y del HERS27-28.
Además, el uso de estradiol entre mujeres, después de un ACV isquémico, no produjo cambios en la mortalidad pero ocasionó una mayor tasa de recurrencia de ACV no fatal y un posible déficit funcional más severo29.
Y el pequeño, pero persistente aumento de la presión arterial sistólica en mujeres tomando EEC es una posible contribución a este efecto; la relativamente pequeña diferencia en la presión sanguínea ha sido asociadas positivamente con diferencias en las tasas de ACV y ECV30-31.
El estudio WHI-estrógenos solos, no da fuerte evidencia de que los EEC reduzcan el riesgo de fracturas de cadera, vertebrales clínicas y otras fracturas. Estas reducciones fueron de igual magnitud que las observadas en el WHI estrógenos progestinas32 y son consistentes con los hallazgos de estudios previos33, 4 y de meta-análisis recientes35, 37 .
La tendencia hacia la reducción en la incidencia de cáncer de mama no se esperaba y es opuesto a lo observado en el estudio WHI estrógenos y progestinas. El cual reportó un riesgo aumentado en 24%.
Estos resultados también parecen contrarios a la preponderancia de los resultados de estudios observacionales. Incluyendo el One Million Women4, 39-40. Cuando examinamos los riesgos de cáncer de mama por el tipo de terapia hormonal, la mayoría de los estudios han reportado un aumento leve del riesgo de cáncer de mama con estrógenos solos, pero un mayor riesgo para estrógenos progestágenos.
Aun otros, recientemente, han encontrado poco o ningún efecto de los estrógenos solos sobre el riesgo de cáncer de mama41. Las diferencias en el tamizaje de cáncer de mama entre los grupos de EEC y placebo no explican los efectos observados sobre cáncer de mama porque el protocolo del WHI solicitaba mamografías y examen clínico de mamas anualmente.
La posibilidad de que la demora en el diagnóstico pudiese contar para esta reducción parece remota porque el efecto de los EEC solos sobre la densidad mamaria es mínima42.
El conocimiento de los efectos a largo término de los EEC sobre el cáncer de mama, aun es incierto. Extender el seguimiento, como fue planeado, y el análisis de las características del cáncer de mama similares a las reportadas para los estudios de estrógenos más progestinas puede brindar datos adicionales38.
En análisis preliminares de subgrupos, los RR estimados para EEC para varios objetivos monitoreados, incluyendo el índice global, fueron más bajos para mujeres entre 50 y 59 años, aunque las diferencias entre los grupos de edad no fueron estadísticamente significativas.
Mientras estos resultados sugieren que los EEC pueden ser de alguna manera más favorables en las mujeres más jóvenes que en las mayores, este análisis de subgrupos debe ser interpretado con cautela, no podemos excluir el papel del azar o el limitado poder del estudio.
Limitaciones
Este estudio fue diseñado para probar solo un preparado de estrógenos, sin oposición, a una sola dosis y por vía oral. No podemos determinar si estos resultados pueden aplicarse a otras preparaciones, dosis o rutas de administración.
Debe tenerse cuidado al hacer comparaciones de los resultados de este estudio de estrógenos solos con el de estrógenos progestinas, aunque esto es de considerable interés.
La diferencia entre las poblaciones de los dos estudios en sus características basales18, 43, sus tasas de eventos, la duración de la intervención y el tiempo de seguimiento, y lo completo de los datos en este reporte inicial son suficientes para hacer de contrastes simples errores potenciales.
Un análisis más detallado de esos estudios paralelos han sido planeado.
Las altas tasas de abandono del medicamento y las tasas más altas de lo esperado del paso de placebo al uso de hormonas son limitaciones adicionales. Las tasas de suspensión de la medicación es menor que la observada en la práctica clínica44 y fue similar en los dos grupos.
La un poco más alta tasa de suspensión en el grupo placebo, no explica la pérdida del doble ciego, que fue infrecuente (1.5%) y similar en los dos grupos.
El análisis de sensibilidad sugiere que la falta de adherencia a la medicación del estudio asignada puede diluir los efectos de los EEC, positiva o negativamente, relativo a lo que se podría haber observado si la adherencia hubiera sido total, pero no distorsiona el balance total de los efectos.
Las tasas más bajas que las esperadas para algunos objetivos, particularmente ECV y fracturas de cadera:
Reduce el poder relativo para el cual fue originalmente proyectado el estudio, pero refuerza el estado general de salud de las participantes. El hecho de que el estudio fuese suspendido tempranamente disminuye la precisión de los efectos estimados.
Un período de intervención mayor podría haber dado mayor evidencia estadística de los efectos de los EEC, particularmente sobre la ECV, para lo cual una evidencia de tendencia a través del tiempo fue observada; y para cáncer de mama, para el que el efecto acumulativo de exposición a largo plazo permanece incierto.
Datos adicionales podrían haber sido permitidos para mayor análisis de los subgrupos. Se planea seguimiento posterior de estas mujeres para intervención posterior.
Implicaciones clínicas
En mujeres entre 50 y 79 años con antecedente de histerectomía, los EEC no afectan las tasas de ECV pero aumentan el riesgo de ACV, con un exceso de riesgo de 12 casos por 10.000 personas-año, y reducen el riesgo de fracturas de cadera, resultando en 6 casos menos por 10.000 personas-año.
Inesperadamente, mujeres tomando EEC también parecen ser diagnosticadas con menos eventos de cáncer de mama que las que toman placebo, pero los 7 casos menos estimados por 10.000 personasaño, no alcanzan significancia estadística.
La totalidad de efectos monitorizados, como se resume en el índice global preespecificado, sugiere un balance total de riesgos y beneficios y, muy importante, no efectos en la mortalidad total.
Basados en estos hallazgos, las mujeres y los profesionales de la salud que las cuidan tienen ahora riesgos estimados de beneficios y peligros de los EEC solos.
Las mujeres que estén considerando tomar EEC deben ser aconsejadas sobre el riesgo de ACV pero se les puede asegurar que no hay un exceso de riesgo de ECV y cáncer de mama por al menos 6.8 años de uso.
Al presente estos datos no demuestran un beneficio global de los EEC sobre la prevención de enfermedad crónica en mujeres postmenopáusicas y esto es un argumento contra su uso con esos fines.
Finalmente, estos datos apoyan las recomendaciones actuales de la Food and Drugs Administration para mujeres postmenopáusicas, de usar los EEC solamente para síntomas menopáusicos y a la dosis efectiva más baja y por el menor tiempo posible45.
Autores/WHI Steering Committee
(Comité directivo del WHI)
Garnet L. Anderson, PhD (writing group chair, Fred Hutchinson Cancer Research Center, Seattle, Wash); Marian Limacher, MD (writing group cochair, University of Florida, Gainesville/Jacksonville). Members (in alphabetical order): Annlouise R. Assaf, PhD (BrownUniversity, Providence, RI);
Tamsen Bassford, MD (University of Arizona, Tucson/Phoenix); Shirley A. A. Beresford, PhD (Fred Hutchinson Cancer Research Center, Seattle); Henry Black, MD (Rush-Presbyterian-St Luke’s Medical Center, Chicago, Ill); Denise Bonds, MD (Wake Forest University School of Medicine, Winston-Salem, NC); Robert Brunner, PhD (University of Nevada, Reno);
Robert Brzyski, MD (University of Texas Health Science Center, San Antonio); Bette Caan, DrPH (Kaiser Permanente Division of Research, Oakland, Calif); Rowan Chlebowski, MD (Harbor-UCLA Research and Education Institute, Torrance, Calif); David Curb, MD (University of Hawaii, Honolulu); Margery Gass, MD (University of Cincinnati, Cincinnati, Ohio); Jennifer Hays, PhD (Baylor College of Medicine, Houston, Tex); Gerardo Heiss, MD (University of North Carolina, Chapel Hill); Susan Hendrix, DO (Wayne State University School of Medicine/Hutzel Hospital, Detroit, Mich); Barbara V. Howard, PhD (MedStar Research Institute/Howard University, Washington, DC);
Judith Hsia, MD (George Washington University Medical Center, Washington, DC); Allan Hubbell, MD(University of California at Irvine, Orange); Rebecca Jackson, MD (The Ohio State University, Columbus); Karen C. Johnson, MD (University of Tennessee, Memphis); Howard Judd, MD (University of California at Los Angeles); Jane Morley Kotchen, MD(Medical College of Wisconsin, Milwaukee); Lewis Kuller, MD(University of Pittsburgh, Pittsburgh, Pa);
Otros Autores/WHI Steering Committee
Andrea Z. La- Croix, PhD (Fred Hutchinson Cancer Research Center, Seattle); Dorothy Lane, MD (State University of New York at Stony Brook); Robert D. Langer, MD (University of California at San Diego, LaJolla/Chula Vista); Norman Lasser, MD(University of Medicine and Dentistry of New Jersey, Newark); Cora E. Lewis, MD (University of Alabama at Birmingham); JoAnn Manson, MD(Brigham and Women’s Hospital, Harvard Medical School, Boston, Mass); Karen Margolis, MD (University of Minnesota, Minneapolis); Judith Ockene, PhD (University of Massachusetts/Fallon Clinic, Worcester);
Mary Jo O’Sullivan, MD (University of Miami, Miami, Fla); Lawrence Phillips, MD (Emory University, Atlanta, Ga); Ross L. Prentice, PhD (Fred Hutchinson Cancer Research Center, Seattle); Cheryl Ritenbaugh, PhD (Kaiser Permanente Center for Health Research, Portland, Ore); John Robbins, MD (University of California at Davis, Sacramento);
Jacques E. Rossouw, MD (National Heart, Lung, and Blood Institute, Bethesda, Md); Gloria Sarto, MD (University of Wisconsin, Madison); Marcia L. Stefanick, PhD (Stanford Prevention Research Center, Stanford University, Stanford, Calif);
Linda Van Horn, PhD (Northwestern University, Chicago, Ill); Jean Wactawski- Wende, PhD (University at Buffalo, Buffalo, NY); Robert Wallace, MD (University of Iowa, Iowa City/ Davenport); Sylvia Wassertheil-Smoller, PhD (Albert Einstein College of Medicine, Bronx, NY).
Declaración de conflicto de intereses
El Dr Anderson ha recibido honorarios como conferencista de otras instituciones académicas y sin ánimo de lucro y de varias compañías farmacéuticas, incluyendo Wyeth.
El Dr Assaf es un empleado de Pfizer Inc, El Dr Chlebowski ha servido como consultor de Astra-Zeneca, Lilly, Novartis, y Pfizer, El Dr Gass ha recibido donaciones y contratos de Duramed, Lilly, GlaxoSmithKline, Merck, Pfizer, Procter and Gamble y Wyeth; honorarios de Aventis, Lilly, GlaxoSmithKline, Merck, Ortho-McNeil, y Procter and Gamble; y sirve en el comité consultivo de Lilly, Merck, y Procter and Gamble,
Dr Jackson ha recibido soporte para investigación de Procter and Gamble y Merck:
Tiene acciones en Procter and Gamble, El Dr LaCroix ha consultado con/y ha recibido honorarios de CME speaking engagements patrocinado por Wyeth, Procter and Gamble, Merck y Pfizer; también es investigador principal de un estudio de osteoporosis financiado por Pfizer,
El Dr Langer ha recibido soporte para investigación de Wyeth y Organon; ha recibido honorarios como conferencista de Solvay, Monarch- King, y Ortho- McNeil, El Dr Lewis ha recibido aportes para investigacion de Lilly, Novartis, y Pfizer, El Dr Wactawski-Wende ha recibido honorarios como conferencista de Merck y soporte en investigación de Wyeth.
Correspondencia:
Garnet L. Anderson, PhD, WHI Clinical Coordinating Center, Fred Hutchinson Cancer Research Center, 1100 Fairview Ave N, M3-A410, Box 19024, Seattle, WA 98109 (garnet@whi.org ). Marian Limacher, MD, Division of Cardiovascular Medicine, University of Florida Health Science Center, 1600 SW Archer Rd, Room M409, PO Box 100277, Gainsville, FL 32610-0277 (limacmc@medicine.ufl.edu ).
Copias:
The WHI Clinical Coordinating Center, Division of Public Health Sciences, Fred Hutchinson Cancer Research Center, 1100 Fairview Ave N, M3-A410; PO Box 19024, Seattle, WA 98109-1024.
Contribución de los autores:
Como coinvestigador principal del centro de Coordinación Clínica del WHI, el Dr Anderson tuvo acceso total a todos los datos en el estudio, tiene la responsabilidad de la integridad, la exactitud del análisis de los datos. Concepto del estudio y diseño: Anderson, Black, Curb, Kuller, Langer, Lewis, Manson, Margolis, Prentice, Robbins, Rossouw, Stefanick, Wactawski- Wende, Wallace.
Adquisición de los datos: Anderson, Limacher, Assaf, Bassford, Beresford, Black, Bonds, Brunner, Brzyski, Caan, Chlebowski, Curb, Gass, Hays, Heiss, Hendrix, Howard, Hsia, Hubbell, Jackson, Johnson, Kotchen, Kuller, LaCroix, Lane, Langer, Lasser, Lewis, Manson, Margolis, Ockene, O’Sullivan, Phillips, Prentice, Ritenbaugh, Robbins, Sarto, Stefanick, Van Horn, Wactawski-Wende, Wallace, Wassertheil- Smoller.
Análisis e interpretación de los datos: Anderson, Limacher, Beresford, Black, Brunner, Brzyski, Chlebowski, Curb, Hays, Hendrix, Howard, Jackson, Judd, LaCroix, Langer, Lewis, Manson, Margolis, Ockene, Prentice, Rossouw, Stefanick, Wallace, Wassertheil-Smoller. Redacción del manuscrito: Anderson, Limacher, Curb, Kuller, LaCroix, Langer, Prentice.
Revisión crítica del manuscrito para conceptos importantes del contenido: Anderson, Limacher, Assaf, Bassford, Beresford, Black, Bonds, Brunner, Brzyski, Caan, Chlebowski, Curb, Gass, Hays, Heiss, Hendrix, Howard, Hsia, Hubbell, Jackson, Johnson, Judd, Kotchen, Kuller, LaCroix, Lane, Langer, Lasser, Lewis, Manson, Margolis, Ockene, O’Sullivan, Phillips, Ritenbaugh, Robbins, Rossouw, Sarto, Stefanick, Van Horn, Wactawski-Wende, Wallace, Wassertheil-Smoller.
Análisis estadístico: Anderson, LaCroix, Prentice. Obtención de fondos: Anderson, Assaf, Black, Brunner, Curb, Heiss, Hendrix, Lane, Langer, Lewis, Manson, Margolis, Ockene, Phillips, Prentice, Robbins, Rossouw, Stefanick, Wactawski-Wende, Wallace, Wassertheil- Smoller.
Soporte administrativo, técnico o material: Anderson, Assaf, Bassford, Beresford, Black, Brunner, Brzyski, Curb, Hays, Heiss, Hendrix, Howard, Hsia, Hubbell, Jackson, Johnson, Kotchen, Kuller, Langer, Lewis, Manson, Margolis, Prentice, Ritenbaugh, Robbins, Rossouw, Sarto, Stefanick, Wactawski-Wende, Wallace.
Supervisión del estudio: Assaf, Beresford, Black, Brunner, Brzyski, Caan, Chlebowski, Curb, Hays, Heiss, Hendrix, Howard, Hsia, Jackson, Johnson, Judd, Kuller, LaCroix, Lasser, Ritenbaugh, Robbins, Rossouw, Van Horn, Wactawski-Wende, Wallace.
Entidades de los investigadores del WHI:
(National Heart, Lung, and Blood Institute, Bethesda, Md): Barbara Alving, Leslie Ford, Lawrence Friedman, Nancy Geller, Sheri Ludlam, Joan McGowan, Nancy Morris, Vivian Pinn, Linda Pottern, Jacques E. Rossouw. Clinical Coordinating Centers: (Fred Hutchinson Cancer Research Center, Seattle, Wash) Ross L. Prentice, Garnet L. Anderson, Andrea Z. LaCroix, Charles Kooperberg, Barbara Cochrane, Anne McTiernan, Julie Hunt, Lesley Tinker, C. Y. Wang, Chu Chen, Deborah Bowen, Alan Kristal, Ruth Patterson, Janet Stanford, Noel Weiss, Emily White; (Wake Forest University School of Medicine,
Winston-Salem, NC) Sally Shumaker, Ronald Prineas, Michelle Naughton; (Medical Research Labs, Highland Heights, Ky) Evan Stein, Peter Laskarzewski; (University of California at San Francisco) Steven Cummings, Michael Nevitt, Maurice Dockrell; (University of Minnesota, Minneapolis) Lisa Harnack; (McKesson BioServices, Rockville, Md) Frank Cammarata, Steve Lindenfelser; (University of Washington, Seattle) Bruce Psaty, Susan Heckbert. Clinical Centers: (Albert Einstein College of Medicine, Bronx, NY) Sylvia Wassertheil-Smoller, William Frishman, Judith Wylie-Rosett, David Barad,
Ruth Freeman; (Baylor College of Medicine, Houston, Tex) Jennifer Hays, Ronald Young, Jill Anderson, Sandy Lithgow, Paul Bray; (Brigham and Women’s Hospital, Harvard Medical School, Boston, Mass) JoAnn Manson, Julie Buring, J. Michael Gaziano, Kathryn Rexrode, Claudia Chae; (Brown University, Providence, RI)
Otras Entidades de los investigadores del WHI:
Annlouise R. Assaf, Carol Wheeler, Charles Eaton, Michelle Cyr; (Emory University, Atlanta, Ga) Lawrence Phillips, Margaret Pedersen, Ora Strickland, Margaret Huber, Vivian Porter; (Fred Hutchinson Cancer Research Center, Seattle, Wash) Shirley A. A. Beresford, Vicky M. Taylor, Nancy F. Woods, Maureen Henderson, Robyn Andersen; (George Washington University, Washington, DC)
Judith Hsia, Nancy Gaba, Joao Ascensao; (Harbor-UCLA Research and Education Institute, Torrance, Calif) Rowan Chlebowski, Robert Detrano, Anita Nelson, James Heiner, John Marshall; (Kaiser Permanente Center for Health Research, Portland, Ore) Cheryl Ritenbaugh, Barbara Valanis, Patricia Elmer, Victor Stevens, Njeri Karanja; (Kaiser PermanenteDivision of Research, Oakland, Calif) Bette Caan, Stephen Sidney, Geri Bailey, Jane Hirata; (Medical College of Wisconsin, Milwaukee, Wis)
Jane Morley Kotchen, Vanessa Barnabei, Theodore A. Kotchen, Mary Ann C. Gilligan, Joan Neuner; (MedStar Research Institute/Howard University, Washington, DC) Barbara V. Howard, Lucile Adams-Campbell, Lawrence Lessin, Monique Rainford, Gabriel Uwaifo; (Northwestern University, Chicago, Ill) Linda Van Horn, Philip Greenland, Janardan Khandekar, Kiang Liu, Carol Rosenberg; (Rush-Presbyterian-St Luke’s Medical Center, Chicago, Ill) Henry Black, Lynda Powell, Ellen Mason;
Otras Entidades de los investigadores del WHI:
(Stanford Prevention Research Center, Stanford University, Stanford, Calif) Marcia L. Stefanick, Mark A. Hlatky, Bertha Chen, Randall S. Stafford, Linda C. Giudice; (State University of New York at Stony Brook) Dorothy Lane, Iris Granek, William Lawson, Gabriel San Roman, Catherine Messina; (The Ohio State University, Columbus) Rebecca Jackson, Randall Harris, Electra Paskett, W. Jerry Mysiw, Michael Blumenfeld; (University of Alabama at Birmingham) Cora E. Lewis, Albert Oberman, James M. Shikany, Monika Safford, Brian K. Britt; (University of Arizona, Tucson/Phoenix) Tamsen Bassford,
Cyndi Thomson, Marcia Ko, Ana Maria Lopez; (University at Buffalo, Buffalo, NY) Jean Wactawski-Wende, Maurizio Trevisan, Ellen Smit, Susan Graham, June Chang; (University of California at Davis, Sacramento) John Robbins, S. Yasmeen; (University of California at Irvine, Orange) Allan Hubbell, Gail Frank, Nathan Wong, Nancy Greep, Bradley Monk; (University of California at Los Angeles) Howard Judd, David Heber, Robert Elashoff; (University of California at San Diego, LaJolla/ Chula Vista) Robert D. Langer,
Y Otras Entidades de los investigadores del WHI:
Michael H. Criqui, Gregory T. Talavera, Cedric F. Garland, R. Elaine Hanson; (University of Cincinnati, Cincinnati, Ohio) Margery Gass, Suzanne Wernke, Nelson Watts; (University of Florida, Gainesville/Jacksonville) Marian Limacher, Michael Perri, Andrew Kaunitz, R. Stan Williams, Yvonne Brinson; (University of Hawaii, Honolulu) David Curb, Helen Petrovitch, Beatriz Rodriguez, Kamal Masaki, Santosh Sharma; (University of Iowa, Iowa City/Davenport) Robert Wallace, James Torner,
Susan Johnson, Linda Snetselaar, Bradley VanVoorhis; (University of Massachusetts/ Fallon Clinic, Worcester) Judith Ockene, Milagros Rosal, Ira Ockene, Robert Yood, Patricia Aronson; (University of Medicine and Dentistry of New Jersey, Newark) Norman Lasser, Baljinder Singh, Vera Lasser, John Kostis; (University of Miami, Miami, Fla) Mary Jo O’Sullivan, Linda Parker, R. Estape, Diann Fernandez; (University of Minnesota, Minneapolis) Karen L. Margolis, Richard H. Grimm, Donald. Hunninghake, June LaValleur, Sarah Kempainen; (University of Nevada, Reno) Robert Brunner, William Graettinger, Vicki Oujevolk; (University of North Carolina,
Otras Entidades de los investigadores del WHI:
Chapel Hill) Gerardo Heiss, Pamela Haines, David Ontjes, Carla Sueta, Ellen Wells; (University of Pittsburgh, Pittsburgh, Pa) Lewis Kuller, Jane Cauley, N. CaroleMilas; (University of Tennessee, Memphis) Karen C. Johnson, Suzanne Satterfield, Raymond W. Ke, Fran Tylavsky, Stephanie Connelly; (University of Texas Health Science Center, San Antonio) Robert Brzyski, Robert Schenken, Jose Trabal, Mercedes Rodriguez-Sifuentes, Charles Mouton; (University of Wisconsin, Madison) Gloria Sarto,
Douglas Laube, Patrick McBride, Julie Mares- Perlman, Barbara Loevinger; (Wake Forest University School of Medicine, Winston-Salem, NC) Denise Bonds, Greg Burke, Robin Crouse, Mara Vitolins, Scott Washburn; (Wayne State University School of Medicine/Hutzel Hospital, Detroit, Mich) Susan Hendrix, Michael Simon, Gene McNeeley.
Comité de monitoría de datos y seguridad: Janet Wittes (chair), Eugene Braunwald, Harvey Cohen, Elizabeth Barrett- Connor, David DeMets, Leo Dunn, Johanna Dwyer, Robert P. Heaney, Daniel Marson, Victor Vogel, Le- Roy Walters, Salim Yusuf.
Fondos/Financiación, papel de los patrocinadores: El NHLBI participó en el diseño, conducción y control del ensayo, revisó los datos de este informe, un representante de la NHLBI fue miembro del comité directivo del WHI, del grupo de los redactores. Wyeth dio las tabletas del estudio (activo y placebo) perono tuvo otro papel en el estudio.
Agradecimientos
Agradecemos y reconocemos el esfuerzo dedicado por los investigadores y el “staff” de los centros clínicos del WHI, el centro clínico coordinador del WHI y el programa de la NHLBI (lista disponible a https://www.whi.org ) y especialmente a Mary Pettinger por el análisis estadístico y Sheri Greaves por la asistencia en la preparación del manuscrito, queremos reconocer a los participantes en el WHI por su extraordinaria colaboración con el programa del WHI.
Referencias – Autor – Efecto de los Estrógenos Equinos Conjugados en las Mujeres Postmenopáusicas con Histerectomía
- 1. Stampfer M, Colditz G. Estrogen replacement therapy and coronary heart disease: a quantitative assessment of the epidemiologic evidence. Prev Med. 1991; 20: 47-63.
- 2. Bush TL, Barrett-Connor E, Cowan LD, et al. Cardiovascular mortality and noncontraceptive use of estrogen in women: results from the Lipid Research Clinics Program follow-up study. Circulation. 1987; 75: 1102-1109.
- 3. Grady D, Rueben SB, Pettiti DB, et al. Hormone therapy to prevent disease and prolong life in postmenopausal women. Ann Intern Med. 1992; 117: 1016-1037.
- 4. Dupont WD, Page DL. Menopausal estrogen replacement therapy and breast cancer. Arch Intern Med. 1991; 151: 67-72.
- 5. Steinberg KK, Thacker SB, Smith SJ, et al. A metaanalysis of the effect of estrogen replacement therapy on the risk of breast cancer. JAMA. 1991; 265: 1985-1990.
- 6. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52705 women with breast cancer and 108411 women without breast cancer. Lancet. 1997; 350: 1047-1059.
- 7. The Women’s Health Initiative Study Group. Design of the Women’s Health Initiative clinical trial and observational study. Control Clin Trials. 1998; 19: 61-109.
- 8. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA. 2002; 288: 321-333.
- 9. Hulley S, Grady D, Bush T, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. JAMA. 1998; 280: 605-613.
- 10. Hays J, Hunt JR, Hubbel A, et al. The Women’s Health Initiative recruitment methods and results. Ann Epidemiol. 2003; 13(9 suppl): S18-S77.
Otras Referencias – Autor – Efecto de los Estrógenos Equinos Conjugados en las Mujeres Postmenopáusicas con Histerectomía
- 11. Grady D, Hulley SB, Furberg C. Venous thromboembolic events associated with hormone replacement therapy [letter]. JAMA. 1997; 278: 477.
- 12. Anderson GL, Manson J, Wallace R, et al. Implementation of the Women’s Health Initiative study design. Ann Epidemiol. 2003; 13: S5-S17.
- 13. Curb D, McTiernan A, Heckbert SR, et al. Outcomes ascertainment and adjudication methods in the Women’s Health Initiative. Ann Epidemiol. 2003; 13(9 suppl): S122- S128.
- 14. Freedman LS, Anderson G, Kipnis V, et al. Approaches to monitoring the results of long-term disease prevention trials: examples from the Women’s Health Initiative. Control Clin Trials. 1996; 17: 509-525.
- 15. Cox Dr Regression analysis and life tables. J R Stat Soc. 1972; 34: 187-220.
- 16. O’Brien PC, Fleming TR. A multiple testing procedure for clinical trials. Biometrics. 1979; 35: 549-446.
- 17. NIH/NHLBI News Release. Statement from Barbara Alving, MD, Director of the Women’s Health Initiative and Acting Director of the National Heart, Lung, and Blood Institute. Available at: http: //www.nhlbi.nih.gov/new/press/04-03- 02. Accessed March 5, 2004.
- 18. Stefanick ML, Cochrane BB, Hsia J, Barad DH, Liu JH, Johnson SR. The Women’s Health Initiative postmenopausal hormone trials: overview and baseline characteristics of participants. Ann Epidemiol. 2003; 13(9 suppl): S78-S86.
- 19. Wysowski DK, Golden L, Burke L. Use of menopausal estrogens and medroxyprogesterone in the United States, 1982-1992. Obstet Gynecol. 1995; 85: 6-10.
- 20. Herrington DM, Reboussin DM, Brosnihan KB, et al. Effects of estrogen replacement on the progression of coronary-artery atherosclerosis. N Engl JMed. 2000; 343:522-529.
Bibliografías – Autor – Efecto de los Estrógenos Equinos Conjugados en las Mujeres Postmenopáusicas con Histerectomía
- 21. Waters DD, Alderman EL, Has J, et al. Effects of hormone replacement therapy and antioxidant vitamin supplements on coronary atherosclerosis in postmenopausal women: a randomized controlled trial. JAMA. 2002; 288: 2432-2440.
- 22. Clarke SC, Kelleher J, Lloyd-Jones H, et al. A study of hormone replacement therapy in postmenopausal women with ischaemic heart disease: the Papworth HRT atherosclerosis study. BJOG. 2002; 109: 1056-1062.
- 23. ESPRIT Team. Oestrogen therapy for prevention of reinfarction in postmenopausal women: a randomized placebo controlled trial. Lancet. 2002; 360: 2001-2008.
- 24. Hodis HN, Mack WJ, Azen SP, et al, for the Women’s Estrogen-Progestin Lipid-Lowering Hormone Atherosclerosis Regression Trial Research Group. Hormone therapy and the progression of coronaryartery atherosclerosis in postmenopausal women. N Engl J Med. 2003; 349: 535-545.
- 25. Manson JE, Hsia J, Johnson KC, et al. Estrogen plus progestin and the risk of coronary heart disease. N Engl J Med. 2003;349: 523-534.
- 26. Grady D, Herrington D, Bittner V, et al, for the HERS Research Group. Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). JAMA. 2002; 288: 49-57.
- 27. Wassertheil-Smoller S, Hendrix S, Limacher M, et al. Effect of estrogen plus progestin on stroke in postmenopausal women: the Women’s Health Initiative: a randomized trial. JAMA. 2003; 289: 2673-2684.
- 28. Simon JA, Hsia J, Cauley JA, et al. Postmenopausal hormone therapy and risk of stroke: the Heart and Estrogen/progestin Replacement Study (HERS). Circulation. 2001; 103: 638-642.
- 29. Viscoli C M, Brass LM, Kernan WN, et al. A clinical trial of estrogen-replacement therapy after ischemic stroke. N Engl J Med. 2001; 345: 1243-1249.
- 30. Prospective Studies Collaboration. Agespecific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002; 360: 1903-1913.
Otras Bibliografías – Autor – Efecto de los Estrógenos Equinos Conjugados en las Mujeres Postmenopáusicas con Histerectomía
- 31. Vasan RS, Larson MG, Leip EP, et al. Impact of high-normal blood pressure on the risk of cardiovascular disease. N Engl J Med. 2001; 345: 1291-1297.
- 32. Cauley JA, Robbins J, Chen Z, et al. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women’s Health Initiative randomized trial. JAMA. 2003; 290: 1729-1738.
- 33. Cauley JA, Seeley DG, Ensrud K, et al. Estrogen replacement therapy and fractures in older women. Ann Intern Med. 1995; 122: 9-16.
- 34. Weiss NS, Ure CL, Ballard JH, et al. Decreased risk of fractures of the hip and lower forearm with postmenopausal use of estrogen. N Engl J Med. 1980; 303: 1195-1198.
- 35. Wells G, Tugwell P, Shea B, et al. Metaanalysis of the efficacy of hormone replacement therapy in treating and preventing osteoporosis in postmenopausal women. Endocrinol Rev. 2002; 23: 529-539.
- 36. Torgerson DJ, Bell-Seyer SE. Hormone replacement therapy and prevention of nonvertebral fractures: a meta-analysis of randomized trials. JAMA. 2001; 285: 2891-2897.
- 37. Nelson HD, Humphrey LL, Nygren P, et al. Postmenopausal hormone replacement therapy. JAMA. 2002; 288: 872-881.
38. Chlebowski RT, Hendrix SL, Langer RD, et al. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women’s Health Initiative randomized trial. JAMA. 2003; 289: 3243-3253. - 39. Ross RK, Paganini-Hill A, Wan PC, Pike MC. Effect of hormone replacement therapy on breast cancer risk. J Natl Cancer Inst. 2000; 92: 328-332.
- 40. Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet. 2003; 362: 419-427.
Lecturas Recomendadas – Autor – Efecto de los Estrógenos Equinos Conjugados en las Mujeres Postmenopáusicas con Histerectomía
- 41. Li CI, Malone KE, Porter PL, et al. Relationship between long durations and different regimens of hormone therapy and risk of breast cancer. JAMA. 2003; 289: 3254-3263.
- 42. Greendale GA, Reboussin BA, Sie A, et al. Effects of estrogen and estrogen-progestin on mammographic parenchymal density. Ann Intern Med. 1999; 130: 262-269.
- 43. Hsia J, Barad D, Margolis K, et al, for the Women’s Health Initiative Research Group. Usefulness of prior hysterectomy as an independent predictor of Framingham risk score (the Women’s Health Initiative). Am J Cardiol. 2003; 92: 264-269.
- 44. Hill DA, Weiss NS, LaCroix AZ. Adherence to postmenopausal hormone therapy during the year following the initial prescription: a population-based study. Am J Obstet Gynecol. 2000; 182: 270-276.
- 45. FDANews Release. FDA updates hormone therapy information for postmenopausal women. February 10, 2004. Available at: https://www.fda.gov/bbs/topics/NEWS/2004/NEW01022l . Accessed March 5, 2004.
Autor – Efecto de los Estrógenos Equinos Conjugados en las Mujeres Postmenopáusicas con Histerectomía
* La importancia histórica y el desarrollo de la de la TRH, hacen de este artículo una información vital. Además, nos recrea con la seriedad con que es diseñado este tipo de estudios. Nota del editor.
The Women’s Health Initiative Randomized Controlled Trial, JAMA, April 14, 2004; 291 (14): 1701