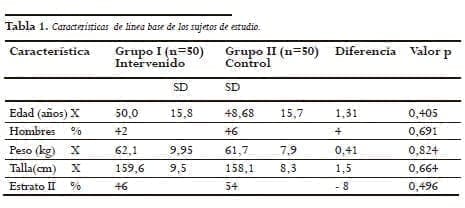
En total se incluyeron 100 sujetos, 50 para el grupo I y 50 para el grupo Il. Como se observa en la Tabla 1 no se observa ninguna diferencia demográfica entre los dos grupos. Las características de base de los dos grupos se muestran en la Tabla 1.
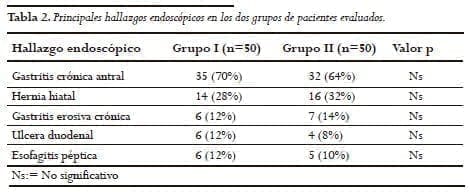
La principal indicación de la endoscopia fue enfermedad ácido péptica en 64% del grupo I vs 62% del grupo II. Veintiocho por ciento de los pacientes del grupo I, ya tenían una endoscopia frente a 32% del grupo II (p=ns) (Tabla 2).
Ante las preguntas formuladas a los 100 pacientes antes de distribuirlos en cada grupo estos contestaron:
- ¿Sabe usted como se desinfectan los equipos de endoscopia? Solo dos pacientes conocían que los equipos se reutilizaban, con previo lavado y desinfección de los mismos en líquidos especiales, es de anotar que uno de ellos era auxiliar de enfermería y el otro familiar de una enfermera.
Ante la respuesta negativa en los 98 pacientes restantes se les explicaron los delineamientos de la ASGE, en sus tres fases:
a. Limpieza mecánica,
b. Desinfección,
c. Irrigación y secado, para lo cual se utilizaron graficas didácticas
Se explicaron los tipos de desinfectantes y la seguridad de cada uno de ellos.
- ¿Le quedan dudas sobre estos métodos de desinfección? Sí: 72% de los pacientes manifestó dudas, 28% manifestó no tener dudas sobre los métodos explicados.
- ¿Sabiendo los costos, cree usted que se debería utilizar un equipo diferente para cada paciente? Veinticuatro por ciento de los pacientes manifestaron que idealmente se les debería realizar la endoscopia con un equipo nuevo.
- ¿Usted cree que siempre debería usarse un protector externo desechable para el endoscopio así solo cubra 50% del contacto con las secreciones?; 76% de los pacientes manifestó su deseo de que se usara al menos un protector externo como barrera para prevenir el contacto del equipo con las secreciones así esto fuera para el exterior únicamente.
El principal diagnóstico endoscópico en los dos grupos fue la gastritis crónica antral en 70% del grupo I vs. 64% del II, hernia hiatal (28% vs 32%) y esofagitis (12 vs 10%) respectivamente.
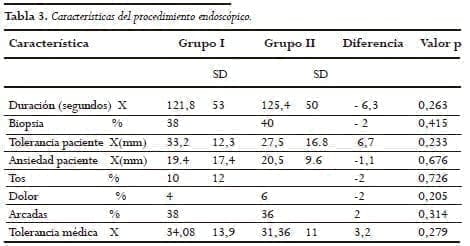
La duración del examen fue de 121,8+/-53 segundos para el grupo I y de 125,4+/-50 para el grupo II (p=0,26); 34% de los pacientes del grupo I fueron biopsiados contra 40% el grupoII (Tabla 3).
La valoración del paciente en cada uno de los grupos sobre cómo se sintió durante la endoscopia:
Se efectuó por dos parámetros; uno de forma cuantitativa a través de una escala análoga visual de 100mm donde 0 es muy mal y 100 es muy bien.
Otro de forma cualitativa de (1= no sintió, 2= se sintió bien, 3= sintió alguna molestia, 4= mucha molestia y 5= incapaz de tolerar).
Los pacientes del grupo I en promedio calificaron la escala cuantitativa en 33,2 vs 27,8 para el grupo II (p=ns) y en la escala cualitativa calificaron como 2 en 68% del grupo I vs 64% del grupo II.
La misma escala análoga sirvió para evaluar la ansiedad antes del examen en cada grupo y la tolerancia del paciente a la endoscopia valorada por el medico.
La ansiedad fue calificada como 19,4 vs. 20,5 y la tolerancia del médico; 34,08 vs. 31,46 para el grupo I y II respectivamente (Tabla 3).
Durante el procedimiento se presentaron episodios de tos en 10% del grupo I vs. 12% del grupo II, dolor en el examen en 4 vs. 6% y arcadas durante el mismo en 38% vs. 36% para el grupo I y el II respectivamente (Tabla 3).
La limpieza mecánica, incluidos los 5 minutos que de forma estándar duraron todos los endoscopios en detergente enzimático después del examen, duró 523 segundos en el grupo que usó protector vs. 595 segundos para el que no lo usó (p= 0,01).
La evaluación sugestiva del auxiliar de enfermería sobre la facilidad de la limpieza mecánica sobre una escala análoga visual de 100mm (0= muy fácil y 100= muy difícil) fue 42 para el grupo con protector y 64,08 para el grupo sin protector (p= 0,01).
Es de anotar que la fase de desinfección dura 20 minutos en los dos grupos por protocolo.
Discusión
En los últimos años se han logrado grandes avances tecnológicos sobre los endoscopios pero la limpieza y desinfección de los mismos sigue siendo un problema mayúsculo (23-25).
El reprocesamiento de los endoscopios (limpieza, desinfección y secado antes de un nuevo examen) es un proceso costoso y que consume tiempo, su efectividad puede estar comprometida no solo por errores del procedimiento sino por variaciones en la temperatura y la duración de la exposición al desinfectante o por el uso de maquinas automáticas (26,27).
El proceso puede complicarse aun mas debido a que el diseño de los endoscopios es complejo, con múltiples uniones, válvulas, canales etc (28).
Aunque los delineamientos de la ASEG:
Para limpieza y desinfección son ampliamente aceptados (en el papel) y la transmisión de infecciones por endoscopia puede ser baja (si se siguen estrictamente), los endoscopios son una fuente potencial de infección cruzada (29,30).
Un estudio microbiológico realizado por Merighi y cols (31) sobre un periodo de dos años durante los cuales evaluó 109 endoscopios, mostró que a pesar de un apropiado procesamiento de los endoscopios, se presento contaminación de los canales en 41% y de la superficie externa en 60%.
En un estudio multicéntrico aproximadamente en 24% de los endoscopios listos para usar se encontró un significante crecimiento bacteriano a nivel del canal de trabajo (32). Pero el riesgo actual de contraer una infección por endoscopia es muy difícil de valorar en la práctica clínica.
Unas referencias señalan una incidencia tan baja como 1 en 1.8 millones de endoscopias (6), pero 2030 enfermeras de unidades de endoscopia reportaron en 116 (6%) infecciones inducidas por endoscopia (33).
Una posibilidad para reducir el riesgo de contaminación:
Al paciente y el grupo de endoscopia y ganar la confianza en la comunidad debido al temor de esta a contraer infecciones graves como sida, hepatitis o enfermedad por priones es el uso de endoscopios no reutilizables (endosheath) (34,35) pero desafortunadamente estos son muy costosos aun en experimentación, estando incluso lejos del alcance de los países ricos.
Por ello el uso de este protector creado por nosotros que es sumamente económico (medio dólar) puede ser una solución (aunque parcial porque solo cubre la superficie externa del tubo de inserción) para este problema que se plantea y que seguramente cada día será mayor porque como observamos en nuestro estudio 98% de los pacientes desconoce cómo se desinfectan e incluso muchos no saben que los equipos se reutilizan.
Con bastante frecuencia en nuestra práctica observamos que los pacientes se aterran porque se les vaya a hacer la endoscopia con el mismo equipo con el que le acaban de hacer la endoscopia al paciente con el cual el estaba hablando solo hace unos minutos y que sale con marcadas náuseas o vómito.
Es por ello que en el trabajo observamos como hasta 26% de los pacientes desearía un equipo nuevo para su examen y que el costo lo asumieran las instituciones de salud, algo completamente ilógico e innecesario.
Pero al comentarles sobre si estarían de acuerdo en que además de una adecuado proceso de desinfección les colocaran un protector tipo condón en la superficie externa del endoscopio, el cual se les enseñó y se les explicaron sus ventajas y desventajas 76% estuvieron completamente de acuerdo.
En nuestro trabajo observamos que los dos grupos fueron comparables entre sí porque fueron muy uniformes:
No encontramos diferencias significativas para los grupos I (con protector) y el grupo II (sin protector) en cuanto a la edad (48,7 vs 51,3 años), sexo (42% vs. 46 % hombres), peso (62,12 vs. 61,7kg), talla (1,59 vs. 1,58m), estrato socioeconómico (II=48% vs 52% y III=34 vs 32%) ni tampoco en los hallazgos endoscópicos.
También observamos que el uso del protector no crea incomodidades en el paciente ni existieron diferencias en la tolerancia al examen en el grupo I ya que en promedio calificaron la escala cuantitativa de tolerancia en 33,2 vs 27.8 para el grupo II (p=ns) y en la escala cualitativa calificaron como buena en 68% del grupo I vs 64% del grupo II.
La misma escala análoga sirvió para evaluar la ansiedad antes del examen en cada grupo y la tolerancia del paciente a la endoscopia valorada porél medico.
La ansiedad fue calificada como 19,4 vs. 20,5 y la tolerancia del medico; 33,08 vs. 31,46 para el grupo I y II respectivamente.
Durante el procedimiento se presentaron episodios de tos en 10% del grupo I vs. 12% del grupo II, dolor en el examen en 4 vs. 6% y arcadas durante el mismo en 38% vs. 36% para el grupo I y el II respectivamente, lo que demuestra que el látex utilizado para fabricar el protector no ocasionó incomodidad al paciente.
La más importante ventaja práctica del protector fue:
El acortamiento en el tiempo de la fase mecánica de desinfección el cual fue de 523 segundos en el grupo que usó protector vs. 595 segundos para el que no lo usó (p= 0,001) y la mayor facilidad de la limpieza como valorado por el auxiliar de 42 para el grupo con protector y 64,08 para el grupo sin protector (p= 0,001) en la escala análoga visual.
Esto puede acortar el tiempo de reprocesamiento del equipo lo cual es una gran ventaja para unidades de endoscopia pequeñas que cuentan con escaso personal de enfermería para la limpieza de los equipos o unidades grandes que cuentan con un gran volumen de pacientes y pocos endoscopios, pero debe señalarse que el protector tiene aún algunas dificultades en su elasticidad y flexibilidad las cuales ocasionan leve dificultad para su colocación pero estamos seguros de que si se pudiera fabricar con una máquina para hacer condones (no disponible en nuestro país) se superarían fácilmente.
Es claro para nosotros, que ejercemos la gastroenterología diariamente:
Que en nuestro país por tener uno de los más altos indicies de prevalencia del cáncer gástrico y por su muy bajo costo, la endoscopia digestiva alta se realiza en gran número.
Por ello, en la mayoría de los centros se realiza sin sedación y en muchas ocasiones en consultorios ambulatorios, pero también es claro que debido a nuestra legislación existen muchos médicos con entrenamiento insuficiente que practican este examen a lo largo de la geografía nacional sin regulación de ningún tipo.
Si además tenemos en cuenta que en los Estados Unidos hasta 70% de las unidades de endoscopia no se ciñen a los criterios de la ASGE, es de suponer que en nuestro medio el porcentaje sea también mayor y por lo tanto que el riesgo y miedo de los pacientes a las infecciones sea mayor.
En nuestra experiencia personal hemos encontrado sitios donde únicamente se lava el equipo y se limpia con gasas, otros centros no usan detergente enzimático y lo más común, que no dejan el equipo en el desinfectante ni siquiera por espacio de 5 minutos.
Muchas veces debido a la practica desleal:
El gran número de pacientes, la no disponibilidad de varios endoscopio, etc, pero es necesario alertar que los pacientes cada vez se informan más sobre los exámenes que se van a realizar, y con el advenimiento del Internet tienen acceso a páginas que le explican muy bien cómo se debe hacer el examen.
Aunque en este estudio modelo 98% de los pacientes desconoce cómo se procesan los endoscopios es llamativo que una vez informados, 76% tenga dudas sobre la desinfección y que si el paciente se informa cómo debe desinfectar los equipos va reclamar cuando no se cumplan estas normas y podemos estar sujetos a demandas médicolegales, por ello debemos cumplir y reforzar las medidas de desinfección.
En EEUU existen personas que han alertado a los pacientes sobre la inadecuada desinfección de los equipos que hacen algunos centros.
Nuestro protector que no busca en ningún momento reemplazar los métodos de desinfección establecidos en los delineamientos, los cuales consideramos son muy seguros para prevenir cualquier tipo de infección por los endoscopios, sino busca reforzar las medidas de desinfección, al evitar el contacto externo con las secreciones, sangre, fluídos, etc y llamar la atención a la comunidad médica sobre las dudas que se pueden generar en los pacientes si los delineamientos no se siguen teniendo en cuenta el gran temor que tienen ellos con la aparición de epidemias como en sida, Hepatitis B y C, las infecciones por priones como los de las vacas locas etc.
Además, este protector, único en el mundo y creado por nosotros, puede servir para dar confianza y seguridad a nuestros pacientes.
Los cuales con bastante frecuencia y desconfianza se preguntan:
- ¿Para cada endoscopia no se usa un equipo diferente?, Lo cual es casi imposible desde el punto de vista económico, pero indirectamente al colocar un protector podríamos dar una idea similar.
- ¿Para cada endoscopia si se desinfecta bien el equipo? al colocar el protector delante del paciente de forma similar como nos colocamos los guantes y de igual forma al botar el protector junto con los guantes al terminar el examen podemos dar una mayor confianza a nuestros pacientes sobre los procedimientos de desinfección del equipo.
Conclusiones y recomendaciones
- Primero, Existe un gran desconocimiento de los pacientes sobre cómo se desinfectan los equipos de endoscopia.
- Segundo, Aparentemente, el protector endoscópico puede generar mayor confianza en el paciente sobre la seguridad de la desinfección.
- Tercero, El protector facilita la limpieza mecánica (el paso fundamental en la desinfección) al impedir el contacto de secreciones con el tubo de inserción, es decir con 50% del endoscopio.
- Cuarto, El protector no interfiere con el procedimiento endoscópico.
- Quinto, El protector no altera la tolerancia del paciente al examen.
- Sexto, Se requiere mayor tecnología para fabricar protectores más delgados y flexibles que sean más fáciles de colocar, la cual no es disponible en nuestro país.
- Séptimo, Se requieren estudios multicéntricos y con mayor número de pacientes para confirmar los resultados de este trabajo.
Nota. Los autores manifiestan no tener ningún vínculo con la fábrica Eterna S.A, la cual de manera desinteresada y sin ningún costo fabricó el protector de acuerdo con los modelos enviados por nosotros.
Agradecimientos
Queremos agradecer especialmente al señor Víctor Vargas, jefe de látex de la compañía Eterna S. A, por sus invaluables sugerencias y apoyo técnico durante la realización de este estudio.
También agradecemos la colaboración de los pacientes voluntarios que permitieron la realización del estudio y sin los cuales no hubiera podido lograrse.
Referencias
- 1. Angel L. Gutiérrez O, Rincón D. Epidemiología de la enfermedad ácido-péptica. Rev Colomb Gastroenterol 1997;3:135-144.
- 2. Parsonnet J, Harris RA. Modeling cost-effectiveness of Helicobacter pylori screening to prevent gastric cancer: a mandate for clinical trials. Lancet 1996; 348:150-154.
- 3. O’Connor HG, Axon ATR. Gastrointestinal endoscopy: infection and disinfection. Gut 1983;24:1067-1077.
4. Spach DH, Silverstein FE, Stamm WE. Transmission of infection by gastrointestinal endoscopy and bronchoscopy. Ann Intern Med 1993; 118:117-128. - 5. Allen J, Allen M, Olson M, et al. Pseudomonas infection of the biliary system resulting from use of a contaminated endoscope. Gastroenterology 1987; 92:759-763
- 6. Technology Assessment Position Paper: transmission of Infection by gastrointestinal endoscopy. American Society for Gastrointestinal Endoscopy, April 1993.
- 7. Bronowicki JP, Venard V, Botte C, et al. Patient-to-patient transmission of hepatitis C virus during colonoscopy. N Engl J Med 1997; 337:237-240.
- 8. Practice Committee of the Society of Gastroenterology Nurses and Associates. Standards for infection control and reprocessing of flexible gastrointestinal endoscopes. Gastroenterology Nursing 1997;20(suppl):1-13s.
- 9. Standards of Practice Committee of the American Society for Gastrointestinal Endoscopy. Infection control during gastrointestinal endoscopy: Guidelines for clinical application. Gastrointestinal Endoscopy 1988; 34(supplement):37-40s
- 10. Centers for Disease Control. Update: Universal Precautions for Prevention of Transmission of Human Immunodeficiency Virus, Hepatitis B Virus, and Other Bloodborne Pathogens in Health-Care Settings. Morbidity and Mortality Weekly Report 1988;37:377-382,387-388.
- 11. American Society for Gastrointestinal Endoscopy ad hoc Committee on Disinfection. Reprocessing of Flexible Gastrointestinal Endoscopes. ASGE, Manchester, MA. 1995.
Bibliografías
- 12. Standard Practice for cleaning and disinfection of flexible fiberoptic and video endoscopes use in the examination of the hollow viscera. ASTM Standard F1518-94, American Society for Testing and Materials, 1916 Race Street, Philadelphia, PA 19103.
13. Birnie G, Quigley E, Clements G, Follet E, Watkinson G. Case report: endoscopic transmission of hepatitis B virus. Gut 1983;24:171-174. - 14. Martin MA, Reichelderfer M. APIC guideline for infection prevention and control in flexible endoscopy. Am J Infect Control 1994;22:19-38.
- 15. Standards of Practice Committee of the American Society for Gastrointestinal Endoscopy. Antibiotic prophylaxis for gastrointestinal endoscopy. Gastrointestinal Endoscopy 1995;42:630-635.
- 16. Burton D, Ott BJ, Gostout CJ, DiMagno EP. Approach to designing a gastrointestinal endoscopy unit. Gastrointestinal Endoscopy Clinics of North America 1993;3:525-540.
- 17. Jain N, Larson D, Schroeder K, et al. Antibiotic prophylaxis for percutaneous endoscopic gastrostomy. Ann Intern Med 1987; 107:824-828.
- 18. Alfa MJ, Sitter KL. In-hospital evaluation of contamination of duodenoscopes: a quantitative assessment of the effect of drying. J Hosp Infect 1991; 19:89-98.
- 19. Occupational Safety and Health Administration. Occupational exposure to bloodborne pathogens: Final rule. Federal Register, 1991; 56: 64003-64182.
- 20. Decker MD. The OSHA Bloodborne Hazard Standard. Infect Control Hosp Epidemiol 1992;13:407-417.
- 21. Gostout CJ, Ott BJ, Burton D, DiMagno EP. Design of the endoscopy procedure room. Gastrointestinal Endoscopy Clinics of North America 1993;3:509-524.
- 22. Revill SI, Robinson JO, Rosen M, Hogg MIJ. The reliability of a linear analogue for evaluating pain. Anesthesia1976;31:1191-1198.
- 23. Anon. Cleaning and disinfection of equipment for gastrointestinal flexible endoscopy: interim recommendations of a working party of the British Society of Gastroenterology. Gut 1988;29:1134-1151.
Fuentes
- 24. Rutala WA, Weber DJ. FDA labeling requirements for disinfection of endoscopes: A counterpoint. Infect Control Hosp Epidemiol 1995;16: 231-235.
- 25. Rutala WA. Disinfection and sterilization of patient-care items. Infect Control Hosp Epidemiol 1996;17:377-384.
- 26. Babb JR, Bradley CR. Endoscope decontamination: where do we go from here? Journal of Hospital Infection 1995;30(supplement):543-551.
- 27. Muscarella LF. High-level disinfection or “sterilization” of endoscopes? Infect Control Hosp Epidemiol 1996;17:183-187.
- 28. Bond WW, Ott BJ, Franke KA, McCracken JE. Effective Use of Liquid Chemical Germicides on Medical Devices: Instrument Design Problems. In: Block SS, ed. Disinfection, Sterilization, and Preservation, 4th Edition. Philadelphia: Lea & Febiger; 1991.
- 29. Cole EC, Rutala WA, Nessen L, Wannamaker NS, Weber DJ. Effect of methodology, dilution, and exposure time on the tuberculocidal activity of glutaraldehyde-based disinfectants. Appl Environ Microbiol 1990;56:1813-1817.
- 30. Bond W, Favero M, Petersen N, Ebert J. Inactivation of hepatitis B virus by intermediate to high-level disinfectant chemicals. J Clinical Microbiology 1983;18:535-538.
- 31. Merighi A, Contato E. Quality improvement in gastrointestinal endoscopy: microbiologic surveillance of desinfection. Gastrointest Endosc 1996;43:457-462.
- 32. Gorse GJ, Messner RL. Infection control practices in gastrointestinal endoscopy in the Unites States. Infect Control Hosp Epidemiol 1991; 12: 289-296.
- 33. Kaczmarek RG, Moore RM. Multi-state investigation of actual disinfection and sterilization. Am J Med 1992; 92:257-261.
- 34. Silverstein FE. Design considerations of solution to endoscopic contamination: the sheathed endoscope (abstrac). Gastrointest Endosc 1992; 38:277.
- 35. Rothstein R.I. Littenberg B. Disposable sheat flexible sigmoidoscopy. Gastrointest Endosc 1995;41:566-572.