Paraganglioma del Órgano de Zuckerkandl, Discusión
Manejo Preoperatorio
Las catecolaminas liberadas por la manipulación del tumor durante la operación pueden ocasionar complicaciones serias como crisis hipertensivas, arritmias cardíacas, edema pulmonar e isquemia del miocardio (50-52). La administración de medicamentos antes de la cirugía se origina de este supuesto, y busca reducir la morbimortalidad asociada (53). Se recomienda que este manejo sea realizado en un periodo entre 10 días y 2 semanas antes de la intervención (16).
Asimismo, el paciente con un feocromocitoma o un paraganglioma puede tener disminución de volumen debido a la vasoconstricción crónica que genera la enfermedad; además, en el periodo perioperatorio puede sufrir alteraciones de su equilibrio hidroelectrolítico, por lo cual, antes de llevarlo a cirugía, se debe corregir la pérdida asociada de volemia (16,54). Sin embargo, existe controversia en la literatura sobre esta medida; por ejemplo, el grupo de la Clínica Cleveland no utiliza rutinariamente antagonistas adrenérgicos en el periodo previo a la cirugía (5), pues no hay pruebas suficientes de que esta medida reduzca las complicaciones asociadas (53).
Por otra parte, el bloqueo de los receptores adrenérgicos puede exacerbar la hipotensión posoperatoria y privar al cirujano de la hipertensión como signo de alarma, ya que puede indicarle la presencia de otro tumor oculto (12,27,53). No obstante, los investigadores del grupo de la Clínica Lahey los utilizan en casos seleccionados, principalmente en aquellos pacientes que presentan hipertensión grave, signos de considerable disminución de volumen y crisis hipertensivas no controladas, graves y frecuentes (5,26).
Si se decide utilizar el método tradicional (premedicación con antagonistas adrenérgicos), se debe iniciar con alfa-bloqueadores (53,55), como son la fenoxibenzamina, la fentolamina y la prazosina. Entre estos, la fenoxibenzamina se considera el de primera elección (5,22,27) pues, en comparación con los bloqueadores competitivos, logra un adecuado control de la presión arterial intraoperatoria al no ser desplazada en presencia de un exceso de catecolaminas. Sin embargo, se puede presentar un mayor riesgo de episodios hipotensivos durante el periodo posoperatorio (16,56).
Otras alternativas terapéuticas son los betabloqueadores, como el labetalol o las dihidropiridinas (bloqueadores de canales de calcio), utilizadas como monoterapia o en combinación con antagonistas alfa-adrenérgicos (11,57).
El manejo preoperatorio puede generar efectos de ortostatismo y taquicardia refleja debido a la vasoconstricción (53,54). Esta última puede tratarse con betabloqueadores, que no deben administrarse antes de los alfa-bloqueadores, debido a que el bloqueo beta puede inhibir la vasodilatación inducida por la epinefrina y, así, llevar a una hipertensión más significativa, con falla cardiaca y edema pulmonar (27,54).
Manejo Quirúrgico
Como lo menciona Rabii, “desde su descripción por Gagner y colaboradores (1992), la suprarrenalectomía laparoscópica se ha considerado como método de referencia para el manejo quirúrgico en enfermedad suprarrenal benigna” (58), pues ofrece ventajas en comparación con la cirugía abierta, como son: menor periodo de estancia hospitalaria, reducción de las complicaciones intraoperatorias y disminución del dolor posoperatorio (43).
Tradicionalmente, se ha pensado que el abordaje laparoscópico es una contraindicación relativa en el caso de los feocromocitomas, debido principalmente a la incertidumbre en cuanto a su carácter maligno y las posibles complicaciones hemodinámicas intraoperatorias que pueden presentarse (29,59). Sin embargo, se ha encontrado que la incidencia de complicaciones hemodinámicas durante la suprarrenalectomía, laparoscópica o abierta, son similares (18,40,43,44,60).
Para los dos casos, las principales complicaciones se deben a grandes cambios de la tensión arterial durante la manipulación de la masa, o se generan por el neumoperitoneo causado por la insuflación de dióxido de carbono (CO2) (21,53), y pueden presentarse a pesar del manejo preoperatorio con alfa-bloqueadores y betabloqueadores. También, se ha reportado hemorragia intraoperatoria por lesión vascular (56,61).
La elección ideal para el manejo quirúrgico de los feocromocitomas y los paragangliomas es controvertida actualmente, ya que los diversos estudios que se han realizado tienen limitaciones generadas por el tamaño de la muestra (59) y por el bajo reporte de casos sobre su abordaje (39). Algunos autores sugieren laparoscopia transperitoneal para los feocromocitomas bilaterales o los paragangliomas (24); sin embargo, se han reportado casos en los que un abordaje laparoscópico retroperitoneal inicial tuvo que convertirse a laparotomía, y en todos los casos los tumores fueron mayores de 5,5 cm de diámetro (57).
La recomendación de nuestro Servicio de Cirugía es que, en casos de tumores grandes (más de 6 cm), adherentes, hipervasculares, con extensión retrocava o signos de neoplasia maligna en las imágenes, se debe optar por un abordaje abierto que permita un adecuado control vascular y una resección completa (40).
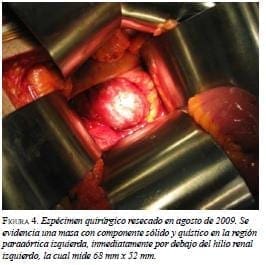
En el paciente que presentamos aquí, y de acuerdo con la información obtenida y las características anatomopatológicas encontradas, se decidió realizar un abordaje abierto (figura 4).
Anatomía Patológica
Descripción macroscópica del espécimen
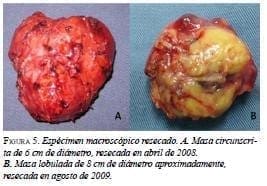
En la segunda intervención se encontró una masa lobulada con un tamaño de 7 x 6 x 5 cm, con un peso de 75 g, adyacente a la aorta abdominal, por debajo de la vena mesentérica inferior, sobre el pedículo y el polo superior renal izquierdo, y en contacto con los vasos esplénicos (figura 5). En el corte macroscópico, se observó un parénquima homogéneo de color rojizo con algunas áreas quísticas. Además, el tejido mostraba cambios por lisis a nivel central.
Citología e inmunohistoquímica
El avance de la biología molecular ha permitido un incremento en la disponibilidad de las técnicas diagnósticas para identificar la histopatología de los tumores endocrinos de forma más precisa, específicamente el inmunofenotipo y el genotipo tumoral (1,16). A pesar de esto, la tipificación, tanto del paraganglioma como del feocromocitoma respecto a su potencial maligno, es difícil (1,46), ya que el único criterio absoluto para determinar dicho potencial es la presencia de metástasis del tejido cromafín en sitios en donde no se esperaría encontrarlo (1). Por esta razón, es importante tener en cuenta que existe la posibilidad de que el tumor presente un gran crecimiento local, sin que esto se correlacione con su potencial metastásico (39).
Las metástasis de los feocromocitomas son raras y se encuentran en 5% de los casos en el momento del diagnóstico. En los paragangliomas mayores de 5 cm se encuentran hasta en el 33% (8,9,11,62). Los lugares más frecuentes de metástasis son el hueso, el pulmón, el hígado y los ganglios linfáticos (13,16).
El ejercicio diagnóstico se basa principalmente en encontrar la mayor cantidad de factores clínicos, imaginológicos, citológicos e inmunohistoquímicos para determinar el potencial maligno del tumor. Para esto se han propuesto múltiples escalas que dan una aproximación al potencial maligno. Por ejemplo, Thompson (2002) propuso el sistema de puntuación PASS (Pheochromocytoma of the Adrenal Gland Scaled Score), específico para feocromocitomas, y que se basa en un puntaje máximo de 20 características histológicas, que incluyen, entre otras, arquitectura celular, tamaño celular, invasión y actividad mitótica (49). Generalmente, los puntajes PASS mayores de 4 evidencian asociación con presencia de metástasis. No obstante, los puntajes inferiores a 4 no descartan la posibilidad de su desarrollo (49).
La inmunohistoquímica ha producido resultados muy variables respecto a la determinación del carácter maligno tumoral (1,46). La literatura reporta diferentes moléculas y péptidos expresados por los tumores, benignos y malignos, pero los datos no son constantes (16). La lista de los marcadores de inmunohistoquímica correlacionados con el potencial maligno es amplia, e incluye: la transcriptasa inversa de la telomerasa (telomerase reverse transcriptase), la proteína 90 de choque de calor, el factor de crecimiento vascular endotelial, el factor 1 de la transcripción inducible por hipoxia, la ciclooxigenasa, la cadherina N, la tenascina C y productos de escisión de la cromogranina y la secretogranina. Sin embargo, ninguno de ellos ha sido completamente validado y no se utilizan en la práctica diagnóstica (20,32,63,64). Asimismo, las pruebas moleculares, como el índice de proliferación celular Ki 67 y la proteína S100 que identifica células sustentaculares, no han mostrado resultados concluyentes en los reportes de la literatura (1,10,32).
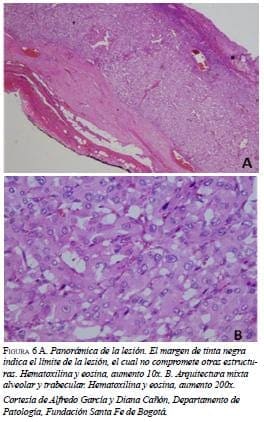
En la panorámica de la masa resecada (figura 6a) se observa el margen –en tinta negra–, indicador del límite del compromiso de la lesión que, en este caso, no presentaba invasión de otras estructuras. Además, se encuentra una arquitectura mixta entre un patrón alveolar (Zellballen) y otro trabecular, usualmente encontrada en los feocromocitomas (figura 6b).
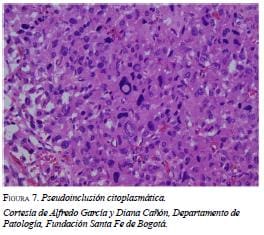
En la citología se encuentra pleomorfismo nuclear, citoplasma granular y basofílico abundante, características de las células cromafines (figura 6b). En el examen histopatológico se encuentran inclusiones globulares hialinas del citoplasma, hallazgo característico reportado por la literatura (figura 7).
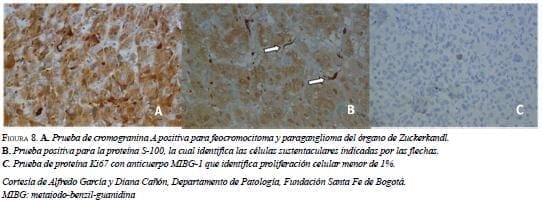
Los estudios de inmunoperoxidasa, por su parte, muestran reacción en las células tumorales para la cromogranina A (CGA): esta prueba es importante para diferenciar las neoplasias suprarrenales corticales, los feocromocitomas y los tumores metastásicos de otros tipos diferentes a los de origen neuroendocrino (figura 8a).
Focalmente y por medio de la proteína S100, se identifican células sustentaculares alrededor de los nidos de células (organización alveolar) (figura 8b). Aunque esta prueba no se realiza rutinariamente en los protocolos, es útil para la confirmación del tumor como origen de la secreción hormonal y para determinar su carácter maligno (1,8). El índice de proliferación celular Ki 67 fue menor de 1% (figura 8c).
De acuerdo con esto, los hallazgos morfológicos y de inmunofenotipo corresponden a un feocromocitoma benigno. En este caso, al tratarse de un tumor extrasuprarrenal, los hallazgos corresponden al diagnóstico hecho de paraganglioma del órgano de Zuckerkandl, probablemente benigno.
Periodo Posoperatorio
El tejido cromafín de los feocromocitomas, derivado de la cresta neural, produce secreción excesiva de catecolaminas, que tiene consecuencias a distancia (52); clásicamente, éstas se manifiestan con la tríada mencionada anteriormente. Sin embargo, se ha encontrado que también pueden asociarse con miocarditis aguda, infarto agudo del miocardio, cardiomiopatías y colapso hemodinámico (26,50).
Cuando el paciente sufre un infarto agudo del miocardio, el electrocardiograma puede mostrar elevaciones en el segmento ST, aunque comúnmente no es así (65). La mayoría de estos pacientes no tiene aterosclerosis coronaria significativa, a diferencia de lo que ocurre en la presentación clásica del infarto agudo del miocardio (53). Esto puede deberse a los altos niveles de catecolaminas liberadas por el tumor, que aumentan el metabolismo del miocardio y producen espasmo de las arterias coronarias, lo que desencadena angina, infarto y cardiomiopatía (51). Los pacientes con feocromocitomas también pueden presentar taquicardias supraventriculares y, con menor frecuencia, taquicardia ventricular, taquicardia ventricular sostenida (torsades de pointes) y fibrilación ventricular (52), así como, arritmias y falla cardiaca (51,61).
Estas respuestas hemodinámicas variables son atribuidas a la modulación cardiaca simpático-vagal, que se pueden correlacionar con las concentraciones plasmáticas de norepinefrina (13,52). Se ha demostrado que en estos pacientes se pueden alterar sus variables fisiológicas por la liberación de catecolaminas durante la resección del tumor (13). De la misma forma, los altos niveles plasmáticos de catecolaminas pueden aumentar directamente la tensión arterial durante el procedimiento (50), como sucedió con el paciente que presentamos aquí.
La aparición de cambios isquémicos en el electrocardiograma puede ser el resultado de la estimulación miocárdica por niveles elevados de catecolaminas; generalmente, es transitoria y sugiere miocarditis tóxica, más que un infarto transmural verdadero (65).
En el periodo posoperatorio, el electrocardiograma de este paciente mostró inversión de la onda T en la pared anterolateral (DI y AVL), con posterior alteración de la repolarización en V4; esto se interpretó inicialmente como un posible trastorno secundario a la sobrecarga ventricular izquierda debida a las crisis hipertensivas transitorias durante el procedimiento. Por este motivo, se decidió solicitar niveles séricos de troponina, la que resultó positiva (0,305 ng/mL). Estehallazgo se interpretó como el resultado de un evento isquémico posoperatorio: infarto agudo del miocardio sin elevación del ST de tipo 2.
Más tarde, se hizo un control de troponina, que mostró disminución respecto al valor previo (0,1 ng/mL), lo que descartó un evento coronario en curso. En el ecocardiograma transesofágico se encontró hipertrofia concéntrica leve del ventrículo izquierdo, con trastornos de la contractilidad segmentaria, y disfunción diastólica estadio I, hallazgos que pueden sugerir una cardiomiopatía inducida por catecolaminas, dependientes del feocromocitoma. La recuperación de la función cardiaca de la disfunción ventricular, que puede llegar a ser grave después de la remoción del tumor, es la evidencia indirecta de que el corazón fue expuesto a altas tensiones arteriales por un tiempo prolongado.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO