Phases of the Development of Biomarkers for Early Detection of Cancer
Resumen
Introducción. Un biomarcador se define como una alteración molecular presente en el desarrollo de la patogénesis del cáncer, que puede ser utilizada para el diagnóstico temprano de la enfermedad. La medición del biomarcador se hace por medio de diversas técnicas, como bioquímica, inmunohistoquímica o biología molecular, en diferentes tipos de muestras, como tejido, sangre periférica y orina.
El biomarcador ideal será aquel que sea válido y específico a la vez, que sea no invasivo, barato y fácilmente detectable. El uso de biomarcadores para la detección temprana del cáncer debe seguir un desarrollo ordenado y sistemático antes de introducirlos en la práctica clínica.
Métodos. Se realizó una búsqueda exhaustiva en las bases de datos de PubMed y Embase, seleccionando los artículos pertinentes para revisarlos acorde a la temática específica de interés.
Resultados. Se propone la sistematización del desarrollo de biomarcadores en cinco grandes fases, las cuales tienen la característica de ser ordenadas desde las evidencias más tempranas hasta las fases finales de su estudio.
Conclusiones. El correcto desarrollo de biomarcadores hace posible la introducción de intervenciones terapéuticas en el ámbito de la prevención secundaria del cáncer.
Palabras claves: biomarcadores de tumor; diagnóstico precoz; neoplasias pancreáticas; neoplasias del sistema biliar; prevención secundaria; intervenciones terapéuticas.
Abstract
Introduction. A biomarker can be defined as a molecular alteration present in the development of cancer pathogenesis which can be used for early diagnosis of the disease. The measurement of the biomarker can be carried out through various techniques such as biochemistry, immunohistochemistry, molecular biology, in different types of samples such as tissue, peripheral blood, and urine. The ideal biomarker will be one that is valid and specific while is non-invasive, cheap, and easily detectable. And the use of biomarkers for the early detection of cancer must follow an orderly and systematic development before introducing them into clinical practice.
Methods. An exhaustive search was performed in PubMed and Embase databases, selecting the relevant articles according to the specific topic of interest.
Results. Systematization of the development of biomarkers in five large phases is proposed, which has the characteristic of being ordered from the earliest evidence to the final phases of their study.
Conclusions. The correct development of biomarkers makes possible the introduction of therapeutic interventions in the field of secondary prevention of cancer.
Keywords: tumor biomarkers; early diagnosis; pancreatic neoplasms; biliary tract neoplasms; secondary prevention; therapeutic interventions.
Introducción – Fases del Desarrollo de Biomarcadores para la Detección Temprana del Cáncer
El rápido y creciente progreso en el campo de la biología molecular ha permitido el desarrollo de biomarcadores, los cuales se han convertido en instrumentos de gran valor para la detección temprana del cáncer 1.
Según el Grupo de Trabajo para la Definición de Biomarcadores (Biomarkers Definitions Working Group), un biomarcador se define como una alteración molecular presente en el desarrollo de la patogénesis del cáncer, que puede ser utilizada para el diagnóstico temprano de la enfermedad 2.
La medición del biomarcador se hace por medio de diversas técnicas, como bioquímica, inmunohistoquímica o biología molecular, en diferentes tipos de muestras, como tejido, sangre periférica y orina.
El biomarcador ideal será aquel que sea válido y específico a la vez, que sea no invasivo, adicionalmente sea barato y fácilmente detectable en sangre periférica o en orina.
Es necesario puntualizar que los biomarcadores no solo se utilizan para la detección temprana del cáncer sino también como:
- Indicadores predictores de riesgo para el inicio del cáncer.
- Herramienta de ayuda al diagnóstico del cáncer.
- Monitoreo y seguimiento de pacientes con cáncer.
- Ayuda para la selección de las terapias en cáncer.
- Indicadores pronósticos.
Sin embargo, el uso de los biomarcadores con estos diferentes fines está fuera del propósito de esta revisión. El uso de biomarcadores para la detección temprana del cáncer debe seguir un desarrollo ordenado y sistemático antes de introducirlos en la práctica clínica.
El objetivo de la presente revisión fue puntualizar y definir una estructura metodológica para el desarrollo de biomarcadores, desde su identificación hasta su utilidad y potencial al introducirlos en la práctica clínica.
Métodos – Fases del Desarrollo de Biomarcadores para la Detección Temprana del Cáncer
Con este objetivo en mente, se propone la sistematización del desarrollo de biomarcadores en varias fases, las cuales tienen la característica de ser ordenadas desde las evidencias más tempranas hasta las fases finales de su estudio, de forma análoga a las fases que se aplican en los experimentos clínicos para el desarrollo de nuevos fármacos 3-5.
En el presente artículo se describe la estructura y el desarrollo de los biomarcadores a profundidad y con gran detalle.
Los estudios anteriores sobre este tópico 6-8 han servido como base para el refinamiento del proceso de desarrollo de los biomarcadores, como se hace en la presente revisión.
Como ejemplo utilizaremos un biomarcador ficticio, identificado por biología molecular en sangre periférica, para la detección temprana del cáncer de páncreas.
Fases del desarrollo de un biomarcador para la detección temprana del cáncer
Estudio fase 0
Son estudios preclínicos que buscan establecer las propiedades del biomarcador nobel en términos de exactitud y precisión. La medición de un biomarcador nobel es exacta cuando representa fielmente el fenómeno de interés que intenta identificar 9.
Tomando como ejemplo el biomarcador nobel para cáncer de páncreas, suponga que se tienen 10 pacientes con cáncer de páncreas y 10 pacientes sanos. El biomarcador es exacto si es positivo en los 10 pacientes con cáncer de páncreas y negativo en los 10 pacientes sanos.
En este caso, el biomarcador nobel para la detección temprana de cáncer de páncreas discrimina 100 % entre los pacientes con carcinoma de páncreas y los pacientes sanos. Por otro lado, un biomarcador nobel es poco exacto si es positivo en dos pacientes con cáncer de páncreas y ocho pacientes sanos. (Ver también: Detección Temprana del Cáncer de Seno)
La precisión es el grado en que un biomarcador tiene casi el mismo valor cuando se mide varias veces 9.
Siguiendo con el ejemplo del biomarcador nobel para cáncer de páncreas, este sería muy preciso si se repitiera la medición varias veces y sus resultados variaran muy poco alrededor de un valor.
Un biomarcador es exacto y preciso si se realizaran varias mediciones y se encuentra que en diez ocasiones el biomarcador nobel es positivo en los 10 pacientes con cáncer de páncreas y negativo en los 10 pacientes sanos.
Por otro lado, un biomarcador nobel es poco válido pero muy preciso si se repite la medición 10 veces y es positivo en 10 diferentes mediciones en dos pacientes con cáncer de páncreas y positivo en 10 diferentes mediciones en ocho pacientes sanos.
Para ayudar a entender mejor el concepto de exactitud y precisión, se toma por analogía el ejemplo del tiro al blanco, que es la forma ilustrativa más clara para diferenciar exactitud de precisión (Figura 1).
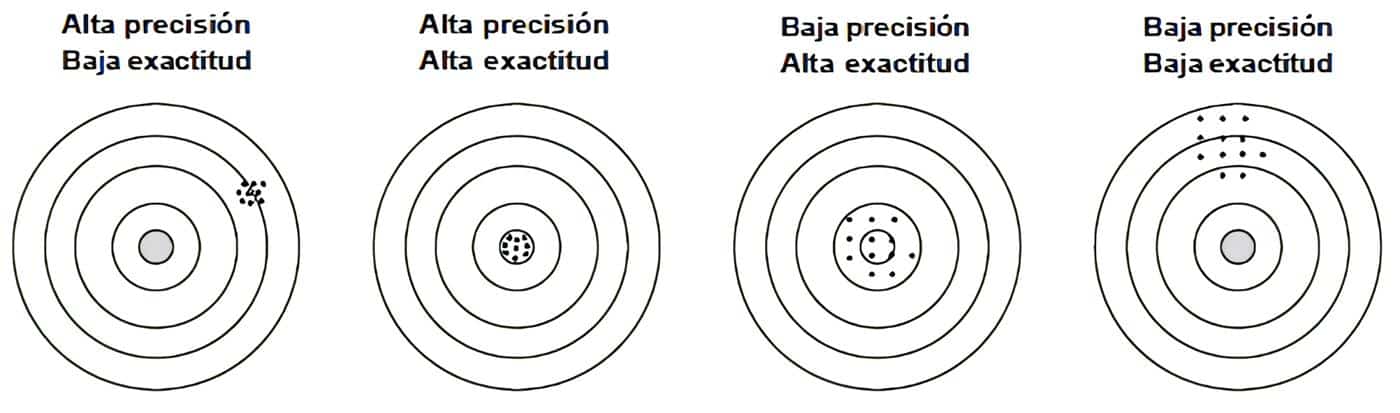
Figura 1. Diferencia entre precisión y exactitud. Fuente: Elaborada por los autores.
Suponga que se tiran varios dardos a un blanco. El objetivo principal, como es de esperar, es ser exacto y preciso, es decir, dar en el blanco la mayor cantidad de veces posible.
Cuando hay alta exactitud y precisión a la vez, los dardos darán en la diana todas las veces, siendo este el mejor escenario posible. Si solamente se tiene precisión, pero no hay exactitud, todos los dardos caerán fuera del centro y se aproximarán entre sí.
Cuando hay alta exactitud, pero baja precisión, los dardos caerán cerca del centro, pero no darán en la diana todas las veces. Cuando hay baja precisión y baja exactitud, los dardos caerán de forma dispersa fuera del centro.
Desde el punto metodológico y epidemiológico los estudios fase 0 son estudios de “casos y controles”, siendo los casos los pacientes con la enfermedad y los controles los sujetos sanos. Solo los biomarcadores que superan esta fase 0 exploratoria, es decir, biomarcadores válidos y altamente precisos, pasan a la siguiente fase.
Estudios fase IA
Los estudios fase IA tienen como objetivo establecer la distribución de los resultados del biomarcador nobel en una muestra de pacientes sanos y así poder definir el rango de valores normales de este.
En esta fase se examinan la influencia de factores tales como la edad, el sexo, el índice de masa muscular, la raza o hábitos del tabaquismo, y qué características tienen sobre los valores o resultados del biomarcador nobel.
Cuando los resultados del biomarcador nobel son expresados en una escala continua, el objetivo de los estudios fase IA consiste en determinar el tipo de distribución estadística (distribución simétrica o asimétrica). Establecer medidas de tendencia central (media, mediana, y la moda) y estipular medidas de variabilidad (rango, desviación estándar y la varianza) 10.
En el caso de distribuciones simétricas, los valores normales de referencia caen en el intervalo de la media +/- 1,96 de desviación estándar para los sujetos sanos. Mientras en las distribuciones asimétricas, los valores normales de referencia caen entre el percentil 2,5 y el percentil 97,5 de la distribución para los sujetos sanos.
Por otro lado, cuando los resultados del biomarcador nobel son expresados en forma dicotómica (positivo o negativo). El objetivo de los estudios fase IA es determinar la proporción de verdaderos positivos y la proporción de falsos positivos 10.
En este último escenario, los biomarcadores nobel son realmente útiles y prometedores cuando muestran una muy baja proporción de falsos positivos y una alta proporción de verdaderos positivos.
Desde el punto metodológico y epidemiológico, los estudios fase IA son los estudios de muestra de “serie de sujetos sanos”.
Estudios fase IB – Biomarcadores para la Detección Temprana del Cáncer
Los estudios fase IB tienen como objetivo establecer si los valores de los resultados del biomarcador nobel en sujetos con la enfermedad difieren sistemáticamente de los resultados del biomarcador en los sujetos sanos.
Desde el punto metodológico y epidemiológico, los estudios fase IB son estudios de “casos y controles”, siendo los casos los pacientes con la enfermedad y los controles los sujetos sanos.
La tabla 1 muestra los valores del biomarcador nobel en 10 pacientes con cáncer de páncreas y 10 pacientes sanos.
Tabla 1. Concentración del biomarcador nobel entre el grupo de pacientes con cáncer
de páncreas y el grupo control de sujetos sanos.

Los resultados son muy alentadores dado que se observan grandes diferencias en la mediana de concentración del biomarcador nobel entre los dos grupos de sujetos.
Por una parte, los pacientes con cáncer de páncreas muestran valores del biomarcador nobel más alto que el grupo control de sujetos sanos. Y, además, los rangos de valores no se superponen ni se traslapan.
En este punto es necesario resaltar que la comparación entre los grupos se realiza bajo condiciones ideales, por lo cual los resultados del biomarcador en esta fase no se pueden utilizar para introducirlo en la práctica clínica.
Sin embargo, si un biomarcador es negativo (no muestra las características anotadas anteriormente), se debe descartar para realizar más evaluación y de esta manera se ahorra esfuerzo y tiempo.
Estudios fase IIA – Biomarcadores para la Detección Temprana del Cáncer
Los estudios de fase IIA tienen como objetivo establecer si los valores de los resultados del biomarcador nobel en los pacientes con la enfermedad específica (cáncer de páncreas) difieren sistemáticamente de los sujetos con otro tipo de cáncer con manifestaciones clínicas parecidas a las presentadas por el cáncer de páncreas.
En esta fase se reúne un grupo de casos de sujetos con cáncer de páncreas y un grupo de control conformado por sujetos con otros tipos de cáncer, como el cáncer de vías biliares, hepatocarcinoma y cáncer de vesícula. Es importante puntualizar que en los diferentes tipos de estudios fase II ya no hay más controles de “sujetos sanos”.
La tabla 2 muestra los resultados del biomarcador nobel escogiendo un punto de corte y dando sus resultados como positivos (niveles altos del biomarcador nobel) y negativo (niveles normales).
Tabla 2. Resultados del biomarcador nobel en los sujetos con cáncer de páncreas y otro tipo de
cáncer con manifestaciones clínicas parecidos.

Los resultados del biomarcador son muy prometedores, con una sensibilidad (verdaderos positivos) del 80 % y una especificidad del 88 %, un valor predictivo positivo del 85,7 %, valor predictivo negativo del 83 % y porcentaje de falsos positivos del 11,7 %
Estudios fase IIB
Los estudios de fase IIB tienen como objetivo establecer si los casos con enfermedad avanzada tienen niveles más altos del biomarcador que los controles con enfermedad temprana.
En esta fase se reúnen un grupo de casos con cáncer de páncreas estado III y IV y un grupo control con cáncer de páncreas estado I y II. Se mide en ambos grupos los niveles del biomarcador nobel y se investiga si estos niveles difieren según las diferentes etapas de la enfermedad.
Desde el punto metodológico y epidemiológico los estudios fase IIB son estudios de “casos y controles”, siendo los casos los pacientes con cáncer avanzado y los controles los pacientes con cáncer de páncreas temprano.
La tabla 3 muestra los resultados del biomarcador nobel dicotomizando los resultados del biomarcador. Definiendo los resultados como positivos (niveles mayores a 393) con cáncer de páncreas avanzado y negativo (niveles menores a 393) con cáncer de páncreas temprano.
Tabla 3. Resultados del biomarcador nobel en los sujetos con cáncer de páncreas avanzado y
los sujetos con cáncer de páncreas temprano.

En este ejemplo los resultados del biomarcador son alentadores, con una sensibilidad (verdaderos positivos) del 94,1 % y una especificidad del 89,4 %, valor predictivo positivo del 88,8 %, valor predictivo negativo del 94,4 % y porcentaje de falsos positivos del 10,5 %. Podemos concluir que el biomarcador nobel es muy prometedor para el diagnóstico de cáncer de páncreas y útil para establecer la gravedad de esta enfermedad, es decir, es útil para detectar la enfermedad en estados tempranos.
Estudios fase IIC
Los estudios fase IIC tienen como objetivo establecer si los valores del biomarcador nobel en los sujetos con cáncer de páncreas difieren de aquellos sujetos con cáncer de páncreas más una enfermedad concurrente.
Desde el punto metodológico y epidemiológico, los estudios fase IIC son estudios de “casos y controles”, siendo los casos los pacientes con cáncer de páncreas y enfermedad concurrente mientras que los controles son los pacientes con solo cáncer de páncreas.
La tabla 4 muestra los resultados del biomarcador nobel, dicotomizando los resultados del biomarcador, definiendo los resultados como positivos (niveles mayores a 393) con cáncer de páncreas y una enfermedad concurrente y negativo (niveles menores a 393) con cáncer de páncreas solamente.
Tabla 4. Resultados del biomarcador nobel en los sujetos con cáncer de páncreas avanzado
y los sujetos con cáncer de páncreas y una enfermedad concurrente.

Nuevamente, en este caso los resultados del biomarcador son alentadores, con una sensibilidad (verdaderos positivos) del 94,7 % y una especificidad del 89,4 %, valor predictivo positivo del 90 %, valor predictivo negativo del 94,4 % y porcentaje de falsos positivos del 10,5 %. La conclusión en este escenario es que los valores del biomarcador novel no se ven afectados por las enfermedades concurrentes en pacientes con cáncer de páncreas.
Estudios fase IID
Los estudios fase IID tienen como objetivo establecer si el biomarcador nobel es capaz de detectar la enfermedad específica (cáncer de páncreas) entre pacientes con sospecha clínica de la enfermedad.
En este escenario, desde el punto metodológico y epidemiológico, los estudios fase IID son estudios de “corte transversal”.
En este diseño metodológico los pacientes con manifestaciones clínicas que hacen sospechar un cáncer de páncreas son enrolados consecutivamente, realizándoles la medición del biomarcador nobel y la prueba de oro para el diagnóstico de cáncer de páncreas de forma simultánea.
Y en este tipo de estudio el investigador no sabe de antemano qué sujetos tienen o no tienen cáncer de páncreas, como en los estudios de casos y controles.
Una característica de este tipo de estudio es que generalmente son multicentricos y los sujetos son referidos desde hospitales generales a centros grandes de atención especializada en patología pancreática y hepatobiliar.
La tabla 5 muestra los resultados del biomarcador nobel y la prueba de oro diagnóstica en los sujetos en quienes clínicamente es razonable que tengan cáncer de páncreas.
Tabla 5. Resultados del biomarcador nobel y la prueba de oro diagnóstica en los sujetos
en quienes clínicamente es razonable que tengan cáncer de páncreas.

En este nuevo tenor se obtiene una sensibilidad (verdaderos positivos) del 86,2 % y una especificidad del 59,6 %, valor predictivo positivo del 52 %, valor predictivo negativo del 89,4 % y porcentaje de falsos positivos del 40,3 %.
Acorde a los resultados anteriormente ilustrados, cuando el biomarcador es negativo se tiene una alta probabilidad de excluir la enfermedad específica bajo estudio.
Por el contrario, cuando el biomarcador nobel es positivo, debido al alto porcentaje de falsos positivos, se deben llevar a cabo otros estudio complementarios, los cuales son por lo general más invasivos.
Estos resultados son explicados por la baja prevalencia de la enfermedad específica bajo estudio en la muestra reclutada 11. Obsérvese que la prevalencia del cáncer de páncreas es del 33 % (29 casos de cáncer de páncreas entre 86 sujetos).
Es decir, casi el 70 % de los sujetos no tienen cáncer de páncreas. Debido a esto es importante realizar estudios fase IID, con una mayor cantidad de sujetos, con el fin de aumentar la prevalencia de la patología bajo estudio (cáncer de páncreas).
La tabla 6 muestra los resultados de un estudio fase IID con mayor número de sujetos en quienes en razonable sospechar clínicamente cáncer de páncreas. El total de pacientes estudiados esta vez es de 125 sujetos, con una prevalencia de la enfermedad del 46,4 %.
Tabla 6. Resultados del biomarcador nobel y la prueba de oro diagnóstica en los sujetos en
quienes clínicamente es razonable que tengan cáncer de páncreas.

En este contexto se obtiene una sensibilidad (verdaderos positivos) del 95,8 % y una especificidad del 80,5 %, valor predictivo positivo del 80,8 %, valor predictivo negativo del 94,7 % y porcentaje de falsos positivos del 19 %. Estos nuevos resultados del estudio fase IID del biomarcador nobel son bastante alentadores y convalidan la utilidad del biomarcador nobel en el diagnóstico temprano para el cáncer de páncreas.
Un estudio fase IID bien diseñado debe evitar varios errores metodológicos, los cuales amenazan su validez, como son: sesgo de espectro, sesgo de verificación y sesgo de ocultamiento 11.
Estudios fase III – Biomarcadores para la Detección Temprana del Cáncer
Los estudios fase III son “experimentos clínicos aleatorizados controlados” doble ciego, los cuales tienen como objetivo establecer si el biomarcador nobel es tan útil que es capaz de impactar resultados clínicamente relevantes en salud, como la mortalidad.
En esta fase, el experimento clínico compara dos grupos de sujetos conformados de manera aleatoria: un grupo de sujetos en quienes se introduce la nueva estrategia usando el biomarcador nobel versus el otro grupo quienes se someten a la estrategia diagnóstica estándar.
El fin último que persigue un biomarcador es el de establecer un periodo de tiempo preclínico en la historia natural de la enfermedad, que haga posible el diagnóstico precoz de la entidad nosológica bajo estudio, para así instaurar un tratamiento temprano que reduzca de forma significativa la mortalidad.
Si los resultados del biomarcador nobel son positivos estos podrán introducirse a la práctica clínica habitual.
Estudios fase IV – Biomarcadores para la Detección Temprana del Cáncer
Los estudios fase IV comprenden grandes cohortes de sujetos consecutivos evaluados mediante el biomarcador nobel. Estudios fase IV son llevados a cabo después de que el biomarcador nobel es introducido en la práctica clínica.
Los estudios fase IV juegan un papel importante en la reevaluación de la exactitud del biomarcador nobel, dado que los resultados del biomarcador nobel no son infalibles.
Y en estos casos, los estudios fase IV verifican y determinan si algunos sujetos etiquetados como verdaderos positivos son realmente falsos positivos y si algunos pacientes etiquetados como verdaderos negativos son falsos negativos.
Esto es particularmente importante si el estándar de oro utilizado en la fase III no es del todo perfecto.
Discusión – Fases del Desarrollo de Biomarcadores para la Detección Temprana del Cáncer
El propósito de esta revisión fue la de presentar una guía formal y metódica para el desarrollo de biomarcadores para la detección temprana del cáncer. Estas fases están ordenadas de manera lineal acorde al objetivo que cada estudio está designado a resolver.
Los estudios de fase temprana sirven como instrumentos de tamizaje para que solo los biomarcadores más prometedores completen la totalidad del proceso.
Los últimos estudios sirven como demostración de su utilidad en la práctica clínica. Sin embargo, en determinadas circunstancias los biomarcadores son tan promisorios que pueden saltar una fase del desarrollo de evaluación.
El proceso para el desarrollo de biomarcadores para la detección temprana del cáncer no busca ser una estructura rígida como una camisa de fuerza.
El correcto desarrollo de biomarcadores hace posible la introducción de intervenciones terapéuticas en el ámbito de la prevención secundaria del cáncer.
Hay un tipo especial de estudios que tienen como objetivo establecer si los pacientes con cáncer sometidos a un procedimiento terapéutico y que presentaron complicaciones derivadas de la intervención tienen valores más altos de biomarcadores inflamatorios que los sujetos sometidos al mismo procedimiento que no presentaron la complicación.
A este respecto, hay que advertir que este tipo de estudios con marcadores inflamatorios no hacen parte del proceso y desarrollo de los marcadores nobel en el diagnóstico temprano del cáncer 12.
En los procesos de validación, habitualmente los biomarcadores no invasivos parten su estudio en una cohorte de descubrimiento (discovery cohort), y luego, si los hallazgos son positivos, se realiza una validación prospectiva (prospective validation cohort).
Los biomarcadores pueden ser utilizados en otros contextos clínicos y son de enorme importancia como predictores de desarrollo de cáncer. Por ejemplo, en cáncer de mama es muy notable destacar el uso del biomarcador genético BRCA1 y BRCA2,. Los cuales si están presentes en las mujeres portadoras sanas, predicen entre un 60 % y un 80 % el desarrollo ulterior del cáncer de mama hereditario.
También los biomarcadores son muy útiles como medio de monitorizar los procesos de recurrencia de pacientes tratados por cáncer.
Como la medición de tiroglobulina para detectar tempranamente la recurrencia del cáncer de tiroides y la medición del antígeno carcinoembrionario para detectar tempranamente la recurrencia del cáncer de colon.
Hoy el auge de los biomarcadores está en amplia expansión y desarrollo en todos los terrenos de investigación. Actualmente se pueden clasificar varios tipos de biomarcadores, separando invasivos (en biopsias) vs no invasivos (saliva, orina, aire espirado, sangre o deposiciones). A su vez, los biomarcadores pueden ser convencionales (por ejemplo, ELISA en sangre) o no tradicionales (como micro ARN en biopsia líquida).
Cumplimiento de normas éticas – Fases del Desarrollo de Biomarcadores para la Detección Temprana del Cáncer
Consentimiento informado: El presente estudio es una revisión de la literatura y, como tal, no requiere de un consentimiento informado ni de aprobación del Comité de Ética Institucional.
Conflictos de interés: Ninguno declarado por los autores.
Fuentes de financiación: Los recursos de financiación del proyecto provienen en su totalidad de aportes de los autores.
Contribución de los autores
– Concepción del estudio: Eduardo de Jesús Torregroza- Diazgranados, Juan Pablo Torregroza-Castilla.
– Búsqueda y recuperación de los artículos: Eduardo de Jesús Torregroza-Diazgranados, Juan Pablo Torregroza- Castilla.
– Redacción del manuscrito: Eduardo de Jesús Torregroza-Diazgranados, Juan Pablo Torregroza- Castilla.
– Revisión crítica y aprobación: Eduardo de Jesús Torregroza-Diazgranados, Juan Pablo Torregroza- Castilla.
Referencias – Fases del Desarrollo de Biomarcadores para la Detección Temprana del Cáncer
1. Henson DE, Srivastava S, Kramer BS. Molecular and genetic targets in early detection. Curr Opin Oncol. 1999;11:419-25. https://doi.org/10.1097/00001622-199909000-00018
2. Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: Preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69:89-95. https://doi.org/10.1067/mcp.2001.113989
3. Khleif SN, Doroshow JH, Hait WN; AACR-FDA-NCI Cancer Biomarkers Collaborative. AACR-FDA-NCI Cancer Biomarkers Collaborative consensus report: advancing the use of biomarkers in cancer drug development. Clin Cancer Res. 2010;16:3299-318. https://doi.org/10.1158/1078-0432.CCR-10-0880
4. Andre F, McShanne LM, Michiels S, Ransohoff DF, Altman DG, Reis-Filho JS, et al. Biomarker studies: a call for a comprehensive biomarker study registry. Nat Rev Clin Oncol. 2011;8:171-6. https://doi.org/10.1038/nrclinonc.2011.4
5. International Conference on Harmonisation E9 Expert Working Group. ICH Harmonised Tripartite Guideline. Statistical principles for clinical trials. Stat Med. 1999;18:1905-42.
6. Sackett DL, Haynes RB. The architecture of diagnostic research. BMJ. 2002;324:539-41. https://doi.org/10.1136/bmj.324.7336.539
7. Gluud C, Gluud LL. Evidence based diagnostics. BMJ. 2005;330:724-6. https://doi.org/10.1136/bmj.330.7493.724
8. Pepe MS, Etzioni R, Feng Z, Potter JD, Thompson ML, Thornquist M, et al. Phases of biomarker development for early detection of cancer. J Natl Cancer Inst. 2001;93:1054-61. https://doi.org/10.1093/jnci/93.14.1054
9. Burns JE, Campion PJ, Williams A. Error and uncertainty. Metrologia. 1973;9:101-2. https://doi.org/10.1088/0026-1394/9/2/006
10. Dawson-Saunders B, Trapp RG. Bioestadística médica. Segunda edición. México: Manual moderno; 1999. p. 49-55.
11. Torregroza-Diazgranados E de J. Pruebas diagnósticas: Fundamentos de los estudios diagnósticos, evaluación de la validez e interpretación clínica de sus resultados. Rev Colomb Cir. 2021;36:193-204. https://doi.org/10.30944/20117582.716
12. Pinares-Carrillo HD, Ortega-Checa D, Vergel-Ramírez K, Chilca-Alva ML, Núñez-Vergara M. Proteína C reactiva como biomarcador predictivo de fuga anastomótica en cirugía oncológica colorrectal: estudio de cohorte retrospectivo. Rev Colomb Cir. 2023;38:289-99. https://doi.org/10.30944/20117582.2269
Autores – Fases del Desarrollo de Biomarcadores para la Detección Temprana del Cáncer
1 Eduardo de Jesús Torregroza-Diazgranados, Médico, especialista en Cirugía general y Cirugía de Mama y Tejidos blandos, Clínica de Cirugía de mama, Bogotá, D.C., Colombia.
2 Juan Pablo Torregroza-Castilla, Estudiante de Medicina, Universidad del Rosario, Bogotá, D.C., Colombia.
Fecha de recibido: 30/03/2023 – Fecha de aceptación: 17/05/2023 – Publicación en línea: 27/06/2023
Correspondencia: Eduardo de Jesús Torregroza-Diazgranados, Calle 111 # 13-03, Bogotá, D.C., Colombia. Teléfono: 3175730414.
Dirección electrónica: torregrozad@gmail.com
Citar como: Torregroza-Diazgranados EJ, Torregroza-Castilla JP. Fases del desarrollo de biomarcadores para la detección temprana del cáncer. Rev Colomb Cir. 2023;38:724-31. https://doi.org/10.30944/20117582.2374
Este es un artículo de acceso abierto bajo una Licencia Creative Commons – BY-NC-ND https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es