El concepto de bipartición de tránsito intestinal ha evolucionado a partir de la necesidad de estimular la secreción de incretinas por parte del intestino distal, sin resecar ni excluir segmentos de intestino delgado, como ocurre en las enteroomentectomías adaptativas descritas por Santoro, la derivación gástrica en Y de Roux por laparoscopia, la derivación biliopancreática, la duodeno-yeyunostomía, la duodeno-ileostomía con una anastomosis, etc 59-60.
Actualmente, la bipartición del tránsito intestinal puede ser alta o baja. La alta está representada por una gastro-ileostomía látero-terminal a 180-250 cm proximales a la válvula ileocecal, con entero-entero anastomosis término-lateral a 80 cm proximales a la válvula en conformación de Y 61, en conformación de omega 62 o mediante una duodeno-ileostomía látero-lateral 63.
La bipartición del tránsito intestinal baja se logra mediante una anastomosis yeyuno-ileal, látero-lateral, en un sitio calculado de acuerdo con la longitud intestinal total del paciente, considerando 1/3 de yeyuno y 2/3 de íleon, cuya suma no debe ser menor de 2,5 m ni de 33 % de la longitud intestinal total 64,65.
Lo anterior se debe a que se ha estimado que una longitud de menos de 200 cm de intestino funcional puede resultar en un síndrome de intestino corto, al igual que un segmento menor de 35 cm de yeyuno (con anastomosis yeyuno-ileal), menos de 60 cm con anastomosis yeyuno-cólica y menor de 150 cm con yeyunostomía terminal 66.
Síndrome de Intestino Corto
En otras palabras, un paciente con un yeyunoíleon de 7 metros podría tener la anastomosis a 100 cm del ángulo de Treitz y a 200 cm de la válvula ileocecal; de esta manera, aun con un paso exclusivamente transanastomótico, la longitud mínima de tránsito sería de 300 cm, lo que constituye el 42,8 % de la longitud total del intestino, lo cual evita la posibilidad del síndrome de intestino corto 67-69.
En el modelo en ratones, se ha establecido que la distancia más apropiada para la derivación es entre 50 a 60% de la longitud total del yeyuno-ileon, ya que, si es menor, no existirán los efectos en la regulación de la glucosa y, si es mayor, aparecerán con mayor frecuencia efectos adversos como la diarrea 70.
Con el fin de favorecer un tránsito similar a través de la anastomosis, la longitud de esta debería ser similar al diámetro de las asas intestinales. Lo anterior, con el fin de evitar las complicaciones que se evidenciaron con la derivación yeyuno- ileal descrita por Stockeld, en 1991 71,72. En esa cirugía se hacía una anastomosis látero-lateralde 9 cm, a 20 cm del ángulo de Treitz, con el asa ileal localizada a 25 cm de la válvula ileocecal.
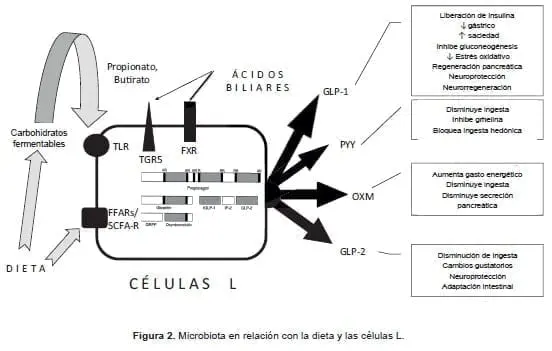
Al hacer una anastomosis de, por lo menos, dos veces el diámetro del asa aferente, la presión transanastomótica favorecería un paso preferencial, logrando disminuir en forma importante el flujo por el resto del intestino con la sobrepoblación bacteriana asociada, además de malnutrición y hepatopatía, como lo reportó en su momento Stockeld (figura 2) 73-75.
 Derivación Intestinal
Derivación Intestinal
La bipartición del tránsito intestinal es una modificación de la derivación intestinal reversible e hipofuncionante de Lazzarotto e Souza (BIRHLS). Después de calcular la superficie de absorción intestinal, utilizando fórmulas no validadas, Lazzarotto e Souza sometió a 1.200 pacientes a una anastomosis yeyuno-ileal látero-lateral, considerando no dejar menos de 90 cm de íleon terminal para evitar complicaciones nutricionales.
En su serie, reportó una pérdida ponderal de 42,7 % y complicaciones como diarrea, náuseas en 9 %, anemia en 0,6 %, hipoalbuminemia en 0,83 % y una extraordinariamente baja tasa de revisión para un procedimiento que se utilizó con fines bariátricos (0,24 %) 76.
No fue sino hasta 10 años después de la publicación del trabajo de Lazzarotto e Souza, que los angloparlantes han vuelto a considerar este tipo de cirugía. Duan, et al., demostraron que la bipartición del tránsito intestinal mediante una anastomosis látero-lateral, produce mejoría en la homeostasis de la glucosa y en la sensibilidada la insulina, así como aumento considerable en las concentraciones de GLP-1 y ácidos biliares totales, al compararla con el modelo de derivación intestinal y yeyunectomía 77.
Estimulación del intestino distal
La yeyunectomía es el componente principal en las entero-omentectomías adaptativas propuestas por Sergio Santoro, procedimientos considerados como readaptaciones intestinales a las condiciones ambientales, que favorecen una mayor secreción de enterohormonas por parte del íleon terminal, como fuera publicado en humanos en 2008 y retomado en el modelo en ratones años después con el fin de reforzar la teoría de la estimulación del intestino distal 78-79.
La GLP-2 se secreta en relación equimolar con la incretina GLP-1, e inhibe el hambre a nivel del núcleo arcuato hipotalámico, además de reducir la producción hepática de glucosa y aumentar la sensibilidad a la insulina 80.
Una potencial desventaja con la yeyunectomía física, es que se sabe que la GLP-2 es una de las enterohormonas asociadas con los procesos readaptativos intestinales y que la readaptación entérica a la resección del intestino delgado está en relación con la magnitud de la resección 81, por lo que una anastomosis látero-lateral podría implicar menos readaptación en comparación con la yeyunectomía, si existieran mecanismos paracrinos que regularan la actividad de la GLP-2.
La bipartición del tránsito intestinal puede hacerse mediante cirugía convencional, laparoscópica o, inclusive, mediante procedimientos totalmente endoscópicos asistidos por magnetos.
La derivación yeyunal parcial o bipartición de tránsito intestinal yeyuno-ileal asistida con magnetos, mantiene los principios fisiológicos de la bipartición del tránsito intestinal, y se logra sin la necesidad de cirugía 82. Sin embargo, entre sus desventajas hay dos principales. La primera es la imposibilidad de cerrar la brecha mesentérica, lo que expone a los pacientes al riesgo de complicaciones por hernia interna.
Lea También: Adenocarcinoma de Yeyuno, Infrecuente Cáncer Gastrointestinal
Síndrome de sobrepoblación bacteriana
La segunda radica en la diferencia con los procedimientos abiertos y los laparoscópicos, en los cuales el sitio de la anastomosis se determina tomando en cuenta la longitud intestinal total, mientras que, en el procedimiento endoscópico, se desconoce dicha longitud y, además, se limita según las características del endoscopio utilizado, con el consecuente riesgo de desarrollar síndrome de sobrepoblación bacteriana, diarrea, malabsorción y otros.
Durante el primer estudio realizado con este sistema endoscópico, se utilizó asistencia laparoscópica para identificar el sitio de la anastomosis a 50-100 cm del ángulo de Treitz y a 50-100 cm de la válvula ileocecal.
Los pacientes pudieron reanudar sus actividades diarias al segundo día, en promedio. Al cabo de 12 meses, habían presentado una pérdida de 40 % del peso excedente (14,6 % del peso total), así como una disminución de 1,8 % de HbA1c (7,8 + 2,4% a 5,9 + 0,5 %).
Entre los efectos adversos en la primera serie de pacientes intervenidos con imanes, se presentaron dolor abdominal (90 %), diarrea leve (50 %) y moderada (50 %), deficiencia de vitamina B (40 %), y deficiencia de vitamina D (20 %) y de hierro en (40 %).
Sin embargo, la diarrea fue resuelta mediante cambios en la composición de la dieta, limitando la ingestión de carbohidratos, con loperamida o con ambas cosas 83. Actualmente, se está llevando a cabo el primer estudio aleatorizado para verificar la utilidad del procedimiento (NTC03130244).
Bipartición del tránsito intestinal
La experiencia previa con la bipartición del tránsito intestinal quirúrgica sugiere una reducción en los niveles de HbA1c de más del 2 % en 53,3 % de los pacientes, mientras que el 73,3 % presentarán una disminución mayor de 1,5 % y pérdida ponderal de 12 %, aproximadamente.
Los parámetros funcionales de las células beta mejoran, así como las concentraciones de la GLP-1. Las tasas de remisión completa de diabetes mellitus de tipo 2 se han reportado en 57 a 59%.
Sistema de la proopiomelanocortina
Al modificar la cinética de las incretinas, la GLP-1 y la GLP-2 contribuyen a la pérdida ponderal mediante su actividad en el vaciamiento gástrico, así como en la activación del sistema de la proopiomelanocortina. La bipartición del tránsito intestinal puede favorecer una pérdida mayor de 10 % del peso inicial en 66,7 % de los pacientes.
Los efectos metabólicos incluyen mejoría en el perfil de riesgo cardiovascular, disminución de la hipertensión arterial sistémica y mejoría en los parámetros de función renal; sin embargo, también se ha documentado disminución de los niveles de vitamina B12.
Los efectos adversos más frecuentemente reportados fueron diarrea (46,7%), flatulencia (26,7%) y dolor (33,3%).
La bipartición del tránsito intestinal no favorece asas ciegas. Sin embargo, de acuerdo con la longitud intestinal en continuidad, pueden existir deficiencias de micronutrientes y macronutrientes, como hierro, cinc, vitamina B o vitamina D, así como de calcio y albúmina. Otro riesgo es la disbiosis, con la generación de diarrea y meteorismo con flatulencia 84.
En cuanto a la seguridad del procedimiento, es claramente superior a otras intervenciones bariátricas que presentan tasas de complicación de hasta 10,5 % y mortalidad menor de 0,5 %; además, es fácilmente reversible.
La remisión de la diabetes mellitus de tipo 2 lograda por procedimientos quirúrgicos, depende de complejas interacciones entre el microbiota, los ácidos biliares y el epitelio intestinal, más que de procesos malabsortivos o restrictivos.
La bipartición de tránsito intestinal es una opción quirúrgica basada en los principios fisiológicos responsables en la remisión de diabetes, y es la más sencilla y segura para el manejo de la diabetes mellitus 84.
Conflicto de interés. Ninguno
Referencias
- Alegre -Díaz J, Herrington W, López-Cervantes M, Gnatiuc L, Ramirez R, Hill M, et al. Diabetes and causespecific mortality in Mexico City. New England J Med. 2016;375:1961–71. doi:10.1056/nejmoa1605368.
- Yu J, Zhou X, Li L, Li S, Tan J, Li Y, et al. The long-term effects of bariatric surgery for type 2 diabetes: systematic review and meta-analysis of randomized and non-randomized evidence. Obes Surg. 2014;25:143–58.doi:10.1007/s11695-014-1460-2.
- Müller-Stich BP, Senft JD, Warschkow R, Kenngott HG, Billeter AT, Vit G, et al. Surgical versus medical treatment of type 2 diabetes mellitus in nonseverely obese patients. Ann Surg. 2015;261:421–9. doi:10.1097/sla.0000000000001014.
- Rao W-S, Shan C-X, Zhang W, Jiang D-Z, Qiu M. A meta-analysis of short-term outcomes of patients with type 2 diabetes mellitus and BMI ≤35 kg/m2 undergoing Roux-en-Y gastric bypass. World J Surg. 2014;39:223–30. doi:10.1007/s00268-014-2751-4.
- Rubino F, Nathan DM, Eckel RH, Schauer PR, Alberti KGMM, Zimmet PZ, et al. Metabolic surgery in the treatment algorithm for type 2 diabetes: a joint statement by International Diabetes Organizations. Diab Care. 2016;39:861–77. doi:10.2337/dc16-0236.
- Baskota A, Li S, Dhakal N, Liu G, Tian H. Bariatric surgery for type 2 diabetes mellitus in patients with BMI <30 kg/m2: a systematic review and meta-analysis. PLoS One. 2015;10:e0132335. doi:10.1371/journal.pone.0132335.
- Tratamiento quirúrgico de la diabetes mellitus tipo 2 en adultos con IMC de 30 a 34.9 kg/m2. Guía de Referencia Rápida. Ciudad de México: CENETEC; 2016. Fecha de consulta: 7 de mayo de 2018. Disponible en : http://cenetec-difusion.com/CMGPC/SS-353-16/RR.pdf.
- Ramírez-Velásquez JE. Cirugía metabólica. En: Manual práctico del manejo de la diabetes mellitus y sus comorbilidades. 2016. Editorial Alfil SA de CV. pp 614.
- Aminian A, Brethauer SA, Andalib A, Punchai S, Mackey J, Rodriguez J, et al. Can sleeve gastrectomy “cure” diabetes? long-term metabolic effects of sleeve gastrectomy in patients with type 2 diabetes. Ann Surg. 2016;264:674–81. doi:10.1097/sla.0000000000001857.
- Abbasi J. Unveiling the “Magic” of diabetes remission after weight loss surgery. JAMA. 2017;317:571-4.
- Espinosa O, Pineda O, Maydón HG, Sepúlveda EM, Guilbert L, Amado M, et al. Type 2 diabetes mellitus outcomes after laparoscopic gastric bypass in patients with BMI <35 kg/m2 using strict remission criteria: early outcomes of a prospective study among Mexicans. Surg Endosc. 2017;32:1353–9. doi:10.1007/s00464-017- 5815-3.
- Lee CJ, Wood GC, Lazo M, Brown TT, Clark JM, Still C, et al. Risk of post-gastric bypass surgery hypoglycemia in nondiabetic individuals: A single center experience. Obesity. 2016;24:1342–8. doi:10.1002/oby.21479.
- Hamdan K, Somers S, Chand M. Management of late postoperative complications of bariatric surgery. British J Surg. 2011;98:1345–55. doi:10.1002/bjs.7568.
- Koliaki C, Liatis S, le Roux CW, Kokkinos A. The role of bariatric surgery to treat diabetes: current challenges and perspectives. BMC Endocrine Disorders 2017;17:50. doi:10.1186/s12902-017-0202-6.
- Fried M, Dolezalova K, Chambers AP, Fegelman EJ, Scamuffa R, Schwiers ML, et al. A novel approach to glycemic control in type 2 diabetes mellitus, partial jejunal diversion: pre-clinical to clinical pathway. BMJ Open Diab Res Care 2017;5:e000431. doi:10.1136/bmjdrc- 2017-000431.
- Stentz FB, Brewer A, Wan J, Garber C, Daniels B, Sands C, et al. Remission of pre-diabetes to normal glucose tolerance in obese adults with high protein versus high carbohydrate diet: randomized control trial. BMJ Open Diab Res Care. 2016;4:e000258. doi:10.1136/bmjdrc- 2016-000258.
- Guyton K, Alverdy JC. The gut microbiota and gastrointestinal surgery. Nat Rew Gastroenterol Hepatol. 2016;14:43–54. doi:10.1038/nrgastro.2016.139.
- Yamane S, Hamamoto Y, Harashima S, Harada N, Hamasaki A, Toyoda K, et al. GLP-1 receptor agonist attenuates endoplasmic reticulum stress-mediated β-cell damage in Akita mice. J Diab Investig 2010;2:104–10. doi:10.1111/j.2040-1124.2010.00075.x.
- Stentz FB, Brewer A, Wan J, Garber C, Daniels B, Sands C, Sandz C, et al. Remission of pre-diabetes to normal glucose tolerance in obese adults with high protein versus high carbohydrate diet: randomized control trial. BMJ Open Diab Res Care 2016;4:e000258. doi:10.1136/ bmjdrc-2016-000258.
- Mao J, Hu X, Xiao Y, Yang C, Ding Y, Hou N, et al. Overnutrition Stimulates Intestinal Epithelium Proliferation Through -Catenin Signaling in Obese Mice. Diabetes. 2013;62:3736–46. doi:10.2337/db13-0035.
- Manning S, Pucci A, Batterham RL. GLP-1: A Mediator of the Beneficial Metabolic Effects of Bariatric Surgery? Physiology. 2015;30:50–62. doi:10.1152/physiol. 00027.2014.
- Federico A, Dallio M, Tolone S, Gravina Ag, Patrone V, Romano M, et al. Gastrointestinal hormones, intestinal microbiota and metabolic homeostasis in obese patients: effects of bariatric surgery. In Vivo. 2016;30:321- 30.
- Gondolesi G, Ramisch D, Padin J, Almau H, Sandi M, Schelotto Pb. What is the normal small bowel length in humans? First donor-based cohort analysis. Am J Transplant. 2012;12(Suppl 4):S49-54. doi: 10.1111/j.1600- 6143.2012.0448.
- Minko E, Pagano A, Caceres N, Adar T, Marquez S. Human intestinal tract length and relationship with body height. Federation Am Societie Experimiental Biol-FASEB J. 2014;28:S916.4
- Kampmann K, Ueberberg S, Menge BA, Breuer TGK, Uhl W, Tannapfel A, et al. Abundance and turnover of GLP-1 producing L-cells in ileal mucosa are not different in patients with and without type 2 diabetes. Metabolism. 2016;65:84–91. doi:10.1016/j.metabol.2015.10.025.
- Sanyal D. Diabetes is predominantly an intestinal disease. Indian J Endocrinol Metab. 2013;17(Suppl1): S64-S67.
- Rubino F. Is type 2 diabetes an operable intestinal disease. Diab Care. 2008;31 (suppl 2):S290-S296.
- McCue DL, Kasper JM, Hommel JD. Regulation of motivation for food by neuromedin U in the paraventricular nucleus and the dorsal raphe nucleus. International J Obes. 2016;41:120–8. doi:10.1038/ijo.2016.178.
- Kaczmarek P, Malendowicz LK, Pruzynska-Oszmalek EA, Wojciechowicz T, Szczepankiewicz D, et al. Neuromedin U receptor 1 expression in the rat endocrine pancreas and evidence suggesting neuromedin U sup pressive effect o n insulin secretion from isolated rat pancreatic islets. Inter J Mol Med. 2006;18:951-955.
- Röder PV, Wu B, Liu Y, Han W. Pancreatic regulation of glucose homeostasis. Experimental Mol Med. 2016;48:e219. doi:10.1038/emm.2016.6.
- Alfa RW, Park S, Skelly K-R, Poffenberger G, Jain N, Gu X, et al. Suppression of Insulin Production and Secretion by a Decretin Hormone. Cell Metab. 2015;21:323–34. doi:10.1016/j.cmet.2015.01.006.
- Rohde U, Hedbäck N, Gluud LL, Vilsbøll T, Knop FK. Effect of the EndoBarrier Gastrointestinal Liner on obesity and type 2 diabetes: a systematic review and meta-analysis. Diab Obes Metab. 2016;18:300–5. doi:10.1111/dom.12603.
- Jiang F, Zhu H, Zheng X, Tu J, Zhang W, Xie X. Duodenal- jejunal bypass for the treatment of type 2 diabetes in Chinese patients with an average body mass index <24kg/m. Surg Obes Relat Dis. 2014;10:641-6. doi:10.1016/j.soard.2013.09.001.
- Dalbøge LS, Pedersen PJ, Hansen G, Fabricius K, Hansen HB, Jelsing J, et al. A Hamster Model of Diet-Induced Obesity for Preclinical Evaluation ofAnti-Obesity, Anti-Diabetic and Lipid Modulating Agents. PLoS One 2015;10:e0135634. doi:10.1371/journal. pone.0135634.
- Kapeluto J, Tchernof A, Biertho L. Surgery for diabetes: clinical and mechanistic aspects. Can J Diabetes. 2017;41:392-400. doi: 10.1016/j.jcjd.2017.05.008.
- Hussain Ma, Akalestou E, Song W Inter-organ communication and regulation of beta cell function. Diabetologia. 2016;59:659-67. doi: 10.1007/s00125-015-3862-7.
- Schedl HP, Wilson HD. Effects of diabetes on intestinal growth in the rat. J Exp Zool. 1971;176:487–95. doi:10.1002/jez.1401760410.
- Zhang X, Wang Y, Zhong M, Liu T, Han H, Zhang G, et al. Duodenal-Jejunal Bypass Preferentially Elevates Serum Taurine-Conjugated Bile Acids and Alters Gut Microbiota in a Diabetic Rat Model. Obes Surg. 2015;26:1890–9. doi:10.1007/s11695-015-2031-x.
- Bhutta HY, Rajpal N, White W, Freudenberg JM, Liu Y, Way J, et al. Effect of Roux-en-Y gastric bypass surgery on bile acid metabolism in normal and obese diabetic rats. PLoS One. 2015;10:e0122273. doi:10.1371/journal. pone.0122273.
- Liu H, Hu C, Zhang X, Jia W. Role of gut microbiota, bile acids and their cross-talk in the effects of bariatric surgery on obesity and type 2 diabetes. J Diab Invest. 2017;9:13–20. doi:10.1111/jdi.12687.
- Kashihara H, Shimada M, Kurita N, Iwata T, Sato H, Yoshikawa K, et al. Duodeno-jejunal bypass improves insulin resistance by enhanced glucagon-like peptide-1 secretrion through increase of bile acids. Hepato-gatroenterol. 2014;61:1049—54.
- Hu C, Su Q, Li F, Zhang G, Sun D, Han H, et al. Duodenal- jejunal bypass improves glucose homeostasis in association with decreased proinflammatory response and activation of JNK in the liver and adipose tissue in a T2DM rat model. Obes Surg. 2014;24(9):1453-62 doi: 10.1007/s116995-014-1230-1.
- Festi D, Schiumerini R, Eusebi Lh, Marasco G, Taddia M et al. Gut microbiota and metabolic syndrome. World J Gastroenterol. 2014;20(43):16079-16094. doi:10.3748/ wjg.v20.i43.16079.
- Li M, Li H, Zhou Z, Zhou Y, Wang Y, Zhang X, et al. Duodenal- Jejunal Bypass Surgery Ameliorates Glucose Homeostasis and Reduces Endoplasmic Reticulum Stress in the Liver Tissue in a Diabetic Rat Model. Obesity Surgery 2015;26:1002–9. doi:10.1007/s11695-015-1816-2.
- Kashihara H, Shimada M, Kurita N, Sato H, Yoshikawa K, Higashijima J, et al. Duodenal-jejunal bypass improves diabetes and liver steatosis via enhanced glucagon- like peptide-1 elicited by bile acids. J Gastroenterol Hepatol. 2015;30:308–15. doi:10.1111/jgh.12690.
- Flynn CR, Albaugh VL, Cai S, Cheung-Flynn J, Williams PE, Brucker RM, et al. Bile diversion to the distal small intestine has comparable metabolic benefits to bariatric surgery. Nat Commun. 2015;6. doi:10.1038/ ncomms8715.
- Abruce-Keller AJ, Salbaum JM, Luo M, Blanchard E, Taylor CM, Welsh DA, et al. Obese type gut microbiota induce neurobehavioral changes in the absence of obesity. Biol Psychiatry. 2015;77:607-15. doi: 10.1016/j. biopsych-2014.07.012.
- Swisa A, Glaser B, Dor Y. Metabolic stress and compromised identity of pancreatic beta cells. Front Genet. 2017;8:21 doi:10.3389/fgene.2071.00021.
- Cheng C-W, Villani V, Buono R, Wei M, Kumar S, Yilmaz OH, et al. Fasting-mimicking diet promotes Ngn3-Driven β-cell regeneration to reverse diabetes. Cell. 2017;168:775–788.e12. doi:10.1016/j.cell.2017.01.040.
- Shao Y, Ding R, Xu B, Hua R, Shen Q, He K, et al. Alterations of gut microbiota after Roux-en-Y gastric bypass and sleeve gastrectomy in Sprague-Dawley rats. Obesity Surgery 2016;27:295–302. doi:10.1007/s11695-016-2297-7.
- Sala P, Torrinhas RS, Fonseca DC, Heymsfield S, Giannella- Neto D, Waitzberg DL. Type 2 diabetes remission after Roux-en-Y Gastric bypass: evidence for increased expression of jejunal genes encoding regenerating pancreatic islet-derived proteins as a potential mechanism. Obes Surg. 2017;27:1123–7. doi:10.1007/s11695-017-2602-0
- Mahdy T, Al wahedi A, Schou C. Efficacy of single anastomosis sleeve ileal (SASI) bypass for type-2 diabetic morbid obese patients: Gastric bipartition, a novel metabolic surgery procedure: A retrospective cohort study. Int J Surg. 2016;34:28–34. doi:10.1016/j.ijsu.2016.08.018.
- Gagner M. Safety and efficacy of a side-to-side duodeno-ileal anastomosis for weight loss and type-2 diabe tes: duodenal bipartition, a novel metabolic surgery procedure. Ann Surg Innov Res. 2015;9. doi:10.1186/s13022-015-0015-0.
- Rodrigues MR da S, Santo MA, Favero GM, Vieira EC, Artoni RF, Nogaroto V, et al. Metabolic surgery and intestinal gene expression: Digestive tract and diabetes evolution considerations. World Journal of Gastroenterology 2015;21:6990–8. doi:10.3748/wjg.v21.i22.6990.
- Srockeld D, Backman L, Granström L. Jejunoileal bypass operations with a side-to-side anastomosis in the treatment of morbid obesity. Obes Surg. 1991;1:161-4.
- Lazzarotto De Melo Souza J. Derivação intestinal seletiva: Ponto. Einstein. 2006:Supl 1:S151-S156.
- Duan J, Tan C, Xu H, Nie S. Side-to-side jejunoileal bypass induces better glucose-lowering effect than endto- side jejunoileal bypass on nonobese diabetic rats. Obes Surg. 2015;25:1458–67. doi:10.1007/s11695-014-1549-7.
- Ren Q, Duan J, Cao J. Rapid improvement in diabetes after simple side-to-side jejunoileal bypass surgery: does it need a ligation or not? Obes Surg. 2018;28:1974–9. doi:10.1007/s11695-018-3122-2.
- Baldassano S, Amato A, Mulè F. Influence of glucagon- like peptide 2 on energy homeostasis. Peptides 2016;86:1–5. doi:10.1016/j.peptides.2016.09.010.
- McDuffie LA, Bucher BT, Erwin CR, Wakeman D, White FV, Warner BW. Intestinal adaptation after small bowel resection in human infants. J Ped Surg. 2011;46:1045–51. doi:10.1016/j.jpedsurg.2011.03.027.
- Ryou M, Aihara H, Thompson CC. Minimally invasive entero-enteral dual-path bypass using self-assembling magnets. Surgical Endoscopy 2016;30:4533–8. doi:10.1007/s00464-016-4789-x.
- Machytka E, Bužga M, Zonca P, Lautz DB, Ryou M, Simonson DC, et al. Partial jejunal diversion using an incisionless magnetic anastomosis system: 1-year interim results in patients with obesity and diabetes. Gastrointestinal Endoscopy 2017;86:904–12. doi:10.1016/j. gie.2017.07.009.
- Caravatto PP, Cohen R. The Role of metabolic surgery in non-alcoholic steatohepatitis improvement. Curr Atheroscler Rep. 2017;19:45. doi: 10.1007/s11883-017-0681. doi:10.1007/s11883-017-0681-y.
- Schiavon CA, Bersch-Ferreira AC, Santucci EV, Oliveira JD, Torreglosa CR, Bueno PT, et al. Effects of bariatric surgery in obese patients with hypertension. Circulation. 2018;137:1132–42. doi:10.1161/circulationaha. 117.032130.
- Cohen RV. Intestinal gluconeogenesis: another weight loss–independent antidiabetic effect of metabolic surgery. Surg Obes Relat Dis. 2017;13:630–1. doi:10.1016/j. soard.2017.01.028.
- Cohen RV, Luque A, Junqueira S, Ribeiro RA, Le Roux CW. What is the impact on the healthcare system if access to bariatric surgery is delayed? Surg Obes Relat Dis. 2017;13:1619–27. doi:10.1016/j.soard.2017.03.025.
- Mazidi M, de Caravatto PPP, Speakman JR, Cohen RV. Mechanisms of action of surgical interventions on weight-related diseases: the potential role of bile acids. Obes Surg. 2017;27:826–36. doi:10.1007/s11695-017-2549-1.
- Yan J, Cohen R, Aminian A. Reoperative bariatric surgery for treatment of type 2 diabetes mellitus.Surg Obes Relat Dis. 2017;13:1412–21. doi:10.1016/j.soard.2017.04.019.
- Cohen RV, Pereira TV, Aboud CM, Caravatto PP de P, Petry TBZ, Correa JLL, et al. Microvascular outcomes after metabolic surgery (MOMS) in patients with type 2 diabetes mellitus and class I obesity: rationale and design for a randomised controlled trial. BMJ Open 2017;7:e013574. doi:10.1136/bmjopen-2016-013574.
- Campos J, Ramos A, Szego T, Zilberstein B, Feitosa H,Cohen R. The role of Metabolic Surgery for patients with obesity grade I and type 2 Diabetes not Controlled Clinically. ABCD, Arq. Bras. Cir. Dig. 2016;29:102–6. doi:10.1590/0102-6720201600s10025.
- Campos Jm, Ramos Ac, Cohen R. The Importance of Brazilian Society of Metabolic and Bariatric Surgery and its interaction with the XXI World Congress of IFSO in BRrazil. ABCD Arq. Bras. Cir. Dig. 2016;29:1–2. doi:10.1590/0102-6720201600s10001.
- Cohen R, Caravatto PP, Petry TZ. Innovative metabolic operations. Surg Obes Relat Dis. 2016;12:1247–55. doi:10.1016/j.soard.2016.02.034.
- Cohen RV, Shikora S, Petry T, Caravatto PP, Le Roux CW. The diabetes surgery summit II guidelines: a disease-based clinical recommendation. Obes Surg. 2016;26:1989–91. doi:10.1007/s11695-016-2237-6.
- Cohen RV. Comment on: Laparoscopic sleeve gastrectomy and Roux-en-Y gastric bypass lead to equal changes in body composition and energy metabolism 17 months postoperatively: a prospective randomized trial. Surg Obes Relat Dis. 2016;12:570–1. doi:10.1016/j.soard.2015.09.002.
- Luque-de-León E, Carbajo MA. Conversion of one-anastomosis gastric bypass (OAGB) is rarely needed if standard operative techniques are performed. Obes Surg. 2016;26:1588–91. doi:10.1007/s11695-016- 2172-6.
- Novikov AA, Afaneh C, Saumoy M, Parra V, Shukla A, Dakin GF, et al. Endoscopic sleeve gastroplasty, laparoscopic sleeve gastrectomy, and laparoscopic band for weight loss: how do they compare? J Gastrointestinal Surg. 2017;22:267–73. doi:10.1007/s11605-017-3615-7.
- Angrisani L, Santonicola A, Iovino P, Vitiello A, Zundel N, Buchwald H, et al. Bariatric surgery and endoluminal procedures: IFSO Worldwide Survey 2014. Obes Surg. 2017;27:2279–89. doi:10.1007/s11695-017-2666-x.
- Alban EAD, García CA, Ospina LM, Munevar HE. Imaging after bariatric surgery: when interpretation is a challenge, from normal to abnormal. Obes Surg. 2018;28:2923–31. doi:10.1007/s11695-018-3334-5.
- Aschner P. Recent advances in understanding/managing type 2 diabetes mellitus. F1000Research 2017;6:1922. doi:10.12688/f1000research.11192.1.
- Quevedo M del P, Palermo M, Serra E, Ackermann MA. Metabolic surgery: gastric bypass for the treatment of type 2 diabetes mellitus. Transl Gastroenterol Hepatol. 2017;2:58–58. doi:10.21037/tgh.2017.05.10.
- Cani PD. Severe obesity and gut microbiota: doesbariatric surgery really reset the system? Gut 2018:gutjnl-2018-316815. doi:10.1136/gutjnl-2018-316815.
- Guilbert L, Joo P, Ortiz C, Sepúlveda E, Alabi F, León A, et al. Seguridad y eficacia de la cirugía bariátrica en México: análisis detallado de 500 cirugías en un centro de alto volumen. Revista de Gastroenterología de México 2018. doi:10.1016/j.rgmx.2018.05.002.
- Guilbert L, Ortiz CJ, Espinosa O, Sepúlveda EM, Piña T, Joo P, et al. Metabolic syndrome 2 years after laparoscopic gastric bypass. International Journal of Surgery 2018;52:264–8. doi:10.1016/j.ijsu.2018.02.056.
- Ramírez-Avilés E, Espinosa-González O, Amado-Galván M, Maydón-González H, Sepúlveda-Guerrero E, Zerrweck-López C. Evolución de los pacientes con diabetes mellitus tipo 2 e intolerancia a los carbohidratos posterior a cirugía bariátrica en la población mexicana. Cir Cir. 2017;85:135–42. doi:10.1016/j. circir.2016.07.005.
Fecha recibido: 13/07/2018 – Fecha aceptación: 21/08/2018
Correspondencia: Walter Kunz, MD – Boulevard Luis Donaldo Colosio N° 422, Colonia Sagrado Corazón, 76804 San Juan del Río, Querétaro, México, teléfonos: (52) (442) 433-5282 y (52) (442) 356-6581
Correo electrónico: walterkunz@gmail.com o arturo.perez.pacheco473@gmail.com
Citar: Kunz-Martínez W, Pérez-Pacheco AI. Bipartición de tránsito intestinal, la nueva era de la cirugía metabólica para la diabetes mellitus de tipo 2. Rev Colomb Cir. 2018;33: 406-20. https://doi.org/10.30944/20117582.88
Este es un artículo de acceso abierto bajo una Licencia Creative Commons – BY-NC-ND https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es


 Derivación Intestinal
Derivación Intestinal