experiencia de la Fundación Valle de Lili, Cali, Colombia
Luis Armando Caicedo1bcd, Juan Carlos Gómez-Vega2abd, Mauricio Francisco Duque6bcd,
Óscar Javier Serrano1bcd, Eliana Manzi3abd, Ana María Arrunátegui4bcd, Juan Guillermo Posada5bcd,
LilianaMesa5bcd, JohannaSchweineberg5bcd, Carlos Eduardo Durán5bcd, Jorge Iván Villegas1bcd,
Diana María Dávalos3abd, Gabriel Jaime Echeverri1bcd
Palabras clave: trasplante de riñón; trasplante isogénico; antígenos HLA; antígenos de histocompatibilidad; hermanos; inmunosupresión.
Resumen
Introducción. En el trasplante renal con HLA idéntico los episodios de rechazo agudo son menores y tienen mejores tasas de supervivencia del injerto, comparado con los receptores con HLA no idéntico; a pesar de esto, persiste el dilema en cuanto al retiro o la disminución de la dosis de inmunosupresión.
El objetivo de este trabajo es describir la experiencia de los trasplantes renales con HLA idéntico de donante vivo y cadavérico que se han realizado en la Fundación Valle del Lili desde 1995 hasta 2014.
Material y métodos. De los 1.462 trasplantes renales realizados se incluyeron aquellos con HLA idéntico. Se hizo un análisis estadístico descriptivo para todas las variables consideradas y, para subgrupos seleccionados, el análisis de supervivencia y de rechazo agudo se hizo con el método de Kaplan-Meier. Para el análisis se usó Stata 12.0®.
Resultados. Se practicaron 29 trasplantes renales con HLA idénticos. La mayoría fueron en hombres de raza mestiza y lo más frecuente fue una etiología desconocida de la enfermedad renal terminal. Dos pacientes presentaron rechazo agudo, y la supervivencia de los injertos a 1, 5, 10 y 15 años, fue de 100%, 93,7 %, 75 % y 75 %, respectivamente; la supervivencia de los pacientes a los 1, 5, 10 y 15 años, fue de 100%, 93,7 %, 84,3 % y 84,3 %, respectivamente.
Conclusiones. Los receptores HLA idénticos poseen una supervivencia prolongada del injerto con menos tasas de rechazo agudo.
Introducción
El primer trasplante renal exitoso fue realizado por Joseph Murray en 1954, entre gemelos idénticos 1,2. Después de este se llevaron a cabo nuevos trasplantes en pacientes vivos no relacionados, sin embargo, debido a la barrera inmunológica, la tasa de fracaso fue alta, y se inició el uso de azatioprina y prednisolona 2-11.
En los años siguientes, el entendimiento de los mecanismos de la reacción inmunológica condujo a un notable aumento de la inmunoterapia farmacológica 6,9. En la actualidad, pese a su desarrollo, persiste aún el temor de rechazo agudo y pérdida del injerto; en este ámbito, es bien conocido que el trasplante renal con HLA idéntico tiene una incidencia menor de rechazo agudo y una mejor supervivencia del injerto, comparado con aquel entre receptores no idénticos 12-15. Estos resultados pueden deberse a que los receptores con HLA idéntico son menos inmunogénicos; sin embargo, puede haber falta de apareamientos en los antígenos del complejo menor de histocompatibilidad (Minor Histocompatibility Antigens, mHAgs) 12,14,16,17.
Actualmente, con el advenimiento de nuevos tipos de donantes 18,19, se practica solo una minoría de trasplantes renales entre personas con HLA idéntico (aproximadamente el 5 % de todos los trasplantes de donantes vivos), porcentaje que puede ser aún menor del 2 % en los Estados Unidos con los de donante cadavérico 4,6-8,12-14,20-28. Por ende, se han llevado a cabo pocos estudios en este grupo de pacientes con HLA idéntico lo que ha conllevado ‘evidencia’ insuficiente en la literatura científica sobre factores de riesgo que disminuyan la supervivencia del injerto a largo plazo, al igual, que opiniones extremadamente diversas sobre los esquemas de inmunosupresión (minimización de la dosis versus retiro) 13,14,16.
Por esta razón, el objetivo de este artículo es describir nuestra experiencia en los pacientes de trasplante con HLA idéntico, evaluando los esquemas de inmunosupresión y los resultados de la supervivencia del injerto y del paciente.
Materiales y métodos
Se hizo un estudio transversal anidado en una cohorte retrospectiva, basado en el registro de trasplantes de órganos sólidos abdominales de la Fundación Valle de Lili. Del registro institucional de trasplante renal, se seleccionaron aquellos con HLA idéntico, entre los años 1995 y 2014.
En esta institución, el trasplante con HLA idéntico se define como aquel en el cual el receptor y el donante comparten los mismos alelos (A, B y DR), tipificados por técnicas moleculares, con una posibilidad máxima de tener seis alelos idénticos, dos A, dos B y dos DR. Este tipo de trasplante debe diferenciarse del HLA-cero-mismatched, en el cual el receptor tiene más alelos tipificados que el donante y aquellos que el donante tiene son idénticos al receptor, por ejemplo, el HLA del receptor es A1, A2, B3, B4, DR5 y DR6, y la tipificación del HLA en el donante es A0, A2, B3, B4, DR5 y DR6, donde no existen dos alelos A tipificables en el donante, y queda un alelo cero, técnicamente se podría llamar un cero mismatched pero no HLA idéntico.
Tipificación del HLA
El ADN se extrajo a partir de sangre periférica, usando las técnicas de precipitación salina (salting-out) y el UltraClean DNA Blood Isolation Kit. Para la tipificación se usaron técnicas moleculares, PCRSSP (Sequence Specific Primers) usando el reactivo ABDR SSPTray de Biotest (Dreieich, Germany) y PCR-SSOP (Sequence Specific Oligonucleotide Probes) INNO-LiPA HLA-A, B, DRB1 Innogenetics 29. Los resultados se obtuvieron con ayuda del kit Biotest HLA-SSP typing v1.1 y del software LiRAS® para LiPA HLA v5.0, respectivamente.
Estadística
Se hizo un análisis estadístico descriptivo para todas las variables consideradas y para los subgrupos seleccionados. Las variables categóricas se presentan en proporciones. El test de Shapiro-Wilk se usó para determinar la normalidad de los datos; las variables numéricas se presentan en promedios y desviación estándar o medianas y rangos intercuartilicos.
Para el análisis de supervivencia del paciente, de la del injerto y del rechazo agudo, se utilizó el método de Kaplan-Meier. Se hizo un análisis bivariado para la pérdida del injerto y se consideró una diferencia estadísticamente significativa con un valor de p menor de 0,05. El programa estadístico Stata 12.0® se usó para el análisis estadístico.
Resultados
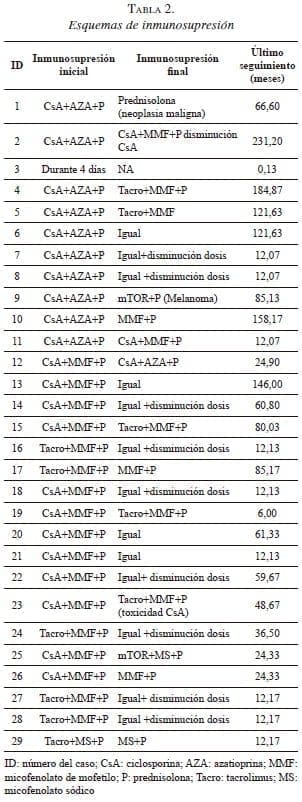
De los1.462 trasplantes renales realizados desde 1995 hasta 2014, se identificaron 29 (1,98 %) trasplantes con HLA idénticos. En las tablas 1 y 2 se pueden observar las características sociodemográficas y los esquemas de inmunosupresión de los 29 pacientes.
La incidencia de rechazo agudo fue de 6,98 % (n=2); el caso 12 presentó un rechazo agudo clínico y, el caso 19, un rechazo agudo de grado 1A de Banff. En la figura 1 se muestra la probabilidad de estar libre de rechazo agudo durante el primer año después del trasplante; al tercer mes fue de 100 % y al año fue de 92,8 %.
En cinco pacientes se perdió el injerto por diversas causas (tabla 3). Para el análisis de supervivencia del injerto, no se incluyó el caso 3 por deberse a una complicación técnico-quirúrgica. La supervivencia global de los injertos a 1, 5, 10 y 15 años, fue de 100 %, 93,7 %, 75 % y 75 %, respectivamente (figura 2). En el análisis bivariado de la pérdida del injerto, el rechazo agudo se asocia con la pérdida del injerto (tabla 4); sin embargo, es necesario un análisis multivariado para confirmar que sea un factor de riesgo.

[enc_su_row][enc_su_column size=”1/2″]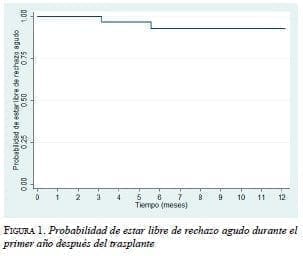
[/enc_su_column]
[enc_su_column size=”1/2″]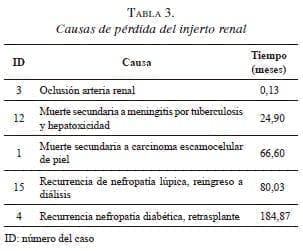 [/enc_su_column][/enc_su_row]
[/enc_su_column][/enc_su_row]
En el mismo análisis, se encontró que en ninguno de los pacientes en quienes la causa de la enfermedad renal crónica era desconocida se perdió el injerto renal. Esto implica que, según el cociente de riesgo en estos casos, la causa desconocida no representa un riesgo; sin embargo, es necesario un análisis multivariado para saber si se puede considerar como un factor protector.La mediana del seguimiento posterior al trasplante fue de 36 meses (rango intercuartílico, RIC: 12-85) y la de la creatinina en el último control fue de 1,36 mg/dl (RIC: 1,06-1,51). Las tres principales complicaciones encontradas fueron dislipidemia (44,83 %), hipertensión arterial de novo (41,38 %) e infección (27,59 %) (tabla 5); esta última se debió a sepsis de origen gastrointestinal, en dos pacientes, a infección urinaria, en dos, a neumonía en uno, a meningitis tuberculosa en uno, a infección por citomegalovirus en uno y a endocarditis en uno. Se encontraron dos neoplasias malignas, un melanoma (caso 9) y un carcinoma escamocelular queratinizante de glándula submandibular (caso 1).
La supervivencia global de los pacientes a 1, 5, 10 y 15 años, fue de 100 %, 93,7 %, 84,3 % y 84,3 %, respectivamente (figura 3).
[enc_su_row][enc_su_column size=”1/2″]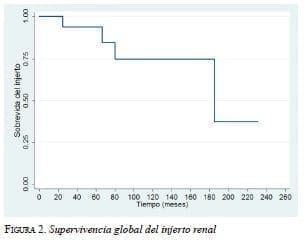 [/enc_su_column]
[/enc_su_column]
[enc_su_column size=”1/2″]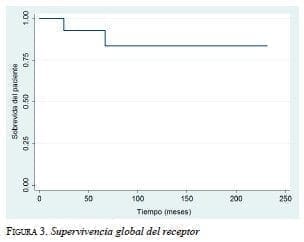 [/enc_su_column][/enc_su_row]
[/enc_su_column][/enc_su_row]
[enc_su_row][enc_su_column size=”1/2″]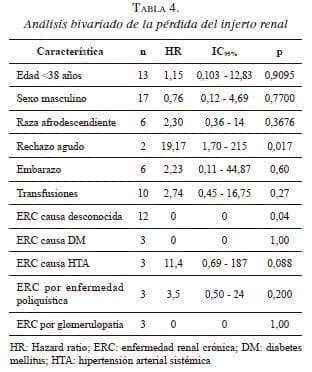 [/enc_su_column]
[/enc_su_column]
[enc_su_column size=”1/2″]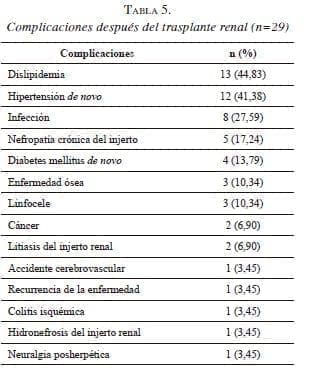 [/enc_su_column][/enc_su_row]
[/enc_su_column][/enc_su_row]
[enc_su_row][enc_su_column size=”1/2″]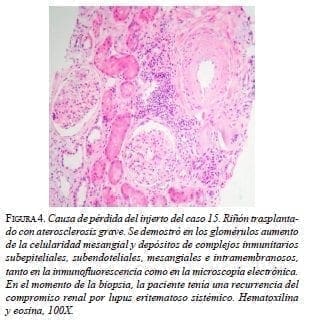 [/enc_su_column]
[/enc_su_column]
[enc_su_column size=”1/2″]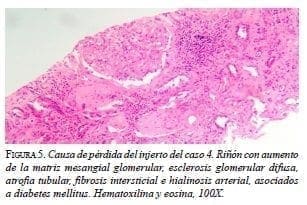 [/enc_su_column][/enc_su_row]
[/enc_su_column][/enc_su_row]
Discusión
Es interesante observar el trasfondo de las pérdidas de los injertos y los rechazos agudos. Ninguna pérdida del injerto renal se asoció con rechazo crónico; por el contrario, se relacionaron con recurrencias de la enfermedad de base, como se evidenció en la histopatología (figuras 4 y 5). En los casos de rechazo del injerto, el rechazo clínico coincidió con falta de cumplimiento del tratamiento. Además, 15 pacientes suspendieron o disminuyeron la dosis de alguno de los inmunosupresores y no presentaron pérdida del injerto o rechazo agudo del trasplante. Estos hallazgos podrían sustentar la hipótesis del bajo riesgo inmunológico que presenta este grupo de pacientes, en quienes, en teoría, se requiere una menor dosis de inmunosupresores, en comparación con el grupo de trasplantes con HLA no idéntico; por lo tanto, se podrían evitar efectos secundarios como toxicidad por el fármaco, predisposición a infecciones, propiedades cancerígenas, riesgo de diabetes mellitus, hiperlipemia e hipertensión arterial sistémica, alteraciones hematológicas o enfermedades óseas, entre otros 6,13,26,28.
Aunque se sabe que el trasplante renal con HLA idéntico tiene una mejor supervivencia que aquel con HLA no idéntico 4,7,8,12-16,20,21,30,31, aún es difícil elegir el esquema terapéutico de inducción y de mantenimiento, y su duración, pues la evidencia científica a nivel mundial no es concluyente. Existen dificultades metodológicas para extrapolar los resultados, como limitaciones en el tamaño de la muestra, estudios retrospectivos y variedad en los esquemas de inmunosupresión, que incluyen esteroides 14, azatioprina 32, micofenolato 13,23,24, inhibidores de la calcineurina 25-28, micofenolato en combinación con inhibidor de la calcineurina o mTOR 12; además, el uso de monoterapia o de inmunosupresión dual 15, lo que depende del centro en donde se hace el estudio.
En la literatura científica revisada, no se encontraron publicaciones sobre trasplantes renales con HLA idéntico provenientes de donantes fallecidos; en el presente trabajo, cinco trasplantes tuvieron estas características y, en uno de ellos, el donante fue un hermano, lo que estaría correlacionado con su condición de idéntico. Lim, et al., compararon 931 trasplantes de riñones zero-HLA-mismatched, 19 (2,0 %) entre gemelos homocigóticos o dicigóticos, 500 (53,7 %) de donantes vivos no gemelares y 412 (44,3 %) de donantes cadavéricos. Concluyeron que los receptores de trasplante renal zero- HLA-mismatched de donante cadavérico tienen un riesgo significativamente mayor de episodios de rechazo agudo y pérdida del injerto, en comparación con los receptores de trasplante de riñón de donantes vivos relacionados zero-HLA-mismatched, por lo que sugieren que reducir la intensidad de la inmunosupresión en los receptores de donante cadavérico puede no estar justificada, ya que no se han reportado los resultados a largo plazo en la supervivencia del paciente y del injerto en estos receptores 15.
Entre las limitaciones del presente estudio, se encuentran su naturaleza retrospectiva y un número pequeño de pacientes; además, la ausencia de un grupo de control, el cual, en futuros estudios, podría ser el grupo de los receptores de trasplante renal del mismo donante cadavérico.
En conclusión, consideramos que la selección o el retiro del tratamiento inmunosupresor deben individualizarse, teniendo en cuenta diversos factores descritos como la historia del trasplante, la enfermedad de base, el grado de inmunización del paciente, el curso posoperatorio y el estado actual del injerto establecido mediante por una biopsia, entre otros 6.
Agradecimientos
Agradecemos a Ana María Aristizábal, por la colaboración en la recolección de ciertos datos; y a Adriana Villegas, Luz Ángela Ocampo y el grupo del Departamento de Biología Molecular de la Fundación Valle de Lili, por la tipificación del HLA.
Conflicto de interés
Todos los autores certifican que no tienen conflicto de interés en relación con la publicación de este manuscrito
Renal transplant with identical HLA with living and cadaver donor:
Experience at Fundación Valle de Lili, Cali, Colombia
Abstract
Introduction: Kidney transplantation is the treatment of choice for patients with end-stage renal disease (ESRD). Graft rejection is much lower in terms of acute rejection and improved graft survival in renal transplantation with HLA-identical compared to non-identical HLA receptors. The aim of this work is to describe the experience of HLA identical kidney transplantation from live and deceased donors that have been performed at Valle de Lili Foundation since 1995 to 2014.
Materials and methods: From the 1,462 kidney transplants performed those with HLA-identical were identified, a descriptive statistical analysis was performed for all variables considered in the analysis and for selected subgroups, the analysis of survival and acute rejection was made with the Kaplan-Meier method. Stata 12.0 was used for the analysis.
Results: A total of 29 HLA-identical kidney transplants were performed. Most were men of mixed race; the main etiology of ESRD was unknown. Two patients had acute rejection and graft survival at five, ten and fifteen years was 93.7%, 75% and 75% respectively, patient survival at five, ten and fifteen years was 93.7%, 84.3% and 84.3% respectively.
Conclusions: HLA-identical receptors have a prolonged survival of the graft with less acute rejection rates.
Key words: Kidney transplantation; transplantation, isogeneic; HLA antigens; histocompatibility antigens; siblings; immunosuppression.
Referencias
1. Guild WR, Harrison JH, Merrill JP, Murray J. Successful ho¬motransplantation of the kidney in an identical twin. Trans Am Clin Climatol Assoc. 1956;67:167-73.
2. Harrison JH, Merrill JP, Murray JE. Renal homotransplantation in identical twins. Surg Forum. 1956;6:432-6.
3. Ojo AO, Morales JM, González-Molina M, Steffick DE, Luan FL, Merion RM, et al. Comparison of the long-term outcomes of kidney transplantation: USA versus Spain. Nephrol Dial Transplant. 2013;28:213-20.
4. de Mattos AM, Bennett WM, Barry JM, Norman DJ. HLA-identical sibling renal transplantation –a 21-yr single-center experience. Clin Transplant. 1999;13:158-67.
Hüser N, Matevossian E, Schmidbauer P, Assfalg V, Scherberich JE, Stangl M, et al. Calculated withdrawal of low-dose immuno¬
suppression based on a detailed immunological monitoring after kidney transplantation between monocygotic twins. Transpl Immunol. 2009;22:38-43.
6. Dziewanowski K, Drozd R, Chojnowska A, Dziewanowska- Rogalska M, Parczewski M. Kidney transplantation among identical twins: Therapeutic dilemmas. BMJ Case Rep. 2011;27;2011. doi: 10.1136/bcr.01.2011.3752.
7. Kessaris N, Mukherjee D, Chandak P, Mamode N. Renal transplantation in identical twins in United States and United Kingdom. Transplantation. 2008;86:1572-7.
8. Simmons RL, van Hook EJ, Yunis EJ, Noreen H, Kjellstrand CM, Condie RM, et al. 100 sibling kidney transplants fo-llowed 2 to 7 1/2 years: A multifactorial analysis. Ann Surg. 1977;185:196-204.
9. Bentley FR, Sutherland DE, Fryd DS, Kaufman D, Ascher NL, Simmons RL, et al. Similar renal allograft functional survival rates for kidneys from sibling donors matched for zero-versus-one haplotype with the recipient. Transplantation. 1984;38:674-9.
10. Grupo de trasplante del HUV. Trasplante renal. Rev Colomb Cirugía. 1990;5:22-5.
11. Gamarra G, Jaime G. Rechazo en pacientes con trasplante renal. Acta Médica Colomb. 1991;16:244-55.
12. Boran M, Boran M, Boran E. HLA-identical sibling renal trans¬plantation: influence of donor and recipient gender mismatch on long-term outcomes. Transplant Proc. 2014;46:3423-5.
13. Gascó B, Revuelta I, Sánchez-Escuredo A, Blasco M, Cofán F, Esforzado N, et al. Long-term mycophenolate monotherapy in human leukocyte antigen (HLA)-identical living-donor kidney transplantation. Transplant Res. 2014 3;3:4.
14. van de Wetering J, Gerrits JH, van Besouw NM, Ijzermans JNM, Weimar W. Successful tapering of immunosuppression to low-dose monotherapy steroids after living-related human leukocyte antigen-identical renal transplantation. Transplanta¬tion. 2009;87:740–4.
15. Lim WH, Gray NA, Chadban SJ, Pilmore H, Wong G. Graft and patient outcomes of zero-human leucocyte-antigen-mismatched deceased and live donor kidney transplant recipients. Transpl Int. 2015;28:610-8.
16. Gerrits JH, van de Wetering J, Weimar W, van Besouw NM. T-cell reactivity during tapering of immunosuppression to low-dose monotherapy prednisolone in HLA-identical living-related renal transplant recipients. Transplantation. 2009;87:907-14.
17. Arrunátegui A, Villegas A, Ocampo L, Rodríguez L, Badih A. Frecuencias alélicas, genotípicas y haplotípicas del sistema HLA clase I y II en donantes de una población del suroccidente colombiano. Acta Médica Colomb. 2013;38:16-21.
18. Sayegh MH, Carpenter CB. Transplantation 50 years la¬ter –progress, challenges, and promises. N Engl J Med. 2004;351:2761-6.
19. Kayler LK, Magliocca J, Zendejas I, Srinivas TR, Schold JD. Impact of cold ischemia time on graft survival among ecd transplant recipients: A paired kidney analysis. Am J Transplant. 2011;11:2647-56.
20. Andre M, Huang E, Everly M, Bunnapradist S. The UNOS Renal Transplant Registry: Review of the Last Decade. Clin Transpl. 2014:1-12.
21. Cecka JM. Kidney transplantation in the United States. Clin Transpl. 2008:1-18.
22. Matas AJ, Smith JM, Skeans MA, Thompson B, Gustafson SK, Stewart DE, et al. OPTN/SRTR 2013 Annual Data Report: Kidney. Am J Transplant. 2015;15(Suppl.2):1-34.
23. Walker JK, Alloway RR, Roy-Chaudhury P, Mogilishetty G, Cardi MA, Weimert N A, et al. A prospective trial of a steroid-free/calcineurin inhibitor minimization regimen in human leu¬kocyte antigen (HLA)-identical live donor renal transplantation. Transplantation. 2009;87:408-14.
24. Venot M, Abboud I, Duboust A, Michel C, Suberbielle C, Vé¬rine J, et al. Calcineurin inhibitor-free monotherapy in human leukocyte antigen–identical live donor renal transplantation. Transplantation. 2011;91:330-3.
25. Peddi VR, Weiskittel P, Alexander JW, Woodle ES, First MR. HLA-identical renal transplant recipients: Immunosuppres¬sion, long-term complications, and survival. Transplant Proc. 2001;33:3411-13.
26. MacDonald AS, Belitsky P, Bitter-Suermann H, Lawen J, MacSween M, Kiberd B, et al. Long-term follow-up (5 and 10 years) in recipients of HLA identical living related donor kidney grafts receiving continuous cyclosporine compared with azathioprine. Transplant Proc. 1997;29:190.
27. Keitel E, Santos AF, Alves MA, Neto JP, Schaefer PG, Bittar AE, et al. Immunosuppression protocols for HLA identical renal transplant recipients. Transplant Proc. 2003;35:1074-5.
28. Verghese PS, Dunn TB, Chinnakotla S, Gillingham KJ, Matas AJ, Mauer MS. Calcineurin inhibitors in HLA-identical living related donor kidney transplantation. Nephrol Dial Transplant. 2014;29:209-18.
29. Marsh SGE, Albert ED, Bodmer WF, Bontrop RE, Dupont B, Erlich HA, et al. Nomenclature for factors of the HLA system, 2010. Tissue Antigens. 2010;75:291-455.
30. Shimmura H, Tanabe K, Ishida H, Miyamoto N, Tokumoto T, Ishikawa N, et al. Long-term results of living kidney transplan¬tation from HLA-identical sibling donors under calcineurin inhibitor immunosuppression. Int J Urol. 2006;13:502-8.
31. Matas AJ, Payne WD, Sutherland DE, Humar A, Gruessner RW, Kandaswamy R, et al. 2,500 living donor kidney transplants: A single-center experience. Ann Surg. 2001;234:149-64.
32. Bartucci MR, Flemming-Brooks S, Koshla B, Knauss TC, Hricik DE, Schulak JA. Azathioprine monotherapy in HLA-identical live donor kidney transplant recipients. J Transpl Coord. 1999;9:35-9.
Correspondencia: Gabriel Jaime Echeverri, MD
Correo electrónico: gjecheverri@icesi.edu.co y
gjecheverri@hotmail.com
Cali, Colombia
1 Cirugía de Trasplante de Órganos Abdominales,
2 Médico y cirujano,
3 Epidemiologia,
4 Patología
5 Nefrología y
6 Fellow en Cirugía de Trasplantes
a Centro de investigaciones clínicas, Fundación Valle del Lili, Cali, Colombia.
b Unidad de Trasplantes, Fundación Valle del Lili, Cali, Colombia.
c Escuela de Medicina, Universidad Icesi, Cali, Colombia
d Centro para la Investigación en Cirugía Avanzada y Trasplantes (CICAT), Cali, Colombia
Fecha de recibido: 16 de mayo de 2016
Fecha de aprobación: 10 de agosto de 2016
Citar como: Caicedo LA, Gómez-Vega JC, Duque MF, Serrano OJ, Manzi E, Arrunátegui AM, et al. Trasplante renal con HLA idéntico de donante vivo y cadavérico: experiencia de la Fundación Valle de Lili, Cali, Colombia. Rev Colomb Cir. 2016;31:170-7.
