experiencia en la Fundación Valle de Lili, Cali, Colombia
Luis Armando Caicedo1, Juan Carlos Gómez-Vega2, Óscar Javier Serrano1, Eliana Manzi3, Juan Guillermo Posada4, LilianaMesa4, JohannaSchweineberg4, Carlos Eduardo Durán4, Ana María Arrunátegui5,
Diana Dávalos6, Jorge Iván Villegas1, Gabriel Jaime Echeverri1
Palabras clave: páncreas exocrino; trasplante de riñón; trasplante de páncreas; diabetes mellitus; complicaciones de la diabetes; insuficiencia renal crónica.
Resumen
Introducción. El trasplante simultáneo de riñón y páncreas es reconocido como un tratamiento eficaz para el manejo de pacientes con diabetes mellitus, principalmente de tipo I, e insuficiencia renal crónica. Sin embargo, hoy en día aún existe dificultad para el seguimiento del injerto pancreático, ya que no existe un marcador serológico definitivo que lo permita y persiste la dificultad para la toma de biopsias. Se ha descrito una modificación en la técnica quirúrgica que permitiría el acceso endoscópico mediante una duodeno-duodenostomía.
Materiales y métodos. Se seleccionaron los pacientes que recibieron un trasplante simultáneo de riñón y páncreas con derivación exocrina al duodeno, evaluando la seguridad del procedimiento, la evolución y las complicaciones médico-quirúrgicas.
Resultados. Nueve pacientes fueron sometidos a trasplante simultáneo de riñón y páncreas con derivación exocrina al duodeno. La mediana de la edad fue de 36 años y la mayoría era del sexo masculino. El tiempo de isquemia en frío fue de 10 horas para el injerto pancreático y de 11 horas para el renal. El tiempo total de hospitalización fue de 21 días. Se presentó una pérdida del injerto pancreático y una pérdida del injerto renal. Hubo una sola muerte, causada por aspergilosis pulmonar.
Conclusiones. La derivación exocrina duodenal permite y facilita la evaluación y el seguimiento endoscópico del injerto pancreático. No supone una mayor exigencia técnica en el trasplante simultáneo de riñón y páncreas, ni un incremento en el número de complicaciones en relación directa con la modificación del procedimiento quirúrgico.
Introducción
Entre las modalidades de trasplante pancreático, el trasplante simultáneo de riñón y páncreas (Simultaneous Pancreas-Kidney Transplant, SPK) es el más frecuente (80 %), seguido por el trasplante pancreático después del de riñón (Pancreas After Kidney Transplant, PAK) y, más raramente, el trasplante solo de páncreas (Pancreatic Transplant Alone, PTA) 1-8. El principal objetivo de este tipo de trasplante es mejorar la calidad de vida del individuo, promoviendo la independencia de insulina exógena, previniendo la progresión de las complicaciones secundarias (retinopatía, neuropatía, nefropatía y enfermedad vascular) y protegiendo el riñón trasplantado para incrementar su supervivencia 1,7,9-16.
El mayor desafío técnico del trasplante pancreático ha sido el adecuado manejo de las secreciones exocrinas que pueden llegar a desencadenar complicaciones quirúrgicas. Por esta razón, la técnica quirúrgica ha sufrido considerables modificaciones en el tiempo 17,18. Los primeros abordajes para resolver el manejo del drenaje exocrino del páncreas en el trasplante, incluyeron la confección de una duodenostomía cutánea en los injertos parciales 18,19. Posteriomente, y motivados por las complicaciones desencadenadas, se ensayó con su derivación hacia la vía urinaria 20. Años más tarde, se probó con un drenaje abierto con un segmento del injerto intraperitoneal 21 y su posterior oclusión por medio de una esclerosis a través de una inyección intraductal (neoprene, prolamina, polisoprene, silicona) 22-25.
Con la evolución hacia los injertos pancreáticos totales con inclusión del duodeno 26,27, en la década de los ochenta se concentró la atención en renovar la idea original de derivar la secreción exocrina del páncreas a la vejiga 28,29. Esto se hizo con los objetivos de reducir el riesgo de fugas en las anastomosis y de ofrecer un método seguro y potencialmente sensible para detectar el rechazo del injerto por medio de mediciones enzimáticas en orina (amilasa urinaria), y posibilitar la toma de biopsias mediante citoscopia; esta técnica fue la más comúnmente utilizada durante este periodo 30. No obstante, a causa de las complicaciones urológicas crónicas (infección urinaria, cistitis, uretritis y pancreatitis por reflujo, hematuria, acidosis metabólica y deshidratación por pérdida de líquidos y bicarbonato), se disminuyó su uso y dio lugar al drenaje entérico con una tasa cercana al 75 %, convirtiéndose este en el método estándar 17,31, el cual proporcionó un mejor perfil de seguridad, aunque persistieron las dificultades para su seguimiento 7,32.
Por esto, y en busca de un fácil acceso al injerto para la toma de biopsias, De Roover, et al. 33, propusieron en el 2007 una nueva transformación de la técnica mediante la derivación exocrina entérica con una anastomosis duodeno-duodenal. Con esta técnica se obtuvo un fácil acceso para la toma seriada de muestras de la mucosa duodenal y del tejido pancreático trasplantado por medio de una sencilla endoscopia, siendo una herramienta útil para su seguimiento histológico. Esta técnica se ha difundido en diferentes centros de todo el mundo y se implementó en la Fundación Valle del Lili en el 2014.
En este artículo se describe la experiencia con el trasplante simultáneo de riñón y páncreas, con drenaje exocrino por anastomosis duodeno-duodenal.
Materiales y métodos
Se trata de una serie de casos basada en el registro de trasplantes de órganos sólidos abdominales de la Fundación Valle de Lili, Cali, Colombia. Se seleccionaron los pacientes sometidos a trasplante simultáneo de riñón y páncreas con drenaje exocrino al duodeno, que cumplieran un seguimiento mínimo de 30 días. Se recolectó la información sobre las variables clínicas en el seguimiento del trasplante, inmediato, a mediano plazo y a largo plazo, que permitiesen evaluar la seguridad de la técnica en comparación con el procedimiento estándar previamente utilizado, o sea, la duodeno-yeyunostomía.
El protocolo institucional utilizado para pacientes sometidos a trasplante simultáneo de riñón y páncreas, incluyó inducción con anticuerpos policlonales (timoglobulina) e inmunosupresión triple con inhibidor de calcineurina (tacrolimus), antimetabolito (micofenolato de mofetilo) y esteroides, profilaxis prequirúrgica antibiótica y antifúngica y antiviral posquirúrgica (ganciclovir-valganciclovir), además de los antibióticos profilácticos recibidos en conjunto con el protocolo de trasplante renal.
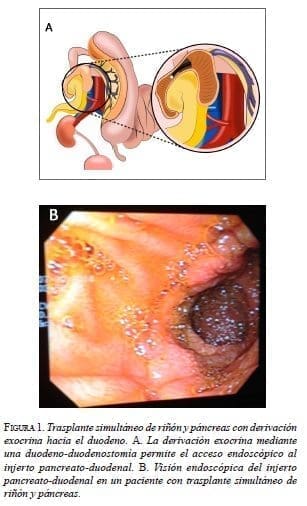 La modificación en la técnica quirúrgica estándar incluyó la derivación exocrina mediante una duodeno- duodenostomía manual en dos planos. Los pasos restantes del procedimiento no se cambiaron (derivación endocrina sistémica mediante anastomosis término-lateral de la porta del injerto a la vena cava inferior y el injerto arterial a la arteria iliaca común o aorta, y la orientación cefálica del injerto para practicar la derivación exocrina propuesta (figura 1).
La modificación en la técnica quirúrgica estándar incluyó la derivación exocrina mediante una duodeno- duodenostomía manual en dos planos. Los pasos restantes del procedimiento no se cambiaron (derivación endocrina sistémica mediante anastomosis término-lateral de la porta del injerto a la vena cava inferior y el injerto arterial a la arteria iliaca común o aorta, y la orientación cefálica del injerto para practicar la derivación exocrina propuesta (figura 1).
Para el análisis estadístico de normalidad de los datos, se usó el test de Shapiro-Wilk, de acuerdo con su distribución. Los datos se registraron en promedios, desviación estándar o medianas y rangos intercuartílicos (RIC), y las variables categóricas se presentaron en proporciones. Para el análisis estadístico se utilizó el programa Stata®, versión 12.0.
Resultados
Se revisaron los 1.597 casos de trasplante renal incluidos en el registro institucional. De estos, 39 pacientes fueron sometidos a trasplante simultáneo de riñón y páncreas, 9 con modificación en la técnica original mediante derivación exocrina del páncreas al duodeno.
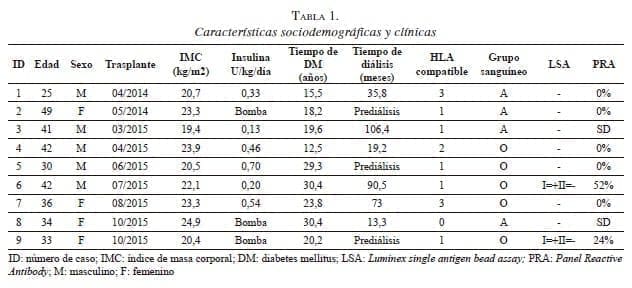
La mediana de edad de estos nueve pacientes fue de 36 años (RIC: 33-42), en su mayoría de sexo masculino, con un índice de masa corporal (IMC) en el receptor de 22,1 kg/m2 (RIC: 20,5-23,3). De los nueve pacientes, tres habían sido manejados con bomba de insulina, tres habían requerido prediálisis y dos presentaban hipersensibilización previa (tabla 1). En solo tres de ellos se logró documentar con claridad en la historia clínica al menos un episodio de hipoglucemia grave. Las afecciones más frecuentes fueron retinopatía (n=6), neuropatía (n=2) y cardiopatía (n=2).
El tiempo quirúrgico fue de 335 minutos (RIC: 260- 365), la isquemia en frío para el injerto pancreático fue de 10 horas (RIC:10-10,5) y, para el injerto renal, de 11 horas (RIC: 11-12). Cuatro de los nueve pacientes requirieron transfusiones de glóbulos rojos empaquetados durante o después el acto quirúrgico; de ellos, dos requirieron dos o más, y uno tuvo que someterse a empaquetamiento y reintervenciones múltiples por sangrado. La glucemia se normalizó en las primeras 24 a 48 horas después de la cirugía, con valores centrales promedio de 85 mg/ dl (RIC: 77-95,7); el promedio de la creatinina fue de 1,48 ± 0,98 mg/dl a los siete días después del trasplante. Por protocolo, todos los pacientes tuvieron un drenaje abdominal testigo después del procedimiento durante diez días (RIC: 10-14). En la mayoría de los pacientes la vía oral se inició a los 6,3 ± 3,7 días (tabla 2); durante el periodo posoperatorio temprano se utilizó nutrición entérica por sonda avanzada distal a la línea de anastomosis o por vía parenteral.
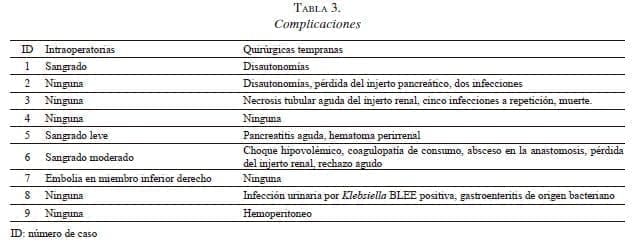
Las complicaciones se muestran en la tabla 3. La pérdida del injerto pancreático del caso 2 ocurrió por trombosis vascular secundaria a hipotensión sostenida por disautonomía, mientras que la pérdida del injerto renal en el caso 6 fue causada por un evento infeccioso abdominal (absceso adyacente al pedículo vascular renal) que provocó finalmente una trombosis venosa. Se presentó un fallecimiento tardío en el caso 3, a causa de una aspergilosis pulmonar no controlada. El promedio de seguimiento después del trasplante fue de 6,6 ± 5, meses. Actualmente, los pacientes restantes no requieren insulina y tienen una función renal estable.

Discusión
En la historia del trasplante simultáneo de riñón y páncreas, el problema técnico más desafiante ha sido el manejo de la función exocrina y el seguimiento del rechazo del injerto pancreático 34. Por eso, actualmente, entre las modalidades de derivación, la anastomosis duodeno-duodenal resulta ser una técnica atractiva que no aumenta significativamente el tiempo quirúrgico comparado con la duodeno-yeyunostomía 17,35; aparentemente, es más fisiológica 15; incluye una posición más fija del injerto 17,34, lo cual podría evitar la torsión de los vasos, reduciendo la trombosis del injerto 17,36; parece disminuir las tasas de complicaciones 37; permite el control endoscópico del injerto, lo cual podría permitir tomar biopsias del injerto pancreático por vía transduodenal mediante endosonografía 17,34,37, y permite dejar libres e indemnes los vasos iliacos izquierdos para posibles sitios de implante de injertos en caso de pérdida.
Generalmente, la tasa de complicaciones gastrointestinales es baja, excepto por el sangrado de la anastomosis 37, la cual se facilita por la abundante irrigación que posee el duodeno 37,38. Gunasekaran, et al., encontraron que las complicaciones hemorrágicas se correlacionaron con el uso de grapas circulares 17, por lo cual se modifico la técnica a una sutura manual en dos planos, sin que se presentaran nuevos episodios de sangrado de la anastomosis entérica.
En la presente casuística no se presentaron complicaciones relacionadas con sangrado gastrointestinal, y las pérdidas registradas de los injertos pancreático y renal se debieron a trombosis secundarias a causas desencadenantes médicas, no técnicas; de igual forma, el periodo de íleo posoperatorio no fue mayor al presentado con la técnica anterior. Las cifras de complicaciones no exceden las del registro previo, ni las cifras estándar en los registros mundiales 7,8,17,31,37,39-41.
Las biopsias renales y el seguimiento renal, a diferencia de lo pensado años atrás, parecen ser insuficientes para determinar el estado histopatológico del páncreas 42,43 y, así, poder tomar decisiones que permitan mejorar su supervivencia. Por esta razón, mediante el procedimiento propuesto de derivación exocrina por vía duodenal y la facilidad para el acceso endoscópico, los estudios futuros permitirán dilucidar su real utilidad y consolidarla como la técnica estándar.
Conclusión
El trasplante simultáneo de riñón y páncreas con drenaje por anastomosis duodeno-duodenal resulta ser un método seguro y simple de practicar.
En conclusión, pese a que el número de trasplantes de páncreas ha disminuido en la última década, lo cual podría atribuirse al desarrollo y mejoramiento de los sistemas de administración exógena de insulina 7 y al advenimiento de tratamientos como el trasplante de islotes pancreáticos 44,45, el trasplante simultáneo de páncreas y riñón continúa siendo el método óptimo de rehabilitación médica y social para pacientes con diabetes mellitus de tipo I y enfermedad renal crónica 1,15,16.
Entre las diferentes técnicas de drenaje exocrino, la derivación hacia el duodeno ha demostrado ser segura, simple de practicar y con menos complicaciones, comparada con otras alternativas; además, permite un acceso fácil para el control endoscópico del injerto pancreático.
Conflicto de interés
Todos los autores certifican que no tienen conflicto de interés en relación con la publicación de este ma-nuscrito.
Exocrine bypass to the duodenum in simultaneous kidney and pancreas transplant, experience at Fundación Valle de Lili, Cali, Colombia
Abstract
Introduction: Despite its recognition as an effective therapy for the management of patients with Type I diabetes mellitus and chronic renal failure, simultaneous kidney and pancreas transplant encounters difficulties in monitoring the pancreatic graft, and there is no strong serologic marker coupled with the difficulties in taking biopsies. We describe a modification of a surgical technique that allows endoscopic access through a duodenostomy.
Materials and methods: Patients who received simultaneous kidney-pancreas transplantation with exocrine bypass to the duodenum were selected to evaluate the safety of the procedure, the clinical postoperative course, and the medical and surgical complications.
Results: Nine patients were submitted to simultaneous kidney-pancreas transplantation with exocrine bypass to the duodenum. Median age was 36, most patients where male. Cold ischemia time was 10 hours for the pancreatic graft and 11 hours for the kidney graft. Total hospital stay was 21 days. There was one death caused by pulmonary aspergillosis.
Conclusions: The duodenal exocrine derivation permits and facilitates the evaluation and endoscopy follow-up of the pancreatic graft. It neither imposes greater technical demands in simultaneous kidney-pancreas transplantation, nor an increase in the number of complications directly related to the modification of the surgical procedure.
Key words: Pancreas, exocrine; kidney transplantation; pancreas transplantation; diabetes mellitus; diabetes complications; renal insufficiency, chronic.
Referencias
1. Meirelles Júnior RF, Salvalaggio P, Pacheco-Silva A. Pancreas transplantation: Review. Einstein (Sao Paulo). 2015;13:305-9.
2. Shyr YM. Pancreas transplantation. J Chin Med Assoc. 2009;72:4-9.
3. Han DJ, Sutherland DE. Pancreas transplantation. Gut Liver. 2010;4:450-65.
4. Bunnapradist S, Cho YW, Cecka JM, Wilkinson A, Danovitch GM. Kidney allograft and patient survival in type I diabetic recipients of cadaveric kidney alone versus simultaneous pan¬creas kidney transplants: A multivariate analysis of the UNOS database. J Am Soc Nephrol. 2003;14:208-13.
5. Steen DC. The current state of pancreas transplantation. AACN Clin Issues. 1999;10:164-75.
6. Kobayashi T, Gruessner AC, Wakai T, Sutherland DE. Three types of simultaneous pancreas and kidney transplantation. Transplant Proc. 2014;46:948-53.
7. Kandaswamy R, Stock PG, Skeans MA, Gustafson SK, Sleeman EF, Wainright JL, et al. OPTN/SRTR 2011 Annual Data Report: Pancreas. Am J Transplant. 2013;13(Suppl.1):47-72.
8. Kandaswamy R, Skeans MA, Gustafson SK, Carrico RJ, Tyler KH, Israni AK, et al. OPTN/SRTR 2013 Annual Data Report: Pancreas. Am J Transplant. 2015;15 (Suppl.2):1-20.
9. Robertson P, Davis C, Larsen J, Stratta R, Sutherland DE; Ame¬rican Diabetes Association. Pancreas transplantation in type 1 diabetes. Diabetes Care. 2004;27(Suppl.1):S105.
10. Mauer M, Fioretto P. Pancreas transplantation and reversal of diabetic nephropathy lesions. Med Clin North Am. 2013;97: 109-14.
11. McLaren AJ, Friend PJ. Trends in organ preservation. Transpl Int. 2003;16:701-8.
12. Rubino F, Gagner M. Potential of surgery for curing type 2 diabetes mellitus. Ann Surg. 2002;236:554-9.
13. Mingrone G, Panunzi S, De Gaetano A, Guidone C, Iaconelli A, Nanni G, et al. Bariatric-metabolic surgery versus conventional medical treatment in obese patients with type 2 diabetes: 5 year follow-up of an open-label, single-centre, randomised controlled trial. Lancet. 2015 5;386:964-73.
14. Pok EH, Lee WJ. Gastrointestinal metabolic surgery for the treatment of type 2 diabetes mellitus. World J Gastroenterol. 2014;20:14315-28.
15. Khubutia M, Pinchuk A, Dmitriev I, Storozhev R. Simultaneous pancreas-kidney transplantation with duodeno-duodenal anas¬tomosis. Transplant Proc. 2014;46:1905-9.
16. Lindahl JP, Jenssen T, Hartmann A. Long-term outcomes after organ transplantation in diabetic end-stage renal disease. Dia¬betes Res Clin Pract. 2014;105:14-21.
17. Gunasekaran G, Wee A, Rabets J, Winans C, Krishnamurthi V. Duodenoduodenostomy in pancreas transplantation. Clin Transplant. 2012;26:550-7.
18. Kelly WD, Lillehei RC, Merkel FK, Idezuki Y, Goetz FC. Allotransplantation of the pancreas and duodenum along with the kidney in diabetic nephropathy. Surgery. 1967;61:827-37.
19. Squifflet JP, Gruessner RW, Sutherland DE. The history of pan¬creas transplantation: Past, present and future. Acta Chir Belg. 2008;108:367-78.
20. Gliedman ML, Gold M, Whittaker J, Rifkin H, Soberman R, Freed S, et al. Clinical segmental pancreatic transplantation with ureter-pancreatic duct anastomosis for exocrine drainage. Surgery. 1973;74:171-80.
21. Sutherland DE, Goetz FC, Najarian JS. Intraperitoneal trans¬plantation of immediately vascularized segmental pancreatic grafts without duct ligation. A clinical trial. Transplantation. 1979;28:485-91.
22. Dubernard JM, Traeger J, Neyra P, Touraine JL, Tranchant D, Blanc-Brunat N. A new method of preparation of segmental pancreatic grafts for transplantation: Trials in dogs and in man. Surgery. 1978;84:633-9.
23. Land W, Gebhardt C, Gall FP, Weitz H, Gokel MJ, Stolte M. Pancreatic duct obstruction with prolamine solution. Transplant Proc. 1980;12(Suppl.2):72-5.
24. McMaster P, Calne RY, Gibby OM, Evans DB. Pancreatic trans¬plantation in man. Transplant Proc. 1980;12(Suppl.2):58-61.
25. Sutherland DE, Goetz FC, Rynasiewicz JJ, Baumgartner D, White DC, Elick BA, et al. Segmental pancreas transplantation from living related and cadaver donors: A clinical experience. Surgery. 1981;90:159-69.
26. Tydén G, Tibell A, Sandberg J, Brattström C, Groth CG. Impro¬ved results with a simplified technique for pancreaticoduodenal transplantation with enteric exocrine drainage. Clin Transplant. 1996;10:306-9.
27. Groth CG, Collste H, Lundgren G, Wilczek H, Klintmalm G, Ringdén O, et al. Successful outcome of segmental human pancreatic transplantation with enteric exocrine diversion after modifications in technique. Lancet. 1982;2:522-4.
28. Cook K, Sollinger HW, Warner T, Kamps D, Belzer FO. Pancrea¬ticocystostomy: An alternative method for exocrine drainage of segmental pancreatic allografts. Transplantation. 1983;35:634-6.
29. Sollinger HW, Cook K, Kamps D, Glass NR, Belzer FO. Cli¬nical and experimental experience with pancreaticocystostomy for exocrine pancreatic drainage in pancreas transplantation. Transplant Proc. 1984;16:749-51.
30. Prieto M, Sutherland DE, Goetz FC, Rosenberg ME, Najarian JS. Pancreas transplant results according to the technique of duct management: Bladder versus enteric drainage. Surgery. 1987;102:680-91.
31. Sollinger HW, Odorico JS, Becker YT, D’Alessandro AM, Pirsch JD. One thousand simultaneous pancreas-kidney transplants at a single center with 22-year follow-up. Ann Surg. 2009;250: 618-30.
32. Gruessner AC, Sutherland DE. Pancreas transplant outcomes for United States (US) and non-US cases as reported to the United Network for Organ Sharing (UNOS) and the Internatio¬nal Pancreas Transplant Registry (IPTR) as of June 2004. Clin Transplant. 2005;19:433-55.
33. De Roover A, Coimbra C, Detry O, van Kemseke C, Squifflet JP, Honore P, et al. Pancreas graft drainage in recipient duodenum: Preliminary experience. Transplantation. 2007;84:795-7.
34. Hummel R, Langer M, Wolters HH, Senninger N, Brockmann JG. Exocrine drainage into the duodenum: A novel technique for pancreas transplantation. Transpl Int. 2008;21:178-81.
35. Serrano OJ, Villegas JI, Echeverri GJ, Posada JG, Mesa L, Schweineberg J, et al. Trasplante simultáneo de riñón y páncreas en pacientes con diabetes mellitus de tipo 1, Clínica Fundación Valle del Lili, Cali, 2001-2013. Rev Colomb Cir. 2014;29:32-41.
36. Boggi U, Vistoli F, Signori S, Del Chiaro M, Campatelli A, Amorese G, et al. A technique for retroperitoneal pancreas transplantation with portal-enteric drainage. Transplantation. 2005;79:1137-42.
37. Walter M, Jazra M, Kykalos S, Kuehn P, Michalski S, Klein T, et al. 125 cases of duodenoduodenostomy in pancreas trans¬plantation: A single-centre experience of an alternative enteric drainage. Transpl Int. 2014;27:805-15.
38. Shokouh-Amiri H, Zakhary JM, Zibari GB. A novel technique of portal-endocrine and gastric-exocrine drainage in pancreatic transplantation. J Am Coll Surg. 2011;212:730-9.
39. Humar A, Ramcharan T, Kandaswamy R, Gruessner RW, Gruessner AC, Sutherland DE. Technical failures after pancreas transplants: Why grafts fail and the risk factors–a multivariate analysis. Transplantation. 2004;78:1188-92.
40. Grochowiecki T, Galazka Z, Madej K, Frunze S, Nazarews¬ki S, Jakimowicz T, et al. Surgical complications related to transplanted pancreas after simultaneous pancreas and kidney transplantation. Transplant Proc. 2014;46:2818-21.
41. Gruessner AC. 2011 update on pancreas transplantation: Com¬prehensive trend analysis of 25,000 cases followed up over the course of twenty-four years at the International Pancreas Transplant Registry (IPTR). Rev Diabet Stud. 2011;8:6-16.
42. Redfield RR, Scalea JR, Odorico JS. Simultaneous pancreas and kidney transplantation: Current trends and future directions. Curr Opin Organ Transplant. 2015;20:94-102.
43. Mohan S, Palanisamy A, Tsapepas D, Tanriover B, Crew RJ, Dube G, et al. Donor-specific antibodies adversely affect kidney allograft outcomes. J Am Soc Nephrol. 2012;23:2061-71.
44. Echeverri GJ, Sabogal AN, Caicedo LA, Casas LA, Mesa L, Schweineberg J, et al. Primer trasplante de islotes realizado en Colombia, experiencia fundación Valle del Lili. Revista Colom¬biana de Endocrinología, Diabetes y Metabolismo. 2015;2:33-9.
45. Sabogal AN, Casas LA, Arango LG, Ferriz K, Guzmán G, Gutiérrez O, et al. Presente y futuro del trasplante de islotes pancreáticos, un tratamiento innovador para la diabetes tipo 1. Revista Colombiana de Endocrinología, Diabetes y Metabolis-mo. 2015; 2:20-32.
Correspondencia: Gabriel Jaime Echeverri, MD, Fundación Valle del Lili, Universidad Icesi
Cali, Colombia
gjecheverri@icesi.edu.co y gjecheverri@hotmail.com
1 Cirugía de Trasplante de Órganos Abdominales
2 Médico y cirujano
3 Epidemiología
4 Nefrología
5 Patología de Trasplantes
6 Salud Pública y Metodología de la Investigación
Centro de Investigaciones Clínicas, Fundación Valle del Lili, Unidad de Trasplantes, Cali, Colombia; Universidad Icesi, Centro para la Investigación en Cirugía Avanzada y Trasplantes (CICAT), Cali, Colombia
Fecha de recibido: 16 de mayo de 2016
Fecha de aprobación: 10 de agosto de 2016
Citar como: Caicedo LA, Gómez-Vega JC, Serrano OJ, Manzi E, Posada JG, Mesa L, et al. Derivación exocrina al duodeno en trasplante simultáneo de riñón y páncreas, experiencia en la Fundación Valle de Lili, Cali, Colombia. Rev Colomb Cir. 2016;31:178-84.
