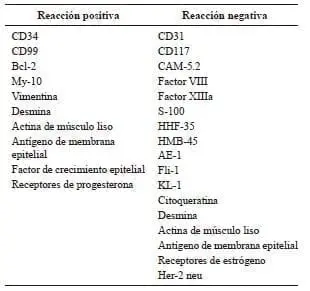
En la tabla 3 se describen todos los marcadores inmunohistoquímicos utilizados en el estudio de los tumores fibrosos solitarios del hígado con las reacciones positivas y negativas que caracterizan a estos tumores; algunos de los marcadores utilizados son positivos en unos casos y negativos en otros 7,8,10-18,20,23-27,29,35. Los tumores más fibrosos, además de ser positivos para el CD34, lo son para otros marcadores inmunohistoquímicos, como el CD99, el Bcl-2, el antígeno de membrana epitelial y la actina de músculo liso. Por el contrario, los tumores más celulares son solo positivos para el CD34 38 (tabla 2). El ki-67 es positivo en 5 % o menos de las células de los tumores benignos fibrosos solitarios del hígado 13,26. Se ha propuesto un ki-67 elevado más de 5 %, como marcador de carcinogenia en estos casos 7,8,24,27.
Tabla 3.
Marcadores inmunohistoquímicos utilizados en el estudio del tumor fibroso solitario del hígado
Análisis molecular, ultraestructura celular y genética
Los tumores solitarios fibrosos son muy heterogéneos en su ultraestructura celular; muestran una variada diferenciación en diferentes tipos de células, como fibroblastos, miofibroblastos, células endoteliales, pericitos y células perivasculares indiferenciadas, en diferentes proporciones 38. Genéticamente, estos tumores presentan predominantemente anomalías estructurales en los cromosomas X, 2, 9, 15 y 18; sin embargo, no existe hasta el presente un consenso definitivo sobre las anomalías genéticas en estos tumores 40.
Quimioterapia
No existe evidencia del beneficio de la quimioterapia en el tumor fibroso solitario del hígado 8,13,17,29. Los tumores fibrosos solitarios tienen una muy baja sensibilidad a la quimioterapia convencional 41. Se han hecho estudios experimentales con malato de sunitinib en tumores solitarios fibrosos de otras localizaciones, con resultados promisorios 42. El sunitinib es un inhibidor de la tirosino-cinasa, activo contra el receptor del factor de crecimiento derivado de las plaquetas alfa y beta (Platelet-Derived Growth Factor Receptor Alpha and Beta, PDGFRA y PDGFRB), y se ha utilizado con buenos resultados como tratamiento de segunda línea en los tumores del estroma gastrointestinal. En los estudios de Silvia Stacchiotti, este agente quimioterapéutico ha demostrado una excelente actividad contra los tumores fibrosos solitarios, con una adecuada reacción a largo plazo en 35 pacientes (4 años) 42,43. Aun cuando ninguno de los pacientes en estos estudios presentaba un tumor fibroso solitario del hígado, los datos de estos estudios pueden ser tomados en cuenta en el momento de tratar pacientes con este tumor.
Pronóstico
Los tumores fibrosos solitarios tienen un pronóstico incierto debido a su comportamiento impredecible 10,15,20,35,44. Se desconoce su potencial maligno 8,11,15,35,44. Aproximadamente, 10 a 15 % de todos estos tumores presentan un comportamiento inicial maligno, en la forma de recurrencias, metástasis o hipoglucemia intratable 7,8,38. Las metástasis se presentan con mayor frecuencia en los pulmones, los huesos, el cráneo y el hígado 23,24. Generalmente, los tumores solitarios fibrosos del tipo celular son más agresivos, principalmente los localizados en el mediastino, el peritoneo, el retroperitoneo y la pelvis 38. La presentación maligna es primaria; solo en algunos casos excepcionales se ha demostrado la progresión de tumores solitarios fibrosos desde su forma benigna a su forma maligna, que se manifiesta con la pérdida de reacción positiva al CD34 y se debe a la sobrexpresión de los genes p53 y p16 44.
El factor pronóstico más importante en el tumor fibroso solitario del hígado es la resección del tumor con márgenes libres, razón por la cual es fundamental lograr una resección R0, debido a que la transformación maligna en un sarcoma de alto grado tiene un pésimo pronóstico 7,8,11,13,14,17,35,36,38. En el caso específico de los tumores fibrosos solitarios del hígado de carácter maligno, aun cuando se han reportado muy pocos casos hasta la fecha (solo cuatro en la literatura inglesa), la presentación del tumor es muy agresiva y generalmente de mal pronóstico a corto plazo 7,8,23,24. Por estas razones, se recomienda el seguimiento metódico y a largo plazo de los pacientes tratados quirúrgicamente por tumor fibroso solitario del hígado 13,14,17,27,28,35.
Conclusiones
El tumor fibroso solitario del hígado es una neoplasia muy infrecuente. Su presentación clínica es habitualmente asintomática y su comportamiento es incierto. En algunos casos, se comporta como un sarcoma agresivo y de mal pronóstico. Actualmente, solo la cirugía ofrece una oportunidad terapéutica en estos casos. Debido al actual desconocimiento de su comportamiento a largo plazo y a la falta de tratamientos específicos, el seguimiento metódico a largo plazo es fundamental para garantizar la supervivencia de los pacientes tratados.
Conflicto de intereses: ninguno.
Solitary fibrous tumor of the liver: updating knowledge
Abstract
Solitary fibrous tumors of the liver (SFTL) are uncommon tumors. To the present day less than 50 cases has been reported in the scientific English literature, most of which behaved as benign tumors. The present article has the main purpose of updating knowledge on SFTL because, due to its rarity, its clinical presentation, study, treatment and prognosis, are not well known. The clinical presentation, radiologic study, surgical treatment, immunohistochemical study and prognosis are updated and comprehensively discussed. The SFTL is an uncommon neoplasm. The clinical presentation is habitually indolent and its behavior is uncertain. In some cases, the SFTL acts as an aggressive sarcoma with poor prognosis. Currently, only surgery offers a therapeutic opportunity for these patients. Due to the lack of current knowledge on the long-term behavior of supposedly benign SFTLs and to the lack of specific therapies, methodical long-term follow-up is essential to ensure the survival of patients treated for SFTL.
Key words: liver; mesenchymal stromal cells; liver neoplasms; solitary fibrous tumor; hemangiopericytoma; hepatectomy.
Referencias
1. Cardillo G, Carbone L, Carleo F, Masala N, Graziano P, Bray A, et al. Solitary fibrous tumors of the pleura: An analysis of 110 patients treated in a single institution. Ann Thorac Surg. 2009;88:1632-7.
2. Langman G. Solitary fibrous tumor: A pathological enigma and clinical dilemma. J Thorac Dis. 2011;3:86-7.
3. Hanau CA, Miettinen M. Solitary fibrous tumor: Histological and immunohistochemical spectrum of benign and malignant variants presenting at different sites. Hum Pathol. 1995;26:440- 9.
4. Gold JS, Antonescu CR, Hajdu C, Ferrone CR, Hussain M, Lewis JJ, et al. Clinicopathologic correlates of solitary fibrous tumors. Cancer. 2002;94:1057-68.
5. Kunieda K, Tanaka Y, Nagao N, Yamaguchi K, Sano J, Osada S, et al. Large solitary fibrous tumor of the retroperitoneum: Report of a case. Surg Today. 2004;34:90-3.
6. Kanthan R, Torkian B. Recurrent solitary fibrous tumor of the pleura with malignant transformation. Arch Pathol Lab Med. 2004;128:460-2.
7. Chan G, Horton PJ, Thyssen S, Lamarche M, Nahal A, Hill DJ, et al. Malignant transformation of a solitary fibrous tumor of the liver and intractable hypoglycemia. J Hepatobiliary Pancreat Surg. 2007;14:595-9.
8. Jakob M, Schneider M, Hoeller I, Laffer U, Kaderli R. Ma¬lignant solitary fibrous tumor involving the liver. World J Gastroenterol. 2013;19:3354-7.
9. Nevius DB, Friedman NB. Mesotheliomas and extraovarian thecomas with hypoglycemic and nephrotic syndromes. Cancer. 1959;12:1263-9.
10. Ji Y, Fan J, Xu Y, Zhou J, Zeng HY, Tan YS. Solitary fibrous tumor of the liver. Hepatobiliary Pancreat Dis Int. 2006;5:151-3.
11. Terkivatan T, Kliffen M, de Wilt JH, van Geel AN, Eggermont AM, Verhoef C. Giant solitary fibrous tumor of the liver. World J Surg Oncol. 2006;4:81.
12. Neeff H, Obermaier R, Technau-Ihling K, Werner M, Kurtz C, Imdahl A, et al. Solitary fibrous tumor of the liver: Case report and review of the literature. Langenbecks Arch Surg. 2004;389:293-8.
13. Vennarecci G, Ettorre GM, Giovanelli L, del Nonno F, Pe¬rracchio L, Visca P, et al. Solitary fibrous tumor of the liver. J Hepatobiliary Pancreat Surg. 2005;12:341-4.
14. Perini MV, Herman P, D’Albuquerque LA, Saad WA. Solitary fibrous tumor of the liver: Report of a rare case and review of the literature. Int J Surg. 2008;6:396-9.
15. Sun K, Lu JL, Teng XD, Ying LX, Wei JF. Solitary fibrous tumor of the liver: A case report. World J Surg Oncol. 2011;9:37.
16. Liu Q, Liu J, Chen W, Mao S, Guo Y. Primary solitary fibrous tumors of liver: A case report and literature review. Diagnostic Pathol. 2013;8:195.
17. Korkolis DP, Apostolaki K, Aggeli C, Plataniotis G, Gontikakis E, Volanaki D, et al. Solitary fibrous tumor of the liver expres¬sing CD34 and vimentin: A case report. World J Gastroenterol. 2008;14:6261-4.
18. Fama F, Le Bouc Y, Barrande G, Villeneuve A, Berry MG, Pidoto RR, et al. Solitary fibrous tumor of the liver with IGF-II-related hypoglycemia: A case report. Langenbecks Arch Surg. 2008;393:611-6.
19. Chithriki M, Jaibaji M, Vandermolen R. Solitary fibrous tumor of the liver with presenting symptoms of hypoglycemic coma. Am Surg. 2004;70:291-3.
20. Guglielmi A, Frameglia M, Iuzzolino P, Martignoni G, de Man¬zoni G, Laterza E, et al. Solitary fibrous tumor of the liver with CD 34 positivity and hypoglycemia. J Hepatobiliary Pancreat Surg. 1998;5:212-6.
21. Anderson N, Lokich JJ. Mesenchymal tumors associated with hypoglycemia. Cancer. 1979;44:785-90.
22. Shetty MR, Boghossian HM, Duffell D, Freel R, González JC. Tumor-induced hypoglycemia. Cancer. 1982;49:1920-3.
23. Yilmaz S, Kirimlioglu V, Ertas E, Hilmioglu F, Yildirim B, Katz D, et al. Giant solitary fibrous tumor of the liver with metastasis to the skeletal system successfully treated with trisegmentec¬tomy. Dig Dis Sci. 2000;45:168-74.
24. Pen L, Liu Y, Ai Y, Liu Z, He Y, Liu Q. Skull base metastases from a malignant solitary fibrous tumor of the liver: A case report and literature review. Diagnostic Pathol. 2011;6:127.
25. Fuksbrumer MS, Klimstra D, Panicek DM. Solitary fi¬brous tumor of the liver: Imaging findings. Am J Radiol. 2000;175:1683-7.
26. Moser T, Nogueira TS, Neuville A, Riehm S, Averous G, Weber JC, et al. Delayed enhancement pattern in a localized fibrous tumor of the liver. Am J Radiol. 2005;184:1578-80.
27. Taboada-Rodríguez V, Zueco-Zueco C, Sobrido-San Pedro C, Martínez-Vicente C. Tumor fibroso solitario hepático: ha¬llazgos radiológicos y revisión de la bibliografía. Radiología. 2010;52:67-70.
28. Soussan M, Felden A, Cyrta J, Morere JF, Douard R, Wind P. Solitary fibrous tumor of the liver. Radiology. 2013;269:304-8.
29. Nath DS, Rutzick AD, Sielaff TD. Solitary fibrous tumor of the liver. Am J Radiol. 2006;187:W187-90.
30. Ginat DT, Bokhari A, Bhatt S, Dogra V. Imaging features of solitary fibrous tumors. Am J Radiol. 2011;196:487-95.
31. Weimann A, Ringe B, Klempnauer J, Lamesch P, Gratz KF, Prokop M, et al. Benign liver tumors: Differential diagnosis and indications for surgery. World J Surg. 1997;21:983-91.
32. Terkivatan T, de Wilt JH, de Man RA, van Rijn RR, Zon¬dervan PE, Tilanus HW, et al. Indications and long-term outcome of treatment for benign hepatic tumors. Arch Surg. 2001;136:1033-8.
33. Ibrahim S, Chen CL, Wang SH, Lin CC, Yang CH, Yong CC, et al. Liver resection for benign liver tumors: Indications and outcome. Am J Surg. 2007;193:5-9.
34. Clarke DL, Currie EJ, Madhavan KK, Parks RW, Garden OJ. Hepatic resection for benign non-cystic liver lesions. HPB. 2004;6:115-9.
35. Novais P, Robles-Medranda C, Pannain VL, Barbosa D, Biccas B, Fogaca H. Solitary fibrous liver tumor: Is surgical approach the best option? J Gastrointest Liver Dis. 2010;19:81-4.
36. Weitz J, Klimstra DS, Cymes K, Jarnagin WR, D’Angelica M, La Quaglia MP, et al. Management of primary liver sarcomas. Cancer. 2007;109:1391-6.
37. Ali SZ, Hoon V, Hoda S, Heelan R, Zakowski MF. Solitary fibrous tumor: A cytologic-histologic study with clinical, radiologic, and immunohistochemical correlations. Cancer. 1997;81:116-21.
38. Gengler C, Guillou L. Solitary fibrous tumor and hemangiope¬ricytoma: Evolution of a concept. Histopathology. 2006;48:63- 74.
39. Hasegawa T, Matsuno Y, Shimoda T, Hirohashi S, Hirose T, Sano T. Frequent expression of bcl-2 protein in solitary fibrous tumors. Jpn J Clin Oncol. 1998;28:86-91.
40. Torabi A, Lele SM, DiMaio D, Pinnt JC, Hess MM, Nelson M, et al. Lack of a common or characteristic cytogenetic anomaly in solitary fibrous tumor. Cancer Genet Cytogenet. 2008;181:60-4.
41. Levard A, Derbel O, Méeus P, Ranchere D, Ray-Coquard I, Blay JY, et al. Outcome of patients with advanced solitary fibrous tumors: The Center Léon Bérard experience. BMC Cancer. 2013;13:109.
42. Stacchiotti S, Negri T, Palassini E, Conca E, Gronchi A, Morosi C, et al. Sunitinib malate and figitumumab in solitary fibrous tumor: Patterns and molecular bases of tumor response. Mol Cancer Ther. 2010;9:1286-97.
43. Stacchiotti S, Negri T, Libertini M, Palassini E, Marrari A, De Troia B, et al. Sunitinib malate in solitary fibrous tumor (SFT). Ann Oncol. 2012;23:3171-9.
44. Mosquera JM, Fletcher CD. Expanding the spectrum of malig¬nant progression in solitary fibrous tumors. Am J Surg Pathol. 2009;33:1314-21.
Correspondencia:
Marcelo A. Beltrán, MD
Correo electrónico: beltran_01@yahoo.com
La Serena, IV Región, Chile
