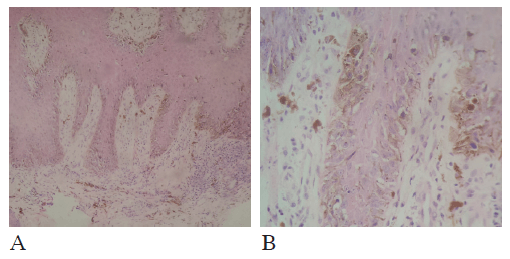
 Figura 2. En los cortes de piel se aprecia epidermis con hiperplasia seudoepiteliomatosa.
Figura 2. En los cortes de piel se aprecia epidermis con hiperplasia seudoepiteliomatosa.
En la capa basal se identifica una proliferación continua de melanocitos con atipia nuclear, nucléolo y ocasionales mitosis.
En la dermis papilar hay incontinencia de pigmento. Hematoxilina y eosina, 10X y 40X.
En casos de difícil diagnóstico, se recomiendan los estudios de inmunohistoquímica (hmb-45, proteína s-100, melan A, enolasa neurona específica, etc.) o el de reacción en cadena de polimerasa (PCR) para establecer la expresión de moléculas como CDK4, CDKN2A, CCND1, KIT, TP53, RAC1 Y MITF. De esta forma, se hace un diagnóstico histológico más preciso y se determinan las células iniciadoras del melanoma, que conforman una subpoblación de crecimiento lento pero con un gran poder neoplásico in vivo; además, estas expresan algunos marcadores como CD20, CD133, CD24, CD271, o el transportador ABC. Las células iniciadoras del melanoma han demostrado ser las responsables de la alta recidiva de este tipo de tumores, ya que generan el denominado efecto de campo, debido a la presencia de alteraciones moleculares similares a las observadas en el tumor que se ubican adyacentes a la lesión e, incluso, a más de un cm de distancia del borde de resección libre de tumor. Además, estas células son capaces de disminuir la concentración de los antineoplásicos intracelulares, aumentado la producción de bombas de flujo de salida (ABCB5), y pueden evitar el sistema inmunitario mediante simulación al no expresar o enmascarar el antígeno MART 1, tal cual como lo explican Bastian y Berlotto 31-33.
Estadificación
La estadificación del melanoma maligno se hace con base en la clasificación TNM (Tabla 1) propuesta por el American Joint Committee on Cancer (AJCC Cancer Staging Manual), en los siguientes estadios 34, 35:
Tabla 1.
Clasificación TNM El American Joint Committee on Cancer ha designado
los estadios del melanoma mediante la clasificación TNM.
Tumor primario (T)a
|
TX |
No se puede evaluar el tumor primario (por ejemplo, melanoma que se ha sometido a legrado o melanoma con acentuada regresión). | ||
| T0 | No hay prueba de un tumor primario. | ||
| Tis | Melanoma in situ | ||
| T1 | Melanomas ≤1,0 mm de grosor | ||
| T2 | Melanomas de 1,01 a 2,0 mm | ||
| T3 | Melanomas de 2,01 a 4,0 mm | ||
| T4 | Melanomas >4,0 mm | ||
| Nota: las subcategorías a y b de T se asignan con base en la ulceración y el número de mitosis por mm2, como se muestra a continuación. | |||
| Clasificación T | Grosor (mm) | Estado de ulceración/ mitosis | |
| T1 | ≤1,0 | a: sin ulceración ni mitosis (<1/mm2) | |
| b: con ulceración o mitosis (≥1/mm2) | |||
| T2 | 1,01 a 2,0 | a: sin ulceración | |
| b: con ulceración | |||
| T3 | 2,01 a 4,0 | a: sin ulceración | |
| b: con ulceración | |||
| T4 | >4,0 | a: sin ulceración | |
| b: con ulceración | |||
Tratamiento
Aunque el melanoma se presenta en la superficie de la piel, donde teóricamente debería ser fácilmente diagnosticado y tratado, esto no es así. Su tratamiento es complicado por la naturaleza agresiva del tumor y su impredecible patrón metastásico, lo cual lo hace más letal que otros tumores de patrón sólido. Por lo anterior, el tratamiento del melanoma es fundamentalmente quirúrgico, tanto de la lesión primaria, como del territorio ganglionar de drenaje si se encuentra comprometido por el tumor 5, 6, 20.
| N2 | 2 a 3 | a: micrometástasisb |
| b: macrometástasisc | ||
| c: metástasis en tránsito/satélites sin ganglios metastásicos | ||
| N3 | ≥4 ganglios metastásicos o ganglios apelmazados o metástasis en tránsito o satélites con ganglios metastásicos | |
LDH= lactato deshidrogenasa
a Reproducido con permiso del American Joint Committee on Cancer: Melanoma of the skin. En: Edge SB, Byrd DR, Compton CC, et al., editors.: AJCC Cancer Staging Manual. 7th edition. New York, NY: Springer; 2010. p. 325-44.
b Las micrometástasis se diagnostican después de una biopsia de ganglio linfático centinela y de haberse completado la linfadenectomía (si es que se llevó a cabo).
c Las macrometástasis se definen como consideran metástasis ganglionares, clínicamente detectables y que han sido confirmadas mediante linfadenectomía terapéutica o cuando la metástasis ganglionar exhibe una extensión extracapsular macrocítica.
Lesión primaria
El tratamiento del melanoma acral lentiginoso es particularmente desafiante debido a la dificultad para obtener los márgenes adecuados y al déficit funcional que se puede originar en la ampliación. Dichas áreas tienen de dos a cinco veces más recurrencia en comparación con otras áreas, debido a los pequeños márgenes utilizados. Históricamente, el manejo de elección del melanoma subungular fue, sin ninguna duda, la amputación del dedo afectado; sin embargo, en los últimos años, se están empleando técnicas más conservadoras que permiten obtener márgenes amplios sin necesidad de amputaciones y sin alterar el pronóstico en comparación con la cirugía radical. En una pequeña serie de casos realizado en 1997, Tseng observó que, cuando el grosor de Breslow era menor de 1,5 mm, el melanoma subungular tenía una menor tasa de metástasis ganglionar, por lo cual sugirió que estaría indicada la escisión local amplia con márgenes de un cm. La cirugía micrográfica de Mohs se considera el tratamiento de elección para el melanoma acral lentiginoso, ya que permite extirpar la lesión completa y preservar la mayor cantidad posible de tejido sano. Sin embargo, tiene la limitación de que, en nuestro medio, son pocos los centros que puedan ofrecer dicha técnica quirúrgica, además del costo requerido 36.
La amplitud de la resección depende del espesor invadido por el melanoma. Para melanomas in situ, se recomienda un margen de resección de 0,5 cm; para los menores de 1,0 mm, uno de 1 cm; para los de 1,01 a 2 mm, uno de 1 a 2 cm; para los de 2,01 a 4 mm, uno de 2 cm; y para los mayores de 4 mm, uno de 2 cm. Estos criterios son también válidos para los melanomas pal¬mares y plantares 37.
El margen quirúrgico puede modificarse según la localización anatómica, por ejemplo, en el rostro. Debe tenerse en cuenta que la resección de la lesión tumoral puede implicar otros procedimientos quirúrgicos, como la amputación, según la localización y la magnitud de la lesión. Si los márgenes de resección son positivos, se debe reintervenir al paciente 36, 37.


