Reanimación del Paciente Traumatizado y Quirúrgico Mayor
García A., MSCC*
Palabras clave: trauma, reanimación, shock, hipovolemia, transporte de oxígeno, deuda de oxígeno, metabolismo anaerobio, catéter de arteria pulmonar, precarga, inostrópicos, acidosis metabólica, tonometría gástrica.
Introducción
La reanimación hemodinámica y metabólica de los pacientes que han sufrido una injuria traumática o quirúrgica mayor, tiene elementos característicos que permiten hacer un enfoque unificado. En torno a ella, se presentan controversias que ameritan ser discutidas y algunas concepciones equivocadas, que justifican ser aclaradas.
Se presentan brevemente los principales cambios fisiopatológicos que motivan las intervenciones terapéuticas. En cuanto a éstas se recurre al mejor nivel de evidencia disponible en la literatura, para definir su utilidad (1).
Se plantean conductas diagnósticas y terapéuticas que permiten enfrentar los pacientes en los diversos escenarios donde se presentan: urgencias, quirófano y las salas de cuidado postquirúrgico, hospitalización y cuidado intensivo.
Definición de Trauma y Cirugía Mayor
1. Cirugía de alto riesgo
La presencia de alguna de las siguientes características en el preoperatorio de un paciente que va a ser sometido a un procedimiento quirúrgico se asocia con una probabilidad de morir de 30% (2):
a. Edad >70 años y evidencia de limitación de la reserva de un sistema.
b. Enfermedad cardiorrespiratoria previa (IAM, EPOC, ACV).
c. Enfermedad vascular terminal que incluye la aorta.
d. Insuficiencia respiratoria: PaO2 0.4, QS/QT >30%, necesidad de ventilación mecánica por más de 48 h.
e. Insuficiencia renal aguda: creatinina >3 mg/dL, BUN > 50 mg/dL.
f. Insuficiencia hepática: bilirrubina total > 5 mg/dL, elevación de las enzimas hepáticas.
g. Problemas nutricionales severos.
h. Catástrofe abdominal aguda con inestabilidad hemodinámica.
i. Sepsis.
j. Cirugía ablativa extensa planeada para carcinoma, p. ej. esofagogastrectomía; cirugía prolongada (>8 h).
2. Trauma mayor (3, 4).
a. Intervención quirúrgica indicada por shock hipovolémico.
b. Apertura de dos cavidades.
c. Transfusión de cuatro o más unidades en el primer día.
d. Infusión de 6 ó más L durante la cirugía o 10 ó más en las primeras 24 horas.
e. ISS >24 ó ATI >24.
Bases Fisiopatológicas
1. La esencia del shock
El shock fue considerado durante mucho tiempo como un problema de presiones intravasculares; posteriormente como una desproporción entre el continente del espacio vascular y el volumen contenido.
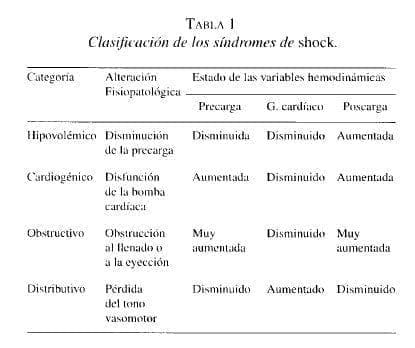
En los últimos 20 años se ha establecido que el trastorno consiste en insuficiente perfusión tisular, ocasionada por hipovolemia absoluta o relativa, insuficiencia de la bomba cardíaca, obstrucción a la entrada o la salida de la bomba, o pérdida del tono vascular con o sin demanda metabólica excesiva por parte de los tejidos que lleva a disfunción celular, que varía en intensidad de acuerdo con la duración y la severidad de la hipoperfusión (5, 6).
Es importante señalar que a menudo coexisten componentes de varias categorías en un paciente. Por ejemplo, el shock hipovolémico puede ocasionar depresión miocárdica y alteraciones microcirculatorias (7); en el shock séptico puede existir un componente de hipovolemia secundario a vasodilatación venosa, además de depresión miocárdica (8, 9); en el shock cardiogénico frecuentemente coexiste hipovolemia (10).
El oxígeno requerido para la realización de los procesos metabólicos debe ser suministrado de manera continua, ya que el organismo no dispone de un sistema que lo almacene (11). Independiente de la alteración fisiopatológica que haya ocasionado el shock, la alteración central consiste en que las células reciben un insuficiente flujo de sangre oxigenada, lo que las obliga a obtener energía a través del metabolismo anaeróbico, mediante el cual se obtiene una menor cantidad de moléculas de alta energía por medio del proceso aeróbico (12). La reducción de la producción de moléculas de alta energía conduce a: corto plazo a disfunción celular, disfunción orgánica transitoria y producción de mediadores de la inflamación que pueden compensarse o autolimitarse, si el shock tiene profundidad y duración limitados. Sin embargo, pueden conducir a insuficiencia orgánica primaria, actividad inflamatoria persistente con disfunción orgánica tardía, o aún a la refractariedad del shock, si éste es muy profundo o duradero (13,14,15).
En situaciones de trauma o estrés quirúrgico, se ha establecido que la probabilidad de falla orgánica múltiple o de muerte, es proporcional a la severidad del insulto hipóxico, medido como deuda de oxígeno (16) (cantidad de oxígeno que debió ser consumida y no lo fue, como consecuencia de la hipoperfusión), acidosis láctica (17, 18), acidosis metabólica medida como exceso de base (EB) (19) o hidrogeniones metabólicos (HM) (20, 21), fracaso en alcanzar unos valores supranormales de índice cardíaco, (IC), entrega de oxígeno (IDO2) y consumo de oxígeno (IVO2) (22-25), y persistencia de hipoperfusión visceral, puesta en evidencia por la persistencia de la acidosis de la mucosa gástrica, independiente de la calidad aparente de la reanimación (26-32). En consecuencia, la adecuada reanimación de un individuo en shock, debe contemplar la reversión de las manifestaciones de metabolismo anaeróbico, sistémicas o regionales.
2. Eventos fisiopatológicos en el shock y el trauma
• La hipovolemia ocasiona una disminución de la precarga, la cual se manifiesta con colapso de las venas yugulares y disminución de las presiones de llenado, y produce una reducción del gasto cardíaco.
• La reducción del gasto cardíaco produce las alteraciones fisiopatológicas y algunas de las manifestaciones clínicas del shock: disminución de la entrega de O2, hipotensión, lentificación del llenado capilar y disfunción orgánica aguda: oliguria y alteraciones neurológicas, por ejemplo.
• La hipotensión, la hipoperfusión, el estímulo de los nociceptores y la liberación de mediadores como consecuencia del daño isquémico y de la destrucción física de los tejidos, en el shock y el trauma, producen señales que son integradas en el hipotálamo, donde se genera la respuesta neurohormonal, que incluye la liberación de catecolaminas, glucocorticoides, glucagón e insulina, responsables de la respuesta cardiovascular y metabólica del shock hipovolémico y el trauma (33-34).
Respuesta cardiovascular: incluye taquicardia, aumento de la fuerza y la velocidad de contracción del miocardio y vasoconstricción del lecho esplácnico. Estos cambios, junto con el aumento de la extracción tisular de oxígeno y el fenómeno de repleción transcapilar, pueden ser suficientes para compensar el cuadro, en hipovolemias menores de 30%, pero fracasan en mantener la estabilidad hemodinámica y preservar la oxigenación tisular en hipovolemias de 30% o más, casos en los que aparecen signos clínicos claros de shock, acompañados de hipoperfusión severa (35).
Una vez que la hipovolemia ha sido corregida, persiste la estimulación cardíaca por catecolaminas, a lo que se agrega vasodilatación periférica, secundaria a fenómenos vasomotores locales, por lo que el patrón hemodinámico de hipovolemia es remplazado por uno de hiperdinamia
Respuesta metabólica: incluye glucogenólisis, lipólisis, proteolisis y gluconeogénesis, a partir de los aminoácidos movilizados, principalmente del músculo. Como parte de esta respuesta se presenta hipermetabolismo, con mayor requerimiento tisular de oxígeno.
Aunque su duración, después de injurias moderadas, es de horas o pocos días, puede persistir durante semanas en lesiones severas.
Durante la fase inicial de la hipovolemia, previa a la reanimación, la actividad metabólica se encuentra reducida, como consecuencia de la disminución de la entrega y el consumo de oxígeno, con predominio de la actividad de catecolaminas, (fase “Ebb”). Posterior a la reanimación, se hace manifiesta la actividad de las restantes hormonas contrarreguladoras y aparecen la hiperdinamia y el hipemetabolismo (fase “Flow”) (37-38).
• La isquemia, seguida por la reperfusión durante la reanimación, somete a las células endoteliales a un insulto hipóxico, al cual le sigue el daño producido por las especies reactivas de oxígeno, que se producen durante la reperfusión (39). Si las células sobreviven, son sometidas a una respuesta inflamatoria aguda ocasionada por la liberación de mediadores inflamatorios por parte de los neutrófilos y los macrófagos. Esta serie de insultos hace que el endotelio se torne protrombótico (40), lo cual facilita la microtrombosis; incremente su permeabilidad, permitiendo el edema intersticial; pierda su capacidad de regulación del tono microvascular (41-42) y se comporte como “quimioatrayente”, fenómeno que permite la atracción, adhesión y migración leucocitaria (43-45). La disfunción endotelial perpetúa la actividad inflamatoria y perturba el flujo sanguíneo en la microcirculación.
• Desde el punto de vista de los compartimentos corporales ocurren unos cambios característicos, que permiten dividir el shock en tres fases secuenciales: fase I, de pérdida de volumen, fase II, de acumulación intersticial de líquidos y fase III, de redistribución (46-47).
Fase I. Inicia con el evento que produce la hemorragia y termina con el evento que la controla.
Durante esta fase, el volumen intravascular se encuentra contraído; el volumen intracelular puede aumentar, por edema celular (48) secundario a la disfunción de las bombas de membrana (49) y el espacio intersticial se contrae, gracias a que cede líquido a los compartimentos intracelular y vascular (50).
Fase II. Empieza cuando se obtiene el control de la hemorragia y termina en el momento de máxima ganancia de volumen intersticial.
Durante esta fase, el balance de líquidos, que resulta de restar los egresos de los ingresos, es positivo, debido a la expansión del espacio intersticial (52-53), la cual tiene una duración y magnitud proporcionales a la severidad del trauma y de la hipovolemia (54), y ocurre de manera obligatoria, aún a expensas de la contracción del volumen intravascular. El espacio intracelular sufre también expansión durante esta fase, por lo anteriormente explicado.
La retención de líquidos ocasiona edema periférico, ganancia de peso y no se asocia con aumento del agua pulmonar extravascular (55).
Esta fase dura entre uno y cuatro días y durante su tratamiento se requiere administrar un volumen de líquidos superior al usual, para mantener la normovolemia y permitir la expansión intersticial.
Al final de esta fase el balance de líquidos es gradualmente menos positivo y finalmente se hace neutro.
Fase III. Redistribución. Inicia en el momento de mayor ganancia de peso y termina cuando el paciente llega a su peso más bajo.
La transición entre las fases II y III es espontánea y ocurre cuando el intersticio comienza a contraerse, después de alcanzar su máxima expansión, transfiriendo agua, proteínas y electrolitos al espacio intravascular (50). Este fenómeno produce un estado transitorio de hipervolemia, que se manifiesta con hipertensión en el 25% de los casos provoca edema pulmonar por aumento de presiones hidrostáticas en una proporción mucho menor (46).
El balance de líquidos durante esta fase es negativo y el tratamiento consiste, en la mayoría de los casos, en restricción del suministro de fluidos y sólo ocasionalmente en la administración de diuréticos. La duración y la intensidad de esta fase varían de acuerdo con la magnitud de la acumulación de líquidos en el intersticio.
Reanimación
Durante el tratamiento de un paciente que ha recibido un traumatismo mayor, ha sido sometido a una cirugía mayor o presenta shock hipovolémico, se deben abordar sistemáti-camente los siguientes principios: control de la hemorragia, corrección de la hipovolemia y corrección de la alteración del transporte de oxígeno.
1. Control de la hemorragia
Este principio debe considerarse como parte esencial de la reanimación, que puede o no requerir un procedimiento quirúrgico. Retrasar el control de la hemorragia, con la pretensión de corregir la hipovolemia, sin controlar la fuente de la pérdida de volumen intravascular, no tiene sentido y puede empeorar el pronóstico del paciente (35, 56).
2. Evaluación de la hipovolemia
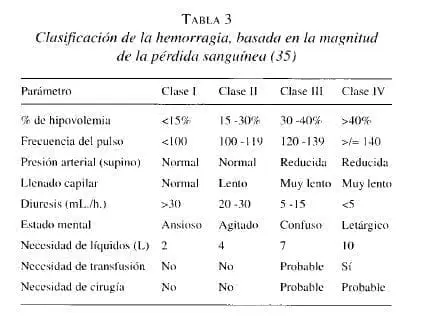
La evaluación de la pérdida sanguínea puede hacerse por medio de la cuantificación del volumen perdido sólo en casos poco frecuentes. En la mayoría de las situaciones la magnitud de la hipovolemia debe ser estimada a partir de las manifestaciones clínicas del shock (tabla 3).
La medición periódica de la diuresis permite obtener una aproximación del estado de perfusión renal. La oliguria suele indicar hipovolemia, en tanto que la ausencia de oliguria no implica que el gasto cardíaco sea suficiente para perfundir satisfactoriamente todos los tejidos de la economía.
La medición frecuente o el registro continuo de la presión venosa central (PVC) permite obtener una aproximación del estado de la precarga:un valor inferior a 15 mmHg, en el individuo que está siendo sometido a un proceso de reanimación, puede ser interpretado como que el continente vascular permite aún la infusión de líquidos endovenosos.
La monitoría invasiva de la presión arterial sistémica y mediante catéter de arteria pulmonar durante el tratamiento inicial y la estabilización, aporta información complementaria limitada. Esta información, resulta particularmente útil para establecer el diagnóstico en situaciones complejas y para seguir la tendencia de las variables, en la medida que discurre la reanimación (57).
3. Corrección de la hipovolemia
a. Accesos vasculares: la reanimación de un sujeto en shock hipovolémico exige la administración de grandes cantidades de líquidos en períodos breves. Es conveniente recordar que el flujo de los líquidos es limitado por el diámetro y la longitud del catéter, (la resistencia es inversamente proporcional a la cuarta potencia del diámetro y directamente proporcional a la longitud). Por esta razón los catéteres venosos centrales de calibre 16 ó 18, disponibles regularmente, no resultan apropiados para la administración de grandes volúmenes.
El acceso apropiado para este efecto consiste en la canalización de dos o tres venas de los miembros superiores con agujas cortas, de grueso calibre (14 ó 16).
También se considera apropiado el uso de grandes catéteres (8 Fr) colocados percutáneamente con técnica Sendinger, en las venas centrales o en las femorales. Estas últimas no se colapsan a pesar de la hipovolemia, están libres del riesgo de neumotórax y pueden ser accedidas sin interferir con las maniobras de tratamiento de la vía aérea (58).
La disección de la vena safena interna o las venas antecubitales, con un catéter de grueso calibre, es un recurso salvador, cuando no se dispone de los materiales o el entrenamiento para hacer la canalización percutánea, o cuando los intentos de hacerlo son fallidos.
b. Selección de los líquidos: la reanimación con soluciones coloides permite una expansión más efectiva del volumen intravascular, con una recuperación más rápida y duradera del gasto cardíaco y la presión arterial (59). Por otra parte, favorece la acumulación de proteínas en intersticio, (factores de coagulación, albúmina y globulinas), lo cual puede tener efectos adversos (60-61); adicionalmente, disminuye la filtración glomerular y se asocia con un incremento de la duración de la ventilación mecánica en los individuos que la requieren (62).
La reanimación con soluciones electrolíticas balanceadas, provee un método más económico de expansión del volumen extracelular, ha demostrado iguales resultados que los coloides en la mayoría de los estudios comparativos y en el análisis agrupado de estos estudios, se asoció con una menor mortalidad, particularmente en los pacientes con shock establecido (63-66). La elección, por lo tanto, favorece a los cristaloides isotónicos, en la mayoría de situaciones.
Las soluciones hipertónicas poseen una serie de ventajas potenciales. Su uso en víctimas de shock hipovolémico, sin embargo, no se ha reflejado en una menor mortalidad y puede producir complicaciones (67).
La transfusión de sangre completa no tiene papel en la terapia moderna del shock hemorrágico. La expansión del volumen circulante se consigue satisfactoriamente con el uso de soluciones electrolíticas balanceadas y es la primera prioridad del tratamiento.
El uso de glóbulos rojos empaquetados (GRE) está claramente indicado en las hemorragias clase IV, escenario en el cual deben administrarse sin pruebas cruzadas.
En hemorragias menores de 30% no suele haber indicación de transfusión y en las hemorragias clase III la indicación se define de manera individualizada, de acuerdo frecuentemente con el análisis del estado de transporte de oxígeno (35).
La administración de plasma, plaquetas y crioprecipitado está indicada en los pacientes que desarrollan coagulopatía (68-69), en quienes la terapia debe guiarse idealmente por las pruebas de laboratorio, tomando como objetivo la corrección de la alteración clínica y no la normalización de las pruebas de laboratorio. El uso profiláctico de estos productos no ha reducido en riesgo de aparición de coagulopatía (70-71) y conlleva los problemas inherentes a las transfusiones: hipervolemia, diferentes tipos de reacción y transmisión potencial de infecciones (72), además que consume innecesariamente un recurso finito y eleva los costos de la reanimación. La transfusión de plasma como expansor plasmático, es una medida proscrita, por lo ya mencionado..
c. El volumen de líquidos
No existe ninguna fórmula que permita establecer con anticipación en volumen qué se va a requerir durante la reanimación. Éste puede ser estimado empíricamente, de acuerdo con las manifestaciones clínicas al ingreso (tabla 3). La velocidad de infusión durante el mantenimiento, se determina de acuerdo con la respuesta (tabla 4).
El paciente que exhibe manifestaciones claras, presenta una hipovolemia de más de 30% y requiere la administración de LEV a chorro y sólo en la medida que la presión arterial y la frecuencia cardíaca tiendan a normalizarse, la velocidad de infusión se reduce gradualmente.
La monitoría de la diuresis proporciona una idea preliminar acerca de la corrección adecuada del volumen intravascular. El nivel de PVC permite saber si el continente vascular permite aún la administración de una cantidad adicional de fluidos, en los casos en los que los parámetros de repleción intravascular no sean satisfactorios.
El volumen empleado para mantener adecuadamente expandido el espacio intravascular, puede parecer excesivo durante la fase II y escaso durante la fase III. El tratamiento cuidadoso dirigido a mantener la normovolemia durante la fase de acumulación de líquidos y la atención permanente al balance de líquidos para identificar la transición a la fase de redistribución, permitirán efectuar un tratamiento adecuado (35).
La decisión inicial de transfundir GRE se basa en la estimación empírica de la hipovolemia, basada en los signos clínicos. El hematocrito inicial no refleja la magnitud de la pérdida sanguínea; sin embargo, en la medida en que el volumen intravascular se recupera, nuevas evaluaciones permiten obtener información acerca de la necesidad de transfusión. Niveles de hemoglobina inferiores a 6 gm/dL son claramente perjudiciales y son indicación de transfusión; valores entre 6 gm/dL y 8 gm/dL casi siempre son indicación de administrar GRE y la transfusión se decide individualmente en pacientes con niveles superiores a 8 gm/dL (73).
4. Evaluación del transporte de oxígeno
La alteración central del shock es la insuficiencia de la entrega de oxígeno a los tejidos, que lleva a una disminución crítica de la producción de energía. El tratamiento y la evaluación de la respuesta deben ir dirigidos en este sentido.
El cumplimiento satisfactorio de los parámetros de repleción del volumen intravascular no garantiza que la entrega de oxígeno sea adecuada (74). Este aspecto debe ser evaluado específicamente en los pacientes con hipovolemia clase III y clase IV y en los pacientes traumatizados o quirúrgicos mayores.
a. Evaluación básica: en el contexto del shock hipovolémico y el estado postraumático, la acidosis metabólica, que puede ser caracterizada por la medición del ácido láctico, el cálculo del exceso de base (EB), o el cálculo de los hidrogeniones metabólicos (HM), identifica los sujetos que están sufriendo hipoperfusión tisular, a pesar de estar aparentemente compensados (75). El EB ha sido correlacio-nado en modelos experimentales con la magnitud de la deuda de oxígeno (76) y la severidad de la acidosis metabólica se ha relacionado con la probabilidad de morir y con el riesgo de SDOM (4, 20, 21). Por otra parte, solamente en los sujetos en shock que presenta acidosis metabólica, es posible obtener aumento del consumo de oxígeno, como consecuencia del aumento de la entrega.
Un nivel de HM >1ONmo11Lo un exceso de base <-8mEq/L identifican los pacientes con hipoperfusión, a riesgo de SDOM (4, 20, 21). De igual manera la acidosis metabólica persistente, a pesar de ausencia de criterios de hipovolemia identifica a los pacientes con deuda de oxígeno en curso.
b. Evaluación avanzada: se consigue a través de la determinación global de la entrega y el consumo de oxígeno y mediante el análisis de la perfusión regional, de algunos territorios críticos.
• Evaluación de la perfusión global: requiere el conocimiento del gasto cardíaco y la composición de la sangre arterial y venosa mixta. Abarca el cálculo de la entrega y el consumo de oxígeno, y las variaciones que se presentan en el segundo, como consecuencia de las modificaciones que se hagan sobre el primero.
Cálculo de las variables para el análisis global del transporte de oxígeno.
| Hb Sata Pa02 Satv PvO, SC GC CaO, Cv02 lC IDO, lV02 |
Concentración de hemoglobina (gm/dL). Saturación de la hemoglobina arterial. Presión arterial de oxígeno. Saturación de la hemoglobina venosa. Presión venosa de oxígeno. Superficie corporal. Gasto cardíaco. Contenido arterial de oxígeno. Contenido venoso de oxígeno. Índice cardíaco. Índice de entrega de oxígeno. Índice de consumo de oxígeno. |
Cálculo de las variables para el análisis global del transporte de oxígeno.
| Ca02= CvO= IC = 10°2= IVO, |
(0.0031 x Pa02)+(l.34xHbxSata 0/100). (0.003 Ix Pv02)+( 1.34xHbxSatv 0/100). GC/SC. Ca02xlCx IO. (Ca02 -CvO) xlCxlO. |
Se ha identificado que los pacientes traumatizados o postquirúrgicos mayores que alcanzan ciertos niveles de estas variables, dentro de las primeras 24 horas después de la injuria, tienen un riesgo menor de SDOM y de muerte (24, 25). De igual manera se ha identificado en este grupo de pacientes que quienes no llegan a un IVO2 esperado, y experimentan en consecuencia, deuda de oxígeno, tienen riesgo de estas complicaciones, el cual es proporcional a la magnitud de la deuda (77).
Se ha propuesto que la reanimación de este grupo de pacientes se dirija al cumplimiento de estos valores supranormales, lo cual en algunos estudios aleatorizados ha disminuido la incidencia de SDOM y la mortalidad (16, 24, 25). Otros autores han fracasado en comprobar esta aseveración (78). La agrupación de los resultados de los estudios disponibles orienta a la conclusión de que justamente los pacientes traumatizados o los sometidos a cirugía mayor, tienen mejor probabilidad de beneficiarse de estas medidas (57, 79).
Este enfoque tiene la desventaja de que se fundamenta en determinaciones de la oxigenación tisular global, que no permite evaluar la persistencia de hipoperfusión en algunos territorios y que desconoce además la variación individual de los pacientes.
Debe ser complementado, por lo tanto, por las variables que identifican el metabolismo anaeróbico e idealmente por el análisis de la perfusión regional de algunos territorios críticos.
• Evaluación de la oxigenación regional
El método mejor estudiado es la tonometría gástrica, el cual se fundamenta en el hecho de que la perfusión del lecho
esplácnico se compromete tempranamente en el shock hipovolémico, el trauma y la sepsis, es la última que se recupera y puede
* Algunos pacientes presentan acidosis metabólica con brecha aniónica estrecha, presumiblemente de origen no láctico, la cual es refractaria al aumento de la entrega de oxígeno. En estos casos no es adecuado perseguir aumentos de la DO2. Lo procedente es investigar la causa de pérdida o falta de generación de bicarbonato y manejar la acidosis como tal.
persistir después de la normalización de los signos vitales. Este fenómeno se refleja en deuda de oxígeno, metabolismo anaeróbico, con acidosis local y ha sido relacionado con SDOM y mayor morbimortalidad (26-32).
La PCO2 del líquido gástrico es igual al de las células de la mucosa gástrica, debido a la rápida difusión de este gas. El tonómetro consiste en una sonda nasogástrica con un balón en la punta, construido con silicona, material que es permeable al CO2. Después de insertarlo, el balón se llena con 2.5 c.c. de NaCl, la cual se deja durante al menos 30 minutos, para dar lugar a la difusión del CO2 hasta el equilibrio. El análisis de la PCO2 del líquido recuperado del balón, permite conocer la PCO2 del líquido y de la mucosa gástricos y calcular indirectamente el PH de las células gástricas, según la ecuación de Henderson-Hasselbach, empleando el valor del HCO3-arterial, así (31):
Phi=6.1 + log10 (HCO3-arterial/ PCO2 de la NaCl x 0.03)
A pesar de la controversia que genera el método, debido al uso del HCO3-arterial y a la posible interferencia por el uso de bloqueadores H2, y por otros trastornos ácido-básicos, la tonometría gástrica parece identificar adecuadamente los pacientes con hipoperfusión esplácnica. En efecto, los estudios que evalúan el método en la clínica han demostrado que los pacientes con un PHi < 7.35 tienen un riesgo mayor de SDOM y muerte. La corrección de la acidosis de la mucosa gástrica mediante la infusión de líquidos o dobutamina, parece disminuir el riesgo (32, 80). Sin embargo, la respuesta a las manipulaciones terapéuticas no es consistente, de modo que el acceso debe ser individualizado, de acuerdo con las características y la respuesta de cada caso.
La aplicación clínica de otros métodos de análisis de la oxigenación regional, tales como la oximetría subcutánea, está aún por definirse (81).
5. Corrección de la alteración del transporte de oxígeno
El propósito central de la reanimación es revertir a la menor brevedad la perfusión tisular insuficiente y, por ende, la deuda de oxígeno. Se apoya en el reconocimiento de la hipoperfusión mediante marcadores globales del metabolismo anaeróbico, (acidosis metabólica), o a través de marcadores regionales, (acidosis de la mucosa gástrica), y en la manipulación de la entrega de oxígeno, con el fin de mejorar el consumo.
Durante la primera hora de la reanimación debe conseguirse una presión de perfusión adecuada y durante las primeras seis horas debe obtenerse una tendencia a la disminución de la acidosis metabólica, con reducción a la mitad en las primeras 12 horas y corrección completa antes de 24 horas.
a. Optimización del transporte de oxígeno, orientado con monitoría básica:
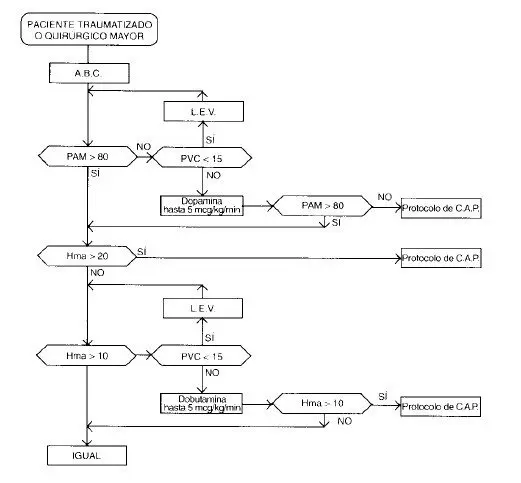
• Obtención de una presión de perfusión mínima. Se considera adecuado en la mayoría de situaciones una presión arterial media (PAM) de 80 mmHg o mayor.
Si la PAM es <80 mmHg, se recurre a la administración de LEV, hasta satisfacer este objetivo, o hasta que
la PVC llegue a 18 mmHg. En este punto, se justifica el uso de dopamina, hasta 5 mcg/kg/min.
Cuando la PAM no alcanza los 80 mmHg, a pesar de la repleción del volumen intravascular y el inotrópico, a dosis baja, está indicado el uso de monitoría con catéter de arteria pulmonar, para guiar la reanimación.
- Evaluación de la acidosis metabólica: el EB 10, se consideran indicadores de hipoperfusión. En estas circunstancias es conveniente optimizar la entrega de oxígeno. Para ese efecto debe recordarse las variables de las cuales depende:
DO2 = CaO2xGCx10
Determinantes del CaO2:
PaO2
Sata
Hb
Determinantes del GC:
FC
Precarga
Postcarga
Contractilidad
De las variables que determinan el CaO2, la PaO2 aporta muy poco al contenido arterial de oxígeno, por lo que no se justifica concentrarse en modificarla. La Sata debe mantenerse en un nivel >90% y la Hb entre 8 y 10 gm./dL.
Es más efectivo, para el propósito de incrementar la entrega de oxígeno, modificar el gasto cardíaco. La frecuencia cardíaca y la postcarga, no suelen ser el problema en los pacientes traumatizados o postquirúrgicos jóvenes, por lo que los esfuerzos deben dirigirse en aumentar la precarga lo máximo que sea posible. Para ello, se administran líquidos endovenosos, aumentando la rata de infusión cuanto sea necesario, para producir un incremento gradual de la PVC, midiendo frecuentemente los gases arteriales, con el fin de identificar el nivel en el cual la acidosis metabólica empieza a reducirse. Si esto no se produce al llegar a 18 mmHg, está indicada la administración de dobutamina a 5 mcg/kg/min. En caso de que esto no inicie la reversión de la acidosis está indicado el uso de catéter de arteria pulmonar.
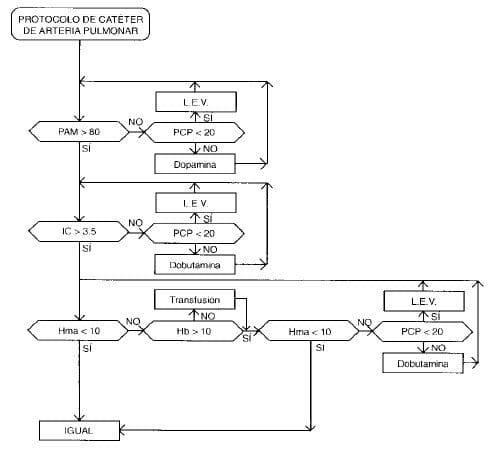
b. Optimización del transporte de oxígeno, orientado con monitoría con catéter de arteria pulmonar: (véase flujograma)
Los objetivos que se buscan son los siguientes:
• Obtención de una presión de perfusión mínima.
• Corrección de la acidosis metabólica.
Se emplean las siguientes estrategias:
• Repleción del volumen intravascular: se administran LEV, a una rata de infusión, que induzca la elevación gradual la PCP. Se compara con el aumento del GC que se produce, de modo que pueda identificarse un valor de precarga a partir del cual el incremento de la PCP no se refleja en aumento del GC. El último nivel de precarga que se asoció con aumento del GC se le llama PCP ideal.
La velocidad de administración de los LEV se reduce para mantener un nivel de PCP estable cuando:
Se alcance la “PCP óptima”.
Se llegue a 20 mmHg de PCP, registrándose aún aumentos del gasto cardíaco.
Se cumpla el objetivo de corrección de la hipoperfusión (reducción del nivel de acidosis metabólica).
Administración de inotrópicos: se infunden catecola-minas cuando no se obtiene corrección de la acidosis, a pesar de satisfacer el criterio de repleción intravascular*.
La elección de la catecolamina favorece a la dobutamina (82-83), pues es la que mejor efecto parece tener sobre la distribución de la microcirculación y el consumo de oxígeno. Sin embargo, cuando el paciente está hipotenso, está indicado el uso de inotrópicos con efecto vasoconstrictor, de los cuales la dopamina es el que se recomienda usualmente.
Otras medidas: el empleo de diuréticos sólo está justificado cuando el paciente muestra hipervolemia.
Los vasodilatadores están indicados en los pacientes que tienen aumento de la postcarga, como causa del gasto cardíaco insuficiente. No se deben incluir erróneamente dentro de este grupo a los sujetos que aún se encuentran hipovolémicos, quienes exhiben postcargas aumentadas, pero que todavía muestran la precarga baja.
6. Otras consideraciones en la reanimación del paciente traumatizado y quirúrgico mayor.
a. Hipotermia: esta complicación ocurre frecuentemente en pacientes traumatizados y quirúrgicos mayores. Ha sido reportada en el 20% al 50% de los traumatizados graves (84-85).
La predisposición está dada por disminución de la actividad metabólica que ocurre como consecuencia del choque hipovolémico, administración de líquidos y componentes sanguíneos fríos, y exposición de la superficie cutánea y de las cavidades. Adicionalmente, la anestesia puede ocasionar disminución del umbral de ter-morregulación, vasodilatación y reducción de la actividad muscular
La hipotermia afecta el funcionamiento de varios sistemas (86-88). Desde el punto de vista cardiovascular, produce bradicardia y arritmias. En el sistema hematológico, produce alteraciones plaquetarias consistentes en secuestro en el hígado y el bazo, que pueden reducir hasta en 30% los niveles; alteraciones morfológicas; disminución de la agregabilidad y alteraciones de la producción de tromboxano; produce también alteración en la actividad de los factores de coagulación, explicada principalmente por disminución de la cinética de tales factores. Se considera que semejante alteración de la función enzimática puede ocasionar alteraciones de la coagulación, equivalentes a una profunda deficiencia de los factores de coagulación. Deprime también el sistema nervioso central; produce fasciculaciones; empeora la capacidad renal de concentración, provocando poliuria, que no guarda relación con una perfusión adecuada e induce inmunosupresión. La hipotermia se asocia con una probabilidad mayor de morir, en grupos estratificados por presencia de choque, severidad del trauma y cantidad de sangre transfundida.
Las siguientes son las medidas que se recomiendan para su prevención:
Mantener la temperatura ambiental por arriba de 21°C.
Evitar la exposición innecesaria de la piel.
Administrar LEV y sangre a temperaturas alrededor de 40oC.
Administrar gases anestésicos y del ventilador humidificados y calientes.
Evitar las medicaciones vasodilatadoras.
Evitar la exposición innecesaria de las cavidades corporales y las vísceras.
Reducir el tiempo quirúrgico a lo indispensable.
Los resultados publicados por algunos autores sugieren que la aplicación de medidas activas para el reca-lentamiento de los pacientes traumatizados hipotérmicos, se asocia con mejor pronóstico (89). En cirugías electivas el uso de medidas agresivas para mantener la normotermia se asoció con menor probabilidad de eventos cardiovasculares en el postoperatorio.
b. Coagulopatía: se define que un paciente que está siendo sometido a un procedimiento quirúrgico tiene coagulopatía, cuando presenta hemorragia no ocasionada por lesión de estructuras vasculares, susceptibles de control quirúrgico, (sangrado no “mecánico” o sangrado no quirúrgico). La hemorragia se hace evidente en los planos de disección, en las superficies traumatizadas o en la superficie de las serosas, como sangrado en capa, o como hemorragia a partir de un sitio que ya había sido controlado. También puede presentarse por fuera del área quirúrgica en las mucosas, los sitios de venopunción, el tubo endotraqueal, o manifestarse como sangrado digestivo o hematuria (90).
La mayoría de casos de coagulopatía en pacientes traumatizados o quirúrgicos mayores ocurre como consecuencia de las alteraciones propias de la injuria o la transfusión múltiple, en tanto que muy pocos corresponden a alteraciones hematológicas previas o son secundarias a administración de anticoagulantes.
La frecuencia de esta complicación es muy variable y depende del mecanismo, la localización anatómica de la lesión, la severidad del trauma, y de la calidad de la atención. Oscila entre el 12 y el 63%, en series de pacientes de alto riesgo (90-95).
La coagulopatía de los pacientes que han recibido transfusiones múltiples ha sido explicada por dilución de las plaquetas y los factores de coagulación. Sin embargo, esta variable explica solamente entre el 35% y el 43% de la alteración de los recuentos plaquetarios que se presenta en estos casos (90). La hipotermia, por las razones ya mencionadas, parece tener más peso en el desarrollo de esta complicación (96-97). Por otra parte, las alteraciones endoteliales producidas por la hipoperfusión y la hipotermia misma, pueden desencadenar coagulación intravascular diseminada, la cual ha sido reportada en el 25% al 30% de los pacientes quirúrgicos que desarrollan sangrado no mecánico (98-99).
La prevención de la coagulopatía se obtiene a través de una reanimación adecuada, tendiente a disminuir el insulto hipóxico y mediante las medidas descritas para la prevención de la hipotermia. La administración profiláctica de componentes sanguíneos o de calcio, cada cierto número de unidades de glóbulos rojos transfundidas, no ha logrado reducir el riesgo de esta complicación, por lo que no están indicados (100-101).
El tratamiento de la coagulopatía durante el procedimiento quirúrgico abarca la revisión y la optimización de la aplicación de las medidas recomendadas para prevenirla; la comprobación del control de todas las causas de sangrado mecánico; la abreviación de la cirugía, con empaquetamiento de las superficies sangrantes, ligaduras intestinales y aplazamiento de anastomosis o construcción de estomas y el cierre temporal rápido de la pared abdominal; y la administración de componentes sanguíneos de acuerdo con las necesidades identificadas por las pruebas de laboratorio. En caso de ser necesaria la administración empírica, los componentes requeridos en orden de probabilidad son plaquetas, plasma fresco congelado y crioprecipitado.
c. Procedimientos de salvamento: consiste en la interrupción del procedimiento quirúrgico como se reseñó en el aparte anterior, cuando se identifican hipotermia, coagulopatía (102) o refractariedad del estado de shock, con el propósito de intensificar la reanimación, someter el paciente a recalentamiento y corregir el problema hematológico en una unidad de cuidado intensivo. Una vez estabilizado el estado hemodinámico y corregidos los problemas hematológico y metabólico, el paciente es trasladado nuevamente al quirófano para completar la cirugía (103-109). Esto ocurre entre 12 y 36 horas en la mayoría de los casos. Algunos individuos requieren más de un procedimiento y resultan siendo tratados por etapas.
Los procedimientos de salvamento o control de daños representan el 5% de todas las laparotomías por trauma (110) y se asocian con una mortalidad entre el 30% y el 70%, la cual depende de la severidad del trauma y de la magnitud de deterioro fisiológico que sufre el paciente cuando se decide abreviar al cirugía. En centros que poseen experiencia considerable con este tipo de pacientes, se ha logrado reducir la mortalidadm, gracias a una decisión más temprana y a una interrelación óptima de lso equipos involucrados (104-110).
Referencias
1. Sackett LD, Richardson WS, Rosenberg W, Haynes BR: Evidence Based Medicine. Churchill Livingstone. New York, N.Y. 1997
2. Shoemaker WC, Appel PL, Kram HB et al: Prospective trial of supranormal values of survivors as therapeutic goal in high risk surgical patients. Chest 1988; 94: 1176-86
3. García A, Soto R: Trauma vascular abdominal. Predictores de mortalidad en 250 casos . VI Congrso Panamericano de Trauma. San José de Costa Rica, noviembre de 1993
4. Sauaia A, Moore Fa, Moore EE, et al: Early predictors of postinjury multiple organ failure, 1994; 129: 34-45
5. KUMARA, PARRILLOlE: Shock: Classification, pathophysiology.and approach to management. In Parrillo lE, Bone RC Eds. Critical Care Medicine. Principies 01′ Diagnosis and Treatment. Mosby year book. St Louis Mi. 1995; 291-340
6. SHOEMAKERWC: A new approach to physiology. monitoring and therapy 01′ shock states. World 1 Surg. 19S7; 11: 133-46
7. ZWEIFACH BW: Microcirculatory hemostasis 1930 – 1990: Insights into the microcirculatory readjustments provided by studies on the peripheral circulatory insufticiency of the shock syndrome. Microcirculation 1995; 2: 245-51
8. CHIDIAC lA, SALON lE: Left ventricular segmental motion abnonnalities in septic shock. Crit Care Med. 1995; 23: 594-S
9. lARDINF, FOURNET, PAGEB, el al: Persistent preload defect in severe sepsis despite tluid loading. A longitudinal echocardiographic study in patients with septic shock. Chest 1999; 116: 1354-9
10. MIMOZ 0, RAuss A, REKIK N, el al: Pulmonary artery cateterization in critically ill patients: a prospective analyses of outcome changes associated with catheter – prompted changes un therapy. Crit Care Med 1994; 22: 573-9.
1l. HAHI.ER OP; MESSMER KF: The physiology of oxygen transport. Transfus Sci, 1997; IS: 425-35
12. RACKow EC; WEIL MH: Physiology of blood flow and oxygen utilization by peripheral tissue in circulatory shock. Clin Chem. 1990; 36: 1544-6
13. W AYDHASC; NAsT-KoLB D; locHuM M; el al: Inflammatory mediators, infection. sepsis, and multiple organ failure after severe trauma. Arch Surg. 1992; 127: 460-7
14. FROON AH; GREVE lW; VAN DER LINDEN Cl; BUURMAN WA: Increased concentrations of cytokines and adhesion molecules in patients after repair 01′ abdominal a0l1ic aneurysm. Eur 1 Surg, 1996; 162: 287-9
15. SEI’KAMI’A; locHlIM M; ZIEGLERM; el al: Cytokines and adhesion molecules in elective and accidental trauma-related ischemia/reperfusion. 1 Trauma, 1995; 44: 874-82
16. SHOEMAKERWC, AI’I’EL PL, KRAM HB, el al: Role 01′ oxygen debt in the development of organ failure, sepsis, and death in high risk surgical patients. Chest 1992; 102: 20S-15
17. WEIL MH, AFIFI AA: Experimental and clinical studies onlactate and pyruvate as indicators 01′ the severity 01′ acute circulatory failure (shock). Circulation 1970; 41: 9S9-82
18. ROlIMEN RMH. REDL H, SClII.AN in severely traumatized patients. 1 Trauma 1993; 35: 349-55
19. FAI.CONE RE. SANTANELLOSAo SCHULZMA, el al: COITelation for metabolic acidosis with outcome following injury and its value as a scoring tool. World 1 Surg 1993; 17: 575-9
20. LOSADAHF, GARCíA A. SDOM después de trauma torácico. Factores de riesgo y cuadro clínico … Presentado en el VII Congreso Panamericano de Trauma. Cal1agena, noviembre 1994
21. LOSADA HF, GARCíA A: Comparación de dos métodos de cuantificación de acidosis metabólica, como predictores de SDOM postraumática. Presentado en el Segundo Congreso de Cuidado Intensivo. Cartagena, 1995
22. SHOEMAKERWC, AI’PEI. PL, KRAM HB, el al: Hemodynamic and oxygen transport responses insurvivors and nonsurvivors of high risk surgery. Crit Care Med 1993; 21: 977-90
23. BOYD0, GROUNDSM, BENNETD: Preoperative increase in oxygen delivery reduces mortality in high risk surgical patients. lAMA 1993; 270: 2699-07.
24. MOORE FA. HAEMMEL lB, MOORI’. EE, el al: Incommensurate oxygen consumption in response to maximal oxygen availability predicts postinjury organ failure
25. BISHOI’ MW, SHOEMAKER WC, AI’I’EL PL. el al: Prospective randomized trial 01′ survivors values of cardiac index, oxygen delivery and oxygen consumption as resuscitation endpoins in severe trauma. 1 Trauma 1995: 38: 780-S
26. FIDDIAN-GREEN RG. BAKER S: Predictive Value 01′ the stomach wall PH ror complications al’ter cardiac operations: Comparison with other monitoring. Crit Care Med. 19S7; 15: 153-7
27. DOGLlO GR, Pus AJO lE EGURROLA MA, el al: Gastric mucosal PH as a prognostic index 01′ mortality in critically ill patients. CritCareMed 1991; 19: 1037-40
28. GUTII::RREZG, PAI.II.AS E DOGI.IO G, (‘/ al: Gastric mucosal PH as a therapeutic index ortissue oxygenation in critically ill patients. Lancet 1992; 339: 195-99
29. MAYNARDN, BIHARI R, BEALE R. (‘/ al: Assessment of splachnic oxygenation by gastric tonometry in patients with acute circulatory failure. lAMA 1993; 270: 1203-10
30. CHAN(; MC, CHEATHAMML, NELSONLD. el al: Gastric tonometry supplements information provided by systemic indicators of oxygen transport. 1 Trauma 1994: 37: 4SS-94
31. GUTIERRI:I G. BROWN S: Gastric tonometry: a new monitoring modality in the intensive care unit. 1 Intensive Care Med 1995: 10: 34-44
32. IVATlJRYRR. SIMON Rl. ISLAMS. el al: A prospective randomized study 01′ endpoints 01′ resuscitation after major trauma: global oxygen transport indices versus organ-speciric gastric mucosal
PH. 1 Am ColI Surg. 1996; 183: 145-54
33. PEITZMANAB; BILLlAR TR; HARBRIC”HTBG; (‘1 al: Hemorrhagic shock. Curr Probl Surg 1995; 32: 925-1002
34. HILL AG. HILL GL: Metabolic response to severe injury. British 1 Surg IlJlJS; 85: S84-lJO
35. American College 01′ Surgeons. Shock. In advanced trauma lire support ror doctors. Instructor course manual. Chicago 1997; 97-117
36. CERRA FB. SIE 37. CUTHBERTSONDP: Ohservations on the disturbance ofmetabolism produced by injury to the limbs. Quarterly 10urnal 01′ medicine. 1932; 25: 233-46
38. CUTHBERTSONDP: Post-shock metabolic response. Lancet 1942; i: 433-37 the severity of the ischemic insult in hemonhagic shock. Crit Care Med 1991; 19: 231-43
39. GRACE P: lschaemia-rcperfusion injury. Br J Surg. 1994: 81: 637-47
40. OGAWAS, GERI.ACHH, Esposrro C, el al: Hipoxia modulates the balTier and coagulant function of cultured bovinum endothelium. J Clinical Invest. 1990; 85: 1090-8
41. OCHOAJ. UIJEKWlIA. BII.I.IAR T. el al: Nitrogen oxide in patients al’ter trauma and during sepsis. Ann Surg 1991: 214-621-6
42. JACOB T, OCHOA J, UDEKWII, el al: Nitric oxide is inhibited in trauma patients. J Trauma 1993: 35: 590-7
43. TEDDER STEI’BER D. CHEN A. el al: The selections: vascular adhesion molecules. FASEB J 1995: 9: 866-73
44. HARI.AN 1. YEIJDER N. WINN R. el al: Mechanisms and consequences for leucocyte-endothelial cell interaction. West Med J. 1991; 155: 365-9
45. MII.ESKI W. WINN R, YEIJlJFR N, el al: Inhibition for CD-18-dependent neutrophil adherence reduces organ injury after trauma in primates. Surgery 1990: 108: 206-12
46. LEDGERWOOIlAM, LlICAS CE: Postresuscitation hypertention: etiology, morbidity and treatment. Arch Surg. 1974, 108: 513-9
47. LlICAS CE. Resuscitation 01′ the injured patient: Three phases for treatment. Surg Clin North Am. 1977; 57: 3-22 48. ClINNINC;HAMJN, SHIRESGT, W NiNER Y: Changes in intracellular sodium and potassium content of the red blood cells in trauma
and shock. Am J Surg. 1971; 70: 215-9
49. CIINNINC;IIAMJN, SHIRESGT, W AGNERY: Cellular transport defects in hemorrhagic shock. Surgery 1971; 70: 215-9
50. LlICAS CE: Hemorrhagic shock. crystalloids, colloids and the interstitial space matrix. Panam J Trauma. 1989: 1: 48-55
51. COPE O. LrrwIN SB: Contribution ofthe Iymphatic system to the replenishment 01′ plasma volume following hemorrhage. Ann Surg. 1962: 655-9
52. SHIRES GT. COHN D. CARRICOCT: Fluid therapy in hemOlThagic shock. Arch Surg. 1964; 88: 688-92
53. WOI.FMAN EF, NEILL SA, HEAPS DK, el al: Donor blood and isotonic salt solution. Arch Surg. 1963; 86: 869-92
54. SHIRESGT. WII.LIAMS J. BROWNF: Acute changes in extracelular fluid associated with major surgical procedures. Ann Surg 1961; ISO: 803-7.
55. TRANBAIIC;1IRE LEWIS FR. CRISTENSENJM. EI.INc;s BY: Lung Water Changes Al’ ter Thermal Injury. The EfTects for Cristalloid Resuscitation and Sepsis. Ann Surg 1980; 192: 479-90.
56. BICKU.I. WH: WAI.I. MJ JR: PEPE PE: el al: Immediate versus delayed fluid resuscitation for hypotensive patients with penetrating torso injuries. N Engl J Med 1994; 331: I 105-9
57. Pulmonary Artery Catheter Consensus Participants. Pulmonary artery consensus conference: consensus statement. Crit Care Med. 1997; 25: 910-25
58. WII.I.IAMS JE SENElT MG. FRIIIlMAN Be. el al: Use for femoral venous catheters in critically ill adults: prospective study. Crit Care Med 1991; 19: 550-3
59. HAlISER CJ, SHOEMAKERWe. TlIRPIN L, el al: Oxygen transport response to colloids and crystalloids in critically ill surgical patients. Surg Gynecol Obstet 1980; 150: 81 1-6
60. FAILLACE DF, LEDGERWOOD AM, LlICAS CE, el al:Immunoglobulin changes al’ter varied resuscitation regimens. J Trauma 1982; 22: 1-5
61. LlICAS CE, LEDGFRWOODAM. MAMMENEF: Altered coagulation protein content al’ter albumin resuscitation. Ann Surg 1982; 196: 198-202
62. LlICAS CE, LFDGFRWOODAM, HICiCiINS:Impaired salt and water excretion al’ ter albumin resuscitation 1’01’ hypovolemic shock. Surgery 1979: 86: 544-9
63. YFLANOVICHY: Crystalloid versus colloid fluid resuscitation: a meta-analysis 01′ mortality. Surgery 1989; 105: 65-71
64. BISSONNI RS, HOLTGRAVEDR, LAWI.ER F, el al: Colloid versus cristalloid in fluid resuscitation: an analysis for randomized controlled trials. J Farm Pract 1991; 32: 387-90.
65. SHIERHOllT G, ROBFRTS 1: Fluid resuscitation with colloid for crystalloid in critically ill patients: a systematic review for randomized trials. Br Med J 1998; 316: 961-4
66. Cristalloid l’S colloids in fluid resuscitation: a systematic review. Choi PTL, Yip G, Quinonez LG, Cook OJ. Crit Care Med 1999: 27: 200-10
67. WADF CE, KRAMER GC, GRADy]J, el al: Efficacy ofhypertonic 7.5% saline and 6% dextran-70 in treating trauma: a metaanalysis for controlled clinical studies. Surgery 1997; 122: 609-17
68. FARINGERPD. MlILLlNS RJ, JOHNSONRL, el al: Blood components supplementation during massive transfusion for AS-I red cells in trauma patients. J Trauma 1993; 34: 481-7
69. EDELMANB, HEYMANMR: Blood component therapy for trauma patients. En Grande e. (de): Trauma anesthesia. St Louis Missouri. Mosby Year Book, 1992, pp 133
70. RFFD RL, C1AVARELLAD, HEIMBACH DM, el al: Prophylactic platelet administration during massive transfusion: A prospective, randomized, double-blind clinical study. Surgery. 1986; 203: 40
71. MARTIN DJ, LlICAS CE, LFDGERWOODA, el al: Fresh frozen plasma supplement to massive red blood cell transfusion. Ann Surg 1985:202: 505
72. DODD RY: The risk 01′ transfusion-transmited infection. N Eng J Med 1992; 327: 419 73. HERBFRT PC, WELLS G, BI.AJCIIMAN MA, el al: Multicenter,randomized, controlled c1inical trial for transfusion requirements
in critical careo N eng J Med 1999; 340: 409-17
74. ABOll-KHAI.II. B: SCALEATM; TROOSKINSZ, el al: Hemodynamic responses to shock in young trauma patients: need for invasive monitoring Crit Care Med 1994; 22: 633-9
75. KINCAID EH: MII.I.ER PR; MEREIJITII JW el al: Elevated arterial base deficit in trauma patients: a marker 01′ impaired oxygen utilization. J Am Coll Surg 1998: 187: 384-92
76. DIINHAM CM. SIEC;EI.JH, WEIRFTER L, el al: Oxygen debt and metabolic acidemia as quantitative predictors of mortality and 77. B¡SHOP MH; SHOEMAKERWC; ApPEL PL: Relationship between supranormal circulatory values. time delays, and outcome in
severely traumatized patients. Crit Care Med 1993; 21: 56-63
78. VI’LMAHOSGC; DEMETRIADESD; SHOEMAKERWC, el al: Endpoints of resuscitation of critically injured patients: ¡.normal or supranormal? A prospective randomized trial. Ann Surg 2000; 232: 409-18
79. HEYLAND DK; COOK Dl; KING D, el al: Maximizing oxygcn delivery in critically ill patients: a methodologic appraisal of the evidence. Crit Care Med 1996; 24: 517-24
80. CHANG MC; MEREDITH lW: Cardiac preload, splanchnic perfusion, and their relationship during resuscitation in trauma patients. 1Trauma 1997; 42: 577-82
81. DRUKERW, PEARSEF, GLASS-HEIIlENREICH L, el al: Subcutaneous tissue oxygen pressure: a reliable index of peripheral perfusion in humans after injury. 1Trauma 1996; 40 (s): 116-22
82. SHOEMAKER WC, AI’PEL PL, KRAM HB: Oxygen transport measurements to evaluate tissue perfusion and titrate therapy: dobutamine and dopamine effects. Oit Care Med 1991; 19: 672-88
83. VINCENTlL, ROMANA, KAHN R.I: Dobutamine administration in septic shock: addition to a standard protocol. Crit Care Med 1990; 18: 689-93
84. LlINA GK, MAIER RV, PAVLlN EG, el al: Incidence and effect for hypothermia in seriously injured patients. 1 Trauma 1987; 27: 1014
85 . .IURKovlCH Gl, GREISERWB, LUTERMANA, el al: Hypothermia in trauma victims: An ominous predictor of survival. 1Trauma 1987; 27: 1019
86. BISSONNETTE B, NEBIJIA SP: Hypothermia during anesthesia. Physiology and effects of anesthetics on thermoregulation. Anesth Clin North Am. 1994; 12: 409-24
87. KAI.ISH MA: Hypothermia and hyperthermia in trauma patients. En Grande C, (ed): Trauma anesthesia. St Louis Missouri, Mosby Year Book, 1992, 340
88. BUI.IN B; SHAVIT y; RAZUMOVSKY .1, el al: Effects for mi Id perioperative hypothermia on cellular immune responses. Anesthesiology 1998; 89: 1133-40
89. GENTILELLOLM, luRKovlcH Gl, STARKMS el al: ¡,1s hypothermia in the victim 01′ major trauma protective for harmful? A randomized prospective study. Ann Surg 1997; 226: 439-47
90. GARCÍA A: Coagulopatía asociada al trauma. Rev Col Cirug. 1996; 11; 17-23
91. ClIE Y, CRYFR HG. MILLER FB, el al: Packing and planned reexploration for hepatic and retroperitoneal hemorrhage: Critical refinements for a useful techni(jue. 1Trauma 1990; 30: 1007
92. FU.ICIANO DV, MATTOXKL, BURCH.IL, el al: Packing for control of hepatic hemonhage . .1Trauma 1976; 26: 738-43
93. PHII.I.IPS TE SOULlER G, WILSON RF: Outcome for massive transfusion exceeding two blood volumes in trauma and emergency surgery. 1Trauma 1987; 27: 903-10
94. COUNTSRB, HAISCHC. SIMONTL, l’/ al: Hemostasis in massively transfused patients. Ann Surg 1979; 190: 91
95. FERRARA A, MACARTlIR 10, WRI(;HT el al: Hypothermia and acidosis worsen coagulopathy in the patient requiring massive transfusion. Am 1Surg. 1990; 160: 515
96. REEIl RL, .I0HNsTONTD. HlIDSON10, el al: The disparity between hypothermic coagulopathy and clotting studies. 1Trauma 1992; 33: 465
97. GUBLER KD, GENTILFLLO LM. HASSANTASHA, el al: The impact of hypothermia on dilutional coagulopathy. 1Trauma 1994; 36: 847
98. BI’N(iTSSON A: Cascade system activation in shock. Acta Anesthesiol Scand 1993; 37. S: 7
99. McMILLAN MA. HURIBAL M. SlIMl’lO B: Common pathway for entothelial-Ieucocyte interaction in shock. ischemia. and reperfusion. Ann 1 Surg. 1993; 166: 557
100. BlINKER lP. STI’TSON lB. COE RC el al: Citric acid intoxication. lAMA 1955; 157: 1361
101. PERKINSHA, SYNIlER M. TRACIII’R C. el al: Calcium ion activity during rapid exchange transfusion with citrated blood. Transfusion 1971; 1 1: 204
102. STONE HH. STROM PR, MUI.I.INS Rl: Management for the coagulopathy with onset during laparotomy. Ann Surg 1983; 197: 532-35
103. BlIRCH 1, ORTIZ VB. RICHARIlSON Rl. el al: Abbreviated laparotomy and planned reoperation for critically injuried patients. Ann Surg 1992; 215: 476
104. FU.ICIANO DY. MATTOX KL BlIRCH lL el al: Packing for control of hepatic hemorrhage. 1Trauma 1976; 26: 738-43
105. CUE Y, CRYER HG. MII.LER FB. el al: Packing and planned reexploration for hepatic and retroperitoneal hemorrhage: Critical retinements 01′ a useful techni(jue. 1Trauma 1990; 30:
1007
106. SIIARP K, LOClCERO R: Abdominal packing 1’01″surgically uncontrollable hemorrhage. Ann Surg 1992; 215: 467
107. ROTONIlO M. SIIWAIJW, MCGoNI(;AL MO. el al: “”Damage control”: An approach for improved survival in exsanguinating abdominal injury. 1Trauma 1993; 35: 375
108. MORRIS .lA, lR., EDDYVA. BUNMANTA. el al: Staged celiotomy for trauma: issues in unpacking and reconstruction. Ann Surg 1993; 217: 576-86
109. HIRSHIJER(;A. WALL Ml lR .. MAITOX KL: Planned reoperation for trauma: a two year experience with 124 consecutive patients. 1Trauma 1994; 37: 365-69
110. BEJARANOW. PÉRFZ M. GARCÍA A. ORIl()NEZ C: Laparotomía abreviada en trauma. Presentación de 192 casos. Presentado en el XII Congreso Panamericano de Trauma, Venezuela. noviembre de 1999.
* ALBERTO GARCÍA MARÍN. Cirujano de Urgencias y UCI. Hospital Universitario del Valle, Cali. Colombia.
1. Cada mol de glucosa oxidada completamente a través del metaholismo aeróbico produce 36 moles de ATP(673 Kcal). A través del metabolismo anaeróbico la glucosa debe ser derivada a la producción de ácido láctico. vía en la que cada mol produce 2 moles de ATP (47 Kcal).



CLIC AQUÍ Y DÉJANOS TU COMENTARIO