VÉLEZ-ROJAS H.,MD, SCC.
Palabras clave: Autotransfusión, Sangre autóloga, Choque hemorrágico.
Ante el aumento cada vez mayor de los índices de mortalidad por choque hemorrágico debido a la gravedad de las lesiones traumáticas y al déficit de los bancos de sangre, en el Hospital Universitario San Vicente de Paúl, de Medellín, se decidió emplear la autotransfusión de sangre total en estos pacientes y en otros con hemorragia severa de origen médico: gestación extrauterina e hiperesplenismo, y en algunas operaciones electivas sobre el hígado y el corazón. Se presentan los resultados obtenidos entre 1984 y 1995 con el uso de la autotransfusión en 650 pacientes. El 25% de ellos recibió sangre con contaminación bacteriana originada en las vísceras huecas del abdomen lesionado. Con el uso de sangre autóloga se eliminaron muchos de los problemas originados por la sangre de banco: demora en su entrega, isoinmunización, fibrilación auricular y sobre todo, transmisión de infecciones como VIH, hepatitis y paludismo, entre otras.
Introducción
En Colombia, las complicaciones y la muerte de los pacientes atendidos en los servicios de urgencias originadas por el choque hipovolémico, constituyen un problema que deben enfrentar los médicos cada vez con mayor frecuencia, debido a la violencia (1) y a la severidad del trauma intencional o accidental; éste desencadena grandes pérdidas sanguíneas que no logran ser compensadas por los exiguos depósitos de los bancos de sangre. Ello y el riesgo de transmisión sanguínea de enfermedades infecciosas, como sífilis, hepatitis, Chagas y SIDA, han hecho que se recurra a la propia sangre del mismo paciente en forma de autotransfusión.
La autotransfusión se ha definido como el procedimiento por el cual se devuelve a la circulación general la sangre que ha perdido un paciente por el área traumática y que se ha acumulado en una de las cavidades corporales.
La autotransfusión se ha utilizado desde el siglo pasado: en 1818, Blundell (2) la realizó por primera vez en Inglaterra al inyectar 8 onzas de sangre perdida en un parto, y luego en 1886, Duncan transfundió 100 mL de sangre durante la amputación de un miembro inferior (3). A partir de entonces se le ha empleado en diversos países y en diferentes situaciones quirúrgicas: embarazo ectópico roto (4), hemotórax masivo (5), miomatosis uterina (6), esplenectomía (7), estallido esplénico (8), hemangiomas cerebrales (9) y en variadas situaciones de urgencias, como en guerras y desastres así como en cirugías por trauma o electivas.
La autotransfusión se emplea en Colombia desde 1948, cuando el recién fundado banco de sangre del Hospital Universitario San Vicente de Paúl (HUSVP), de Medellín, fue incapaz de suplir la demanda para la operación urgente de una paciente con anemia aguda por embarazo ectópico roto (10); se la siguió utilizando en pequeña escala hasta 1984, cuando empezó su empleo sistemático y con adaptaciones tecnológicas que buscaban acomodarse a nuestros recursos y posibilidades.
En este trabajo se presentan los resultados obtenidos entre 1984 y 1995 con el uso de la autotransfusión en pacientes que requirieron una operación urgente en el HUSVP de Medellín. Esta sistematización de nuestra experiencia es fundamental para el planteamiento de investigaciones prospectivas que permitan esclarecer su verdadera utilidad y sus limitaciones.
Materiales y Métodos
Los Pacientes
Se trata de un estudio descriptivo, retrospectivo en el que se revisó la experiencia de la autotransfusión en 650 pacientes urgentes o electivos del HUSVP y de algunas clínicas particulares de Medellín, entre diciembre de 1984 y junio de 1995. Dichos pacientes fueron atendidos en los servicios de urgencias de esas instituciones y presentaban pérdidas sanguíneas o acumulaciones en una cavidad corporal mayores de 500 mL o iban a ser sometidos a operaciones electivas que por su naturaleza hacían prever una pérdida significativa de sangre durante el acto quirúrgico.
Procedimiento de la autotransfusión
Se efectuó en cinco etapas sucesivas: decisión, recolección, anticoagulación, filtración y reinfusión.
– Decisión. Era tomada por el cirujano en el momento de iniciar el acto quirúrgico.
– Recolección. Cuando existía sangre acumulada en el tórax o el abdomen, se procedía de la siguiente manera:
a. En el tórax se puncionaba con la aguja No. 18 de la bolsa de flebotomía que usan los bancos de sangre, que ya tiene anticoagulantes, directamente en la pared del tórax en el espacio intercostal apropiado o en el extremo distal del tubo de toracostomía ya pinzado.
b. Si el tórax y el abdomen ya estaban abiertos, se extraía la sangre de la cavidad con ayuda de un pequeño recipiente o aspirando con un equipo al vacío (11) o con una bomba aspirante-impelente de SARNS (Sams Incorporated, Ann Arbor, Michigan, EEUU).
– Anticoagulación. Se emplearon dos sistancias anticoagulantes (12):
a. Citrato de sodio en forma de citrato-fosfato-dextrosa, que es la sustancia que contienen las bolsas del banco para recibir la sangre del donante.
b. Heparina en solución de 0.4 mL en 500 mL de solución salina, mezclada con la sangre extraída, especialmente de la cavidad abdominal, en una proporción del 20%. Esta mezcla se realizó en una de dos modalidades: 1) In situ, agregando de una vez la totalidad de la solución a la sangre en la cavidad, después de calcular el volumen allí almacenado y procurando una mezcla uniforme; 2) fraccionada, aspirando alternadamente volúmenes de heparina y de sangre almacenada en proporción de 20/80 hasta la recolección total.
– Filtración. Se lleva a cabo durante el proceso de recolección y luego nuevamente en el momento de la reinfusión hacia el paciente (13). En el primer paso, si había coágulos grandes o partículas tisulares de mayor tamaño, la sangre se pasa inicialmente a través de un cedazo plástico y luego por un filtro doble de nylon de la llamada screen de 140 y 80 micras, colocado en la parte distal del tubo aspirador en su conexión con el recipiente de recolección. Para la reinfusión se utilizó el filtro que tiene los equipos de transfusión sanguínea (14).
– Reinfusión. Se hace a partir del recipiente colector, directamente hacia las venas del paciente, durante la intervención quirúrgica o al final de ella cuando ya están controladas todas las áreas sangrantes. Esta última modalidad se usaba sólo si el estado de hipovolemia del paciente lo permitía.
El postoperatorio del paciente fue controlado por el equipo de cirujanos que había efectuado la intervención quirúrgica y la autotransfusión.
Complicaciones
Toda transfusión sanguínea acarrea peligros (15) tales como errores en la clasificación del grupo, transmisión de enfermedades (16-20), arritmias cardíacas por empleo de sangre fría, inoportunidad por la demora que implica la toma de las muestras de sangre, su envío al banco, su estudio y su devolución. Estos peligros se eliminan con el uso de sangre autóloga aunque ésta también origina complicaciones que se clasifican en 4 tipos:
– Trastornos de coagulación, como coagulopatía dilucional por consumo de los factores de coagulación, fibrinógeno y plaquetas (21,22).
– Trauma y lisis de los eritrocitos, provocados por la turbulencia de la aspiración o por los rodillos de los equipos. Ello y el tiempo que permanece la sangre acumulada en una de las cavidades, provocan la lisis con la consiguiente liberación de hemoglobina que puede desencadenar una insuficiencia renal aguda (IRA).
– Émbolos sólidos y gaseosos (23) ocasionados por la manipulación y por el trauma de los tejidos. Los primeros, a su vez, pueden desencadenar coagulación intravascular diseminada (24).
– Contaminación bacteriana producida por gérmenes diferentes de los del paciente (25) o por los suyos propios, habitantes normales de las vísceras huecas de la cavidad abdominal (26-30).
Análisis de la información
La información se obtuvo de un formulario diligenciado por los cirujanos en el postoperatorio inmediato que fue diseñado con el fin de conservar un registro de la experiencia independiente de las historias clínicas hospitalarias. De él se tomaron las variables consideradas de mayor importancia para el análisis y que pudiera orientar la formulación de investigaciones futuras.
La sistematización, el procesamiento de los datos y el análisis estadístico se hicieron en el programa Epi Info 6.04 (OMS/CDC de Estados Unidos). Para el análisis se utilizarón medidas estadísticas descriptivas de frecuencia, de tendencia central y de dispersión, según fuera el caso. Para establecer relaciones entre las variables se utilizaron las pruebas X2 y t student y un nivel de significación del 0.05.
Resultados
Descripción de los pacientes
Se incluyeron 650 pacientes con edades comprendidas entre 7 y 82 años. El promedio de 26.9 años (DE: 10.4 años). El 62.6% (407/650) tenían entre 15 y 34 años. Hubo 595 hombres (91.5%) y 55 mujeres (8.5%).
Seiscientos treinta y tres pacientes (97.4%) sufrieron algún tipo de trauma y los 17 restantes (2.6%) fueron de origen no traumático. De los traumatizados, 296 lo fueron por arma de fuego (46.8%), y 271 (42.8%) por armas cortopunzantes; los 66 restantes (10.4%) tuvieron traumas cerrados. Tuvo heridas traumáticas el 98.7% (587/595) de los hombres y el 83.6% (46/55) de las mujeres. Las 9 mujeres restantes presentaron hemorragia de aparición espontánea, causada por embarazo ectópico, ruptura de aneurisma o estallido esplénico.
Características clínicas
El compromiso, según las áreas corporales afectadas en los pacientes traumatizados, fue del tórax en el 42% (266/633), el abdomen en el 38.4% (243/633) el tórax y abdomen simultáneamente en el 18% (114/633) y en otras áreas en los 10 restantes.
Según los órganos afectados por el trauma, la lesión fue vascular en 302 pacientes (46.5%), de víscera sólida en 82 (12.6%), de víscera hueca en 16 (2.5%), de víscera sólida y hueca en 27 (4.22%) y tanto vascular como víscera sólida y hueca en 223 (34.3%) (Tabla 1).
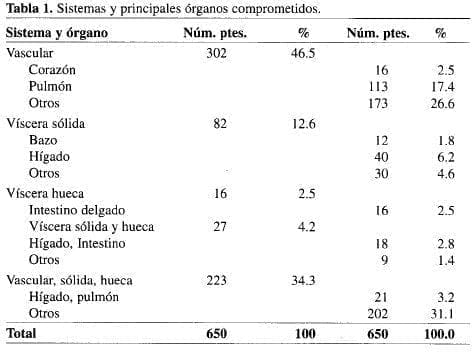
Entre los 633 pacientes traumatizados, 266 (42.0%) que presentaban lesión de víscera hueca, se supone que su contenido contaminó la sangre libre en la cavidad.
El promedio de sangría fue 3 litros (DE: 1.5) en los pacientes traumatizados y 3.2 litros (DE: 2.5) en los no traumatizados.
La autotransfusión
La bolsa de transfusión fue el método de recolección más empleado en la autotransfusión urgente: se usó en 234 pacientes (37%); fue seguida por el pocillo en 214 pacientes (33.8%); la bomba de Sams en 131 pacientes (20.7%); y la bomba al vacío en 54 pacientes (8.5%). En las autotransfusiones por operaciones electivas (17 casos) la distribución fue similar.
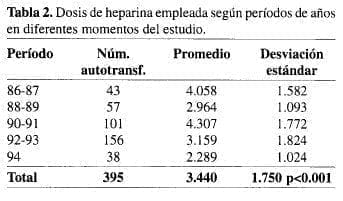
De los 633 pacientes con trauma que recibieron autotransfusión urgente se empleó heparina en 383 (60.5%), citrato en 224 (35.4%), ambas en sólo 6 pacientes (0.9%) y ningún anticoagulante en 20 (3.2%). En 84 pacientes se aplicó la heparina in situ. El promedio de unidades de heparina utilizadas en 383 pacientes traumatizados fue de 3.440 unidades (DE: 1.750), con una variación en la dosis, según los años (Tabla 2).
El volumen de sangre transfundida en los 422 pacientes traumatizados que no recibieron sangre del banco fue en promedio de 1.670 mL (DE:1.059) y varió desde 250 hasta 8.800 mL. En los 211 pacientes en quienes se utilizó sangre de banco además de la autóloga, el promedio de volumen de autotransfusión fue de 1.280 mL (DE: 1.155 mL). Cada individuo de un grupo de 135 pacientes traumatizados recibió adicionalmente, en promedio, 190 mL de glóbulos rojos.
Al comparar el volumen de sangre que perdió cada paciente traumatizado con la cantidad total que se reemplazó por autotransfusión y por sangre de banco, se obtiene un superávit o un déficit. El primero se presentó en el 5% (32/633) de los pacientes, con un promedio de 633 mL (DE: 678), pero a su vez, estos fueron quienes mayor sangrado tuvieron (promedio 3.8 L). Entre quienes tuvieron déficit en el reemplazo sanguíneo (601/633) el promedio fue de 924 mL (DE: 702).
La autotransfusión, a pesar de su seguridad, también presenta complicaciones. Estas se dieron en el 39.7% de los pacientes traumatizados (251/633) (Tabla 3), en quienes la principal complicación fue la muerte en 138 pacientes (21.8%).
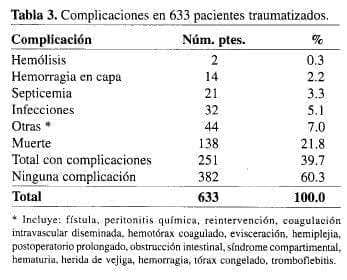
*Incluye: fístula, peritonitis química, reintervención, coagulación intravascular diseminada, hemotórax coagulado, evisceración, hemiplejia, postoperatorio prolongado, obstrucción intestinal, síndrome compartimental, hematuria, herida de vejiga, hemorragia, tórax congelado, tromboflebitis.
La armas de fuego fueron la principal causa de trauma en los pacientes complicados. Entre los 138 muertos, 89 (64.5%) fueron heridos por arma de fuego (AF) y 34 (24.6%) por arma cortopinzante (ACP). Similar distribución de las armas empleadas ocurrió en las demás complicaciones, excepto en la hemorragia en capa (AF 29%, y ACP 57.1%). En quienes no se complicaron, la frecuencia fue del 38.7% de heridas con AF; 54.7% con ACP; 6.6% con otras armas.
Considerando en una categoría los 113 pacientes vivos que presentaron alguna complicación, y en otra los 138 muertos, y comparándolos con los 382 no complicados, se observa en la Tabla 4 la relación existente entre las magnitudes del sangrado, de la autotransfusión y del déficit, con las posibles complicaciones; en los tres parámetros las diferencias fueron significativas; sin embargo, esta asociación se debe al volumen de sangre no reemplazada.

En la Figura 1 se presentan los diversos tipos de complicaciones en los pacientes que recibieron sangre presumiblemente contaminada. Se evidencia una relación de esta condición con la sepsis y con otras complicaciones no sépticas. No hay relación de la sangre contaminada con la complicaciones hemorrágicas y con la muerte. Los pacientes que recibieron sangre contaminada tuvieron un déficit volumétrico mayor que los que la recibieron no contaminada (diferencia: 0.12 L p= 0.01).
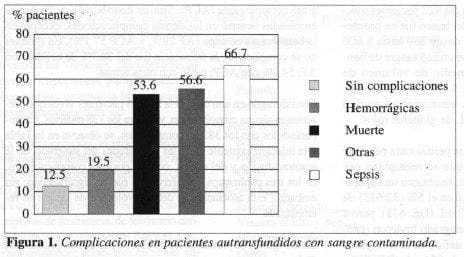
No se encontraron diferencias en los diversos tipos de complicaciones según el volumen de heparina empleada (unidades por litro de sangre autotransfundida) (p>0.01).
Discusión
Ante la imposibilidad de los bancos de sangre para atender la demanda siempre creciente de sangre para salvar la vida de los pacientes con trauma severo y en choque hipovolémico, en el HUSVP se optó hace más de 10 años por la autotransfusión de sangre autóloga, buscando reducir los índices de mortalidad por esta causa. En el Servicio de Urgencias ya no se descarta la sangre que el herido tenga acumulada en el tórax o en el abdomen sino que se la transfunde de inmediato para contrarrestar el choque de manera más efectiva que con la sangre de banco, escasa y distante. La sangre está caliente y a la mano para su empleo inmediato sin necesidad de estudios de clasificación de grupo sanguíneo ni de enfermedades transmisibles, con lo que se economiza un tiempo vital que contribuye grandemente a la supervivencia del paciente en estado grave.
Este trabajo tiene grandes limitaciones, dado su carácter descriptivo retrospectivo, ya que inicialmente no había claridad sobre los obstáculos de una tarea como ésta y, menos aún, sobre sus posibles soluciones. El carácter mismo de urgencia frente a una vida que se está apagando, unido a la inexperiencia, llevó a no cumplir en los primeros tiempos un protocolo riguroso de trabajo.
La decisión es la más importante de las etapas de la autotransfusión, pues el tiempo es precioso para asegurar el éxito en los casos más graves. Hay que actuar con prontitud desde el mismo momento en que se entienda la esencia del cuadro clínico que presenta el herido: choque hipovolémico.
El método de recolección varió en el curso del trabajo: pasó de exprimir las compresas empapadas en sangre hasta recurrir a la bomba de Sarns que es el método ideal porque aspira la sangre de una cavidad y la expele a un recipiente recolector; en el curso del trabajo utilizaron métodos tan sencillos para recolectar la sangre como pocillos y bolsas de banco.
No se usó, como regla general, ninguna sustancia anticoagulante cuando la sangre se obtuvo del tórax a través de la sonda de toracostomía conectada a la trampa de agua que, en estos casos, era reemplazada por solución salina normal. En las primeras épocas se añadió heparina a la sangre del tórax de un gran número de pacientes cuando ésta fue recogida durante la toracotomía. La tendencia actual es a suprimir todo tipo de anticoagulación pues la sangre en contacto con el aire y en permanente agitación por los movimientos respiratorios se conserva líquida. En los casos con un volumen significativo de sangre acumulada en la cavidad abdominal (más de 1.000 mL), la heparina se empleó a distintas diluciones muy elevadas en los años iniciales (5.000 a 10.000 unidades por paciente). Esas concentraciones fueron reduciéndose hasta adoptar en los últimos tiempo 2.000 unidades por paciente; la tendencia actual es a suprimir totalmente la anticoagulación en pacientes con pérdidas masivas, ya que hay datos que hacen pensar que la heparina contribuye a la aparición de coagulopatías.
Los trastornos de la coagulación, como la coagulopatía dilucional por consumo de los factores de coagulación, fibrinógeno y plaquetas, son de mayor gravedad en las transfusiones masivas de 2 o más litros, pues las plaquetas sufren agregación al contacto con el aire y las superficies del peritoneo, los músculos, los plásticos, etc., y son atrapadas en los filtros. Muchos de estos pacientes que reciben su propia sangre autocontrolan la coagulopatía si logran sobrevivir las primeras 4 ó 5 horas. Nunca se ha visto algo similar en aquellos pacientes que reciben sangre de banco. En la autopsia de pacientes fallecidos que recibieron autotransfusión se han presentado casos de trombosis pulmonar por hipercoagulabilidad.
La hipotermia tiene un efecto nocivo sobre la cascada de la coagulación en el paciente con trauma, por varios mecanismos que bajan la coagulabilidad con alteración de la morfología y la función y secuestro de las plaquetas (31,32).
Alrededor del propósito y del esfuerzo para evitar el fallecimiento de todo herido en choque hipovolémico y con inestabilidad hemodinámica, restaurando a la mayor brevedad posible la volemia con su propia sangre acumulada en el tórax o en el abdomen, se afrontaron las dificultades que se presentaban en cada caso, con modalidades variables de un paciente a otro, sin la visión de conjunto que la experiencia ofrece y que sólo se capta al final cuando se pueden apreciar los errores, las dificultades y las imprecisiones que la ignorancia oculta.
Las dudas que se plantean alrededor del uso de sangre contaminada por los propios gérmenes del paciente, necesitan un mejor análisis basado en los datos que pueda suministrar el laboratorio clínico con cultivos de la sangre que se va a emplear y con el control que pueden afrecer los hemocultivos del receptor obtenidos inmediatamente se hace la autotransfusión y varias horas después.
De estos y muchos otros aspectos surge la necesidad de realizar un trabajo prospectivo en el que se cumplan estrictamente todos los requisitos de la investigación científica, así se podrá fundamentar mejor el uso de la autotransfusión.
Agradecimientos
En la realización de este trabajo debo agradecer la participación y el esfuerzo de muchas voluntades: los cirujanos de urgencia en todos sus niveles, los anestesiólogos y las enfermeras. Entre los primeros quiero mencionar con nombre propio al doctor Alberto Bernal Eusse, quién laboró por 20 años como cirujano de la Policlínica del HUSVP y a quien se le deben muchas de las vidas y aportes a este trabajo. Mención muy especial al Centro de Investigaciones Médicas de la Facultad de Medicina de la Universidad de Antioquia, con nombres propios como el Doctor Carlos Lerma Agudelo, su director, y su consagrado investigador; el doctor Héctor Y. García García. Sin ellos, todos los informes aquí presentados hubieran permanecido en la oscuridad. Finalmente, a la secretaria Adriana Escobar que una y cientos de veces corrigió y efectuó cambios de última hora.
Abstract
Faced with rapidly increasing mortality rates from hemorrhagic shock of traumatic origin, a condition that is aggavated by insufficiency of blood bank facilities, our group at San Vicente de Paul Hospital, Medellín, Colombia, started an agressive program of auto-transfusion of whole blood in trauma patients, in cases of major bleeding of medical origin, in extra-uterine pregnancy, in patients with hypersplenism, and in major hepatic and cardiac operations.
We hereby report our results in the 1984-1995 period that underwent auto-transfusion in 650 patients; 255 of them received contaminated blood originating in the hollow viscera of the traumatized abdomen.
The use of autologous blood eliminated many of the problems associated with bank blood: delays in delivery, iso-immunozation, atrial fibrillation, and specially, the transmission of infections such as VIH, hepatitis, and malaria.
Referencias
1. Saldarriaga JC: La violencia en Antioquia. Bol Epidemiol Ant 1987; 12: 285-314
2. Blundell J: Experiment on the transfusion of blood. Medical Chir Transf 1818; 9: 56-9
3. Duncan J: On reinfusion of blood in primary and other amputations. Brit Med J 1886; 1: 192-3
4. Thies HJ: Zur Behandlung der extrauterine Gravität. Zbl Gynhack 1914; 38-191
5. Elmendorf A: Ueber Widerinfusión nach Punktion eines firschen Hemotorax. Munchen Med Wochenschr 1917; 64: 36-9
6. Noon GP, Solis TT, Natelson EA: A simple method of intra-operative autotransfusion. Surg Gynecol Obstet 1976; 143: 65-70
7. Coley BL: Traumatic rupture of the spleen: splenectomy, auto-trasfusion. Am J Surg 1928; 14: 334-5
8. Smith RS: Laparoscopically guided blood salvaged at splenic trauma. J Trauma 1993; 34: 113-5
9. Davies LE, Cushing H: Experiences with blood replacement during or after major intracraneal operations. Surg Gynecol Obstet 1925; 40: 310-32
10. Vélez H: La autotransfusión en 110 pacientes urgentes. An Acad Medic Medellín. Epoca V 1989; 2: 81-9
11. Dekkers R, Rizzo RJ, Body SC, Fitzgerald DJ, Clhun LH: Seed whole blood autotrasfusion in aortic aneurysm operation with modified collection infusion system. Ann Thorac Surg 1995; 59: 184-6
12. Mortelmans Y, Vermaunt G, Van Aken H, Goossens W, Boogaerts M: Quality of washed salvaged red blood cells during total hip replacement: a comparison between the use of heparin and citrate as anticoagulant. Anaesth Analg 1994; 79: 357-63
13. Orr MD: Remove of microfibrils collagen hemostat by the use of trasfusion filters. Ann Thorac Surg 1994; 57: 100-1
14. Vargas ZA, Thompson JF, LockeEdmunds JC, Baird RN, Farnden JR: Clinical and experimental studies of intra-operative autotransfusion using a new filtration device. Brit J Surg 1995; 82: 765-9
15. Warner RA: The risk of transfusion. Anaesth Clin North Am Banks 1990; 3: 501-17
16. Seidl SS, Kuhn P: Transmission of diseases by blood transfusion. World J Surg 1987; 11: 30-5
17. Arch RD, et al: Post-transfusion hepatitis: Current perspectives. Ann Int Med 1980; 92: 539-46
18. Curran JW, Lawrence DN, Jeffe H: Acquired immunodeficiency syndrome (AIDS) associated with transfusions. N Engl J Med 1984; 31: 69-75
19. Paterman TA, Jaff HW, Feorino PM, Getchell JP, Narfield JT: Transfusion associated with acquired immunodeficiency syndrome. World J Surg 1987; 11: 36-40
20. Seyfriend H, Walewska Y: Immune hemolyitic transfusion reactions. World J Surg 1987; 11: 25-9
21. Moore EE, Dunnel EL, Breslich DL, Catloy WB: Platelet abnormalities asociated with massive autotrasfusion. J Trauma 1980; 20: 1052-6
22. Locker GJ, Staudinger T, Knapp S, Laczika KF, Burgmann H, Urlicic A: Prostaglandin E inhibits platelet decrease after massive blood transfusion during major surgery: influence on coagulation cascade? J Trauma 1997; 42: 525-31
23. Lindes JV, Kaplan HS, Murphy MT: Fatal air embolism due to peri-operative blood recovery. Anaesth Analg 1997; 84: 422-6
24. Seyfriend H, Walewska I:Immune hematologic transfusion reactions. World J Surg 1987; 11: 25-9
25. Glover JL, Smith R, Yaw PB: Intra-operative autotransfusion. World J Surg 1987; 11: 60-4
26. Glover JL, Broadie TA: Autotransfusion of blood contaminated by intestinal contents. J Am Coll Emerg Physic 1978; 7: 142-4
27. Timberlake GA, Mc Swain EN: Autotransfusion of blood contaminated by enteric contents. J Trauma 1988; 28: 855-7
28. Ozmen V, Mc Swain EN, Nichols RL, Smith J, Flint LM: Autotransfusion of potentially contaminated cultured positive blood (CPB) in abdominal trauma. J Trauma 1992; 32: 36-9
29. Conti S, Mekhian H, Fitzpatrick HP: Fatal peritonitis after massive blood transfusion. Case report. J Trauma 1987; 18: 362-3
30. Rush BF, Redan JA, Flanagan JJ, Heneghan JB, Hsieh J, Murphy TF, et al: Does the bacteremia observed in hemorrhagic shock have clinical significance? Ann Surg 1989; 210: 342-7
31. Reuler JB: Hypothermia, pathophysiology, clinical setting and management. Ann Int Med 1978; 89: 519-27
32. Valeri CR, Feingold H, Cassidy G, Ragno G, Shukri K, Altschule MD: Hypothermia induced by reversible platelet dysfunction. Ann Surg 1987; 205: 175-81.
Correspondencia:
Doctor Hernando Vélez Rojas. Calle 2 Sur No. 46-55 Consulto 522. Medellín, Colombia.
Doctor Hemando Vélez Rojas, Cirujano Gral., Clínica “Las Vegas “, Hosp. Univ. San Vicente de Paúl. Medellín, Colombia.
