N. ZUNDEL, MD, SCC; H. RESTREPO, MD, SCC; J.D. HERNANDEZ, MD.
Palabras clave: Esplenectomía laparoscópica, Púrpura trombocitopénica idiopática, Esferocitosis hereditaria, Anemia hemolítica autoinmune, Cirugía mínimamente invasora.
Se presenta la experiencia de los autores en esplenectomía laparoscópica a partir de 1994, en la que se describe por primera vez en el pcís la práctica de 29 casos en pacientes con púrpura trombocitopénica idiopática, e5ferocitosis hereditaria y anemia hemolítica autoinmune. Se discuten las indicaciones y contraindicaciones, se describe la técnica quirúrgica y las variaciones que hemos implementado, comparándolas con las de otros autores, con el fin de disminuir costos. Se presentan los resultados y se concluye que es un procedimiento seguro, eficaz, con las ventajas para el paciente de la cirugía mínimamente invasora, y que es posible realizarlo a costos razonables.
Introducción
Desde que Spencer Wells, en Inglaterra en 1887, realizó la primera esplenectomía electiva exitosa (1, 2), ésta viene practicándose para diversas patologías; y desde cuando en 1991 Delaitre practicó la primera esplenectomía por laparoscopia (3-7), y en 1992 Cuschieri describió su técnica (8-10), varios grupos han presentado su experiencia con este procedimiento. Aunque, debido a su importancia inmunológica y el acceso a nuevas técnicas de diagnóstico menos invasoras el bazo ya no es extirpado con tanta liberalidad como en otras épocas, aún hay patologías que sólo se curan o mejoran sustancialmente con la esplenectomía (11).
Inicialmente la esplenectomía laparoscópica (EL) se practicó en pacientes con enfermedades hematológicas en las que el bazo tenía un tamaño normal o pequeño (5-7, 9, 11-15), pero actualmente tiene las mismas indicaciones que la esplenectomía abierta (Nomenclatura 1).

Algunas de estas indicaciones no están bien establecidas. Existe controversia acerca de si debe practicarse esplenectomía según el estadio de los linfomas (4, 9, 10); para algunos autores el trauma es contraindicación para la EL, mientras que otros la han realizado con éxito (9-11). Igual sucede con los aneurismas de la arteria esplénica, de rara presentación (4).
Se han reportado algunas EL por patologías poco frecuentes como un hamartoma (19), un bazo flotante necrosado (17) un paciente con enfermedad poliquística (17).
Aunque no hay consenso relacionado con las contraindicaciones del procedimiento, han sido mencionadas por algunos autores la hipertensión portal, coagulopatía no corregida, adenopatías sobre el hilio esplénico, la obesidad mórbida (4, 10, 11, 14) y, como ya se mencionó, el trauma y los aneurismas (9-11), que podrían ser contraindicaciones relativas.
Durante la cirugía pueden practicarse procedimientos adicionales como colecistectomía, apendicectomía (2, 12), etc.
Las complicaciones que han sido informadas (2, 4, 6, 7, 11, 15, 16) son generalmente menos frecuentes que en la esplenectomía abierta, y usualmente no son atribuibles a la técnica propiamente dicha (Nomenclatura 2).

La conversión, en general poco frecuente, ha sido principalmente por hemorragia, ya sea de origen vascular o parenquimatoso (5, 10-12) o por ruptura del bazo o de la bolsa en la cavidad abdominal.
Existe aún un gran número de interrogantes acerca de la técnica, del tamaño y peso máximos del bazo y de la seguridad de la EL en pacientes con cáncer; sin embargo, este procedimiento está encontrando su lugar en la cirugía laparoscópica avanzada.
En este artículo se presenta la primera experiencia en Colombia con la técnica de EL empleada por los autores, los resultados obtenidos y las complicaciones asociadas.
Pacientes y Métodos
Entre enero de 1994 y marzo de 1998 se practicó esplenectomía laparoscópica a 29 pacientes en la Fundación Santa Fe de Bogotá y en el Hospital Pablo Tobón Uribe de Medellín,así como en otras ciudades, por los mismos autores.
El estudio preoperatorio de los pacientes con indicación quirúrgica incluyó ecografía y TAC abdominal para establecer el tamaño y el peso estimado del bazo y la presencia de bazos accesorios, además de los exámenes hematológicos requeridos según la patología del paciente, y los demás exámenes prequirúrgicos usuales.
Todos los pacientes deben tener recuento plaquetario por encima de 50.000 y pruebas de coagulación normales o deben ser corregidas con la administración de los productos adecuados en el preoperatorio inmediato (9). En el caso de estar recibiendo esteroides o gamaglobulina, se debe continuar con este tratamiento (9, 13, 18).
Es también indispensable vacunarlos con el Pneumovax®, vacuna contra varias cepas de pneumococo responsables de la sepsis posesplenectomía (OPSI), idealmente 8 a 15 días antes de la cirugía (2-7, 9-11, 13, 17, 18,20).
Se administran antibióticos profilácticos durante la inducción anestésica.
Técnica quirúrgica
Posición del paciente
Se coloca al paciente en decúbito supino con un rollo bajo el hemitórax y región lumbar izquierdos, con los miembros superiores adosados al cuerpo y los miembros inferiores en abducción para permitir al cirujano situarse entre ellos. Los ayudantes se ubican a cada lado y los monitores a la cabecera (Figura 1).
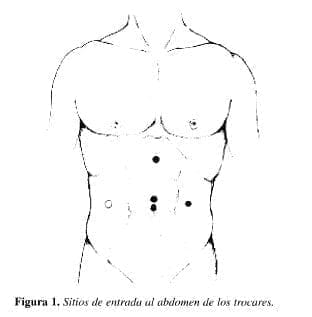
Se colocan cuatro puertos de acceso, tres de ellos en la línea media, u.no periumbilical (W 1); otro, debajo del apéndice xifoides (N° 2); Yel tercero, en un punto equidistante de los dos anteriores (N° 3); todos con trocares de 10 mm; el cuarto trocar, también de 10 mm, se localiza en el flanco izquierdo a la misma altura del trocar inferior (N° 4); o más abajo, dependiendo del tamaño y de la localización de la porción más inferior del bazo (Figura 1). Para la colocación del primer trocar (periumbilical) se incide la piel con bisturí, se profundiza en el tejido celular subcutáneo con electrocauterio y se dilata con pinzas de Kelly. Se abre la aponeurosis con electrobisturí entre pinzas para pasar el trocar mediante técnica abierta, y se inicia la insuflación del neumoperitoneo para colocar los demás trocares.
Procedimiento
Por el trocar N° 1 se introduce la cámara; por el N° 2, una pinza de pulmón, que en nuestra experiencia es la que mejor permite sujetar y manipular el bazo; por el N° 3 Ypor el N° 4, que son la mano derecha y la izquierda del cirujano, el disector y la tijera y los demás instrumentos que se requieran (clips, portagujas, etc).
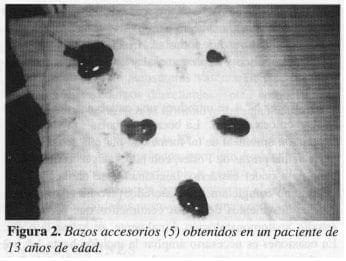
La primera acción está dirigida a encontrar y resecar los bazos accesorios en los lugares donde son más frecuentes (2, 4, 6, 7, 10-14, 17, 21): hilio esplénico, cola del páncreas, epiplón, a lo largo de la arteria esplénica, ligamento esplenocólico, mesenterio y ovario izquierdo (en orden descendente de frecuencia), ya que las enfermedades hematológicas pueden persistir o recidivar por la presencia de tejido esplénico accesorio (Figura 2).
Inicialmente los vasos polares inferiores son disecados, ligados entre clips y cortados, ya que pueden ser fuente de hemorragia importante si se desgarran al movilizar el bazo de sus elementos de fijación.
Luego se incide y abre la hoja anterior del ligamento gastroesplénico para exponer los vasos cortos, que se disecan, se ligan con clips y se cortan. Usualmente el vaso gástrico corto más alto en la curvatura mayor no puede ser alcanzado y se deja para un paso posterior, en el que se puede emplear una endograpadora vascular, que es el método preferido por la mayoría de los autores americanos y europeos, pero que eleva mucho los costos.
La disección del mlio esplénico debe ser muy cuidadosa pues en este momento se puede presentar la complicación más temida: la lesión de los vasos esplénicos, lo que puede obligar a la conversión de la cirugía. Vale la pena anotar que por dicho riesgo, esta es la única cirugía laparoscópica que practicamos con un equipo disponible de laparotomía abierta y con clamps vasculares listos.
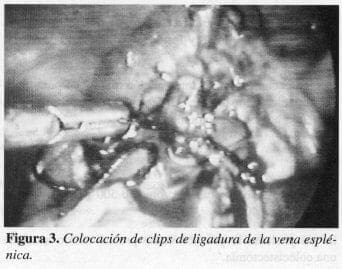
La arteria se liga con dos clip s proximales y uno distal y se corta. Una vez disecada e individualizada, la vena esplénica es ligada con seda Oanudada en forma endocorporal. El segmento distal es ligado con clips y se corta con tijeras (Figura 3). También puede realizarse este paso con endograpadora.
En este momento el bazo puede ser traccionado y el último vaso gástrico corto expuesto para ligarlo con clips y cortarlo. Se libera el bazo de todas sus fijaciones, los ligamentos esplenocólico y esplenorrenal y el ligamento freno esplénico.
Por el trocar N° 4 se introduce una endobolsa dentro de la cual se coloca el bazo. La boca de la bolsa es extraída por la incisión umbilical de tal forma que por ella se puedan introducir las pinzas de Foster, con las cuales se fragmenta el bazo para poder extraerlo. Inicialmente se obtienen partes del órgano completamente macerado, pero luego es posible obtener fragmentos de varios centímetros que permiten el estudio anatomopatológico. Finalmente, se extrae la bolsa. En ocasiones es necesario ampliar la incisión hasta 1.5 o 2 centímetros para poder extraer el bazo que queda en la bolsa. Es de suma importancia vigilar que ésta bolsa no se rompa, ya que la diseminación de su contenido puede permitir la siembra de tejido esplénico viable en la cavidad abdominal, conocida como esplenosis (1,2,5,6,9,10, 12, 13), que puede reactivar la enfermedad he mato lógica preexistente o producir siembras tumorales.
Se revisa la hemostasia y se irriga la cavidad. En caso de estar indicado, se puede practicar otro procedimiento quirúrgico, como una colecistectomía o una apendicectomía (2). Se extraen los trocares bajo visión directa y se cierran las incisiones. No dejamos drenes.
Evolución y seguimiento postoperatorio
Debe realizarse control frecuente del recuento plaquetario, ya que en los pacientes con PTI y otras entidades hematológicas puede presentarse trombocitosis por encima de un millón de plaquetas, casos en los cuales podría estar indicada la administración de heparina.
Resultados y Discusión
En el período de 51 meses reportados se practicaron 29 EL en pacientes entre los S y los 51 años de edad con los siguientes resultados:
Las indicaciones para la intervención fueron, púrpura trombocitopénica idiopática en 21 pacientes; esferocitosis en 7; y anemia hemolítica auto inmune en 1.
Ninguno de los procedimientos debió ser convertido a abierto.
El peso de los bazos fue en promedio 500 g, con un rango entre 350 y 1.400 g.
En un paciente se practicó como procedimiento asociado una colecistectomía.
Se encontraron bazos accesorios en 3 pacientes, 2 con un bazo cada uno, y el tercero con cinco bazos accesorios, dos en el epiplón mayor y tres en el hilio esplénico (Figura 2).
Se practicó una esplenectomía accesoria en un paciente con PTI que presentó persistencia de su enfermedad después de una esplenectomía abierta situación ya reportada en la literatura (7, 10).
Dos pacientes requirieron transfusión de dos unidades de glóbulos rojos cada uno, circunstancia que también se presenta en la cirugía abierta.
No se presentó ninguna complicación intraoperatoria.
Hubo 1 caso de mortalidad por sepsis secundaria a neumonía, a los S días del postoperatorio; la morbilidad estuvo dada por atelectasia en 2 pacientes e infección superficial de la herida quirúrgica en otro.
El tiempo quirúrgico osciló entre SOy ISO’, con una media de 106′. La estancia intrahospitalaria en todos los caso estuvo entre 4S y 96 horas, con una media de 54 horas.
Probablemente, debido a la escasa experiencia y a que se trata de una técnica reciente y en desarrollo, no hay aún unidad de criterio, y es así como la posición del paciente varía del decúbito supino con las piernas en aducción o en abducción a posición de litotomía y hasta en decúbito lateral derecho (2, 4-9, 12-14, 17, IS, 20). Igual sucede con la ubicación del cirujano, en algunos casos del lado derecho o, como lo preferimos nosotros, en medio de las piernas abiertas del paciente (2, 17). También la colocación y el número de los trocares, que va de cuatro a seis, es diferente (2, 4-9, 13, 14, 20). Pensamos que la posición ideal es el decúbito supino por su comodidad y porque la conversión, de ser necesaria, puede realizarse sin cambiar al paciente de posición. En este caso, la colocación de los trocares en la línea media hace más fácil unir las incisiones con mejor resultado estético.
Hay acuerdo en la necesidad de explorar la cavidad en busca de bazos accesorios, que son resecados al encontrarse. No consideramos necesario realizar estudios preoperatorios para buscarlos, ya que ninguno de estos fue completamente confiable, aunque algunos autores han expresado su preocupación por la dificultad de explorar algunos sitios donde son menos frecuentes, como el mesenterio del intestino delgado (5, 6).
El manejo de las estructuras vasculares va desde la ligadura con clips o sutura hasta el empleo de instrumentos de autosutura y corte (2, 5, 7-14 ) e incluso del bisturí ultrasónico (5,6, IS). La arteriografía más embolización de la arteria esplénica es innecesaria y en nuestro concepto aumenta los costos y los riesgos (5, 6, 10).
En algunos trabajos describen la extracción del bazo intacto por una incisión ampliada de alguno de los puertos (4, 7, 14, 20) o uniendo dos de ellos (2), e incluso se reporta una incisión adicional de Pfannenstiel o en la fosa ilíaca izquierda (7). Consideramos que es mucho más apropiado fragmentar el órgano ya sea en forma digital o con pinzas (2, 5- 9, 12, 16, 18) o con un “fragmentador” (morcellator) diseñado para ello, pero es un aparato costoso (5, 11).
En cuanto al tamaño y peso del bazo se ha escrito que el procedimiento puede estar contraindicado en bazos muy grandes, mayores de 15 a 20 cm (20, 21) o de mucho peso, que según los autores está alrededor de 700 g. En nuestra opinión se debe intentar siempre la vía laparoscópica sin importar el tamaño del órgano, y si hay dificultades técnicas se convierte a abierta.
Se ha reportado una tasa de conversión que varía según las series entre el 3 y el 21% (6, 11, 18), aunque algunos grupos como el nuestro no han tenido que convertir ninguna laparoscopia (4, 6, 9).
Los tiempos quirúrgicos y de anestesia son mayores que los la esplenectomía abierta y han sido reportados desde 64 minutos hasta 8 horas según las diferentes series (2, 4-7, 11, 12, 15, 16, 18), lo que indica que.con el tiempo y la experiencia se logrará reducir esos tiempos.
Aunque hay reportados casos con sangrados de 1.500 mL, usualmente el sangrado es escaso, muy similar al de la cirugía abierta.
La respuesta de las plaquetas en pacientes con enfermedades hematológicas es buena, comparable a la de la cirugía abierta (4, 6, 9-11).
Los resultados también se miden por el tiempo de hospitalización, que en promedio es de 3 dígs (2, 4-7, 9, 11, 12, 15, 16, 18, 21) aunque hay pacientes dados de alta incluso el mismo día de la intervención (2); y por el tiempo de reinicio de las actividades normales que es, aproximadamente, de 15 días y algunos hasta de 8 días (5, 6, 16, 18, 21); ambos lapsos son más cortos que los de la cirugía abierta.
El costo comparativo entre la EL y la abieI:’ta puede ser mayor, igualo menor; sin embargo, todos coinciden en que el valor del procedimiento quirúrgico es mucho más alto en la EL, y en que lo sube el precio de la cirugía abierta es la estancia hospitalaria (5, 7, 12, 14-16). En la medida en que se logre un ahorro en los implementos de la laparoscopia, obviando el empleo de auto suturas vasculares, disectores de agua a presión, equipos desechables, etc., como lo hace nuestro grupo, la diferencia disminuye apreciablemente.
Los estudios que comparan la EL y la técnica abierta, aunque no son muy bien diseñados, permiten evaluar la EL como un procedimiento practicable y seguro (2, 5-9-12, 14, 15); la rápida recuperación postoperatoria y el retorno temprano a las actividades normales son una ventaja indiscutible (2, 4-6, 9, 15).
Conclusiones
Aunque el número de procedimientos realizados no es aún suficientemente grande, se puede afirmar que la esplenectomía laparoscópica es una intervención posible, adecuada y segura, y que una vez se supere la curva de aprendizaje y se disminuyan los tiempos quirúrgicos, se minimicen las complicaciones y se reduzcan los costos, se convertirá en el procedimiento ideal, como lo es hoy la colecistectomía laparoscópica, ya que conserva todas las ventajas que da la cirugía mínimamente invasora sobre la abierta.
Abstract
Starting in 1994, we present for the first time in Colombia our experience in 29 patients with idiopathic thromboytopenic purpura, hereditary spherocytosis and autoimmune hemolytic anemia who have be en submitted to laparoscopic splenectomy. Indications for this type of surgery are discussed. The laparoscopic procedure (with some variations we have introduced to the classical technique-aiming at reduction of costs-) is described, comparing our experience with that of other authors. From our results we conclude that it is a safe, efficient procedure, having the advantages of minimally invasive surgery, which can be carried out at a reasonable cost for the patient of the institution.
Referencias
1. Sheldon R. Croom R. Meyer A: Bazo En: Sabiston D. Tratado de patología quirúrgica. Mc Graw-Hill Inc., 1988. 1218-45.
2. Wise S, Rosenbaum G: Laparoscopic Sple-nectomy. In: Arregui M, Fitzgibbons R, Katkhouda N. McKernan, Reich H, eds. PrincipIes of Laparoscopic Surgery: Basic and Advanced Techniques. Springer- Verlag New York Inc” 1995, pp 356-65.
3. Delaitre B, Maignien B, Icard P: Laparoscopic splenectomy. (Carta). Br J Surg 1992; 79:1334.
4. Brunt M, Langer J, Whitman E, et al: Comparative analysis of laparoscopic versus open splenectomy. Am J Surg 1996 Nov; 172: 596-601.
5. Smith D, Meyer T, Goretsky M et al: Laparoscopic splenectomy by the lateral approach: A safe and etfective alternative to open splenectomy for hematologic disea-ses. Surgery 1996 Nov; 120 (5): 789-94.
6. Tsiotos G, Schlinkert R: Laparoscopic splenectomy for immune thrombocytopenic purpura. Arch Surg 1997 Jun; 132: 642-6.
7. Watson D, Coventry B,Chin T. et al: Laparoscopic versus open splenectomy for immune thrombocitopenic purpura. Surgery 1997 Jan; 121 (1): 18-22.
8. Cuschieri A, Shimi S, Banting S, et al: Technical aspects of laparoscopic splenectomy: Hilar segmental devascularization and instrumentation. J R Coll Surg Edinb 1992; 37: 414-16.
9. Cuschieri A: Laparoscopic splenectomy. In: Vitale G, Sanfilippo J, Perissat J: Laparoscopic Surgery: An atlas for general surgeons. J.B. Lippincott Company, Philadelphia, 1995.
10. Rege R, Merriam L, Joehl R: Esplenectomía laparoscópica. Clinicas quirúrgicas de Norteamérica 1996 Jun; 3: 449-459.
11. Flowers J, Lefor A, Steers J et al: Laparoscopic splenectomy in patients with hematologic diseases. Ann Surg Ju11996; 224(1): 19-28.
12. Farah R, Rogers Z, Thompson R et al: Comparison of laparoscopic and open splenectomy in children with hematologic disorders. J Pediatr Ju11997; 131(1): 41-6.
13. Schlinkert R, Braich T: Laparoscopic assisted splenectomy for treatment of presumed immune trhombocytopenic purpura: initial results. Mayo C¡in Proc May 1994; 69: 422-4
14. Lefor A, Melvin S, Bailey R et al: Laparoscopic splenectomy in the management of immune thrombocitopenic purpura. Surgery Sep 1993; 114(3):613-18.
15. Friedman R, Hiatt J, Korman Jet al: Laparoscopic or open splenectomy for he matologic disease: Wich approach is superior? J Am Coll Surg Jul 1997; 185: 49-54.
16. Díaz J, Eisenstat M, Chung R: A case-controlled study of laparoscopic splenectomy. Am J Surg Apr 1997; 173: 348-50.
17. Cadiere G, Verroken R, Himpens J et al: Operative strategies in laparoscopic splenectomies. J Am Coll Surg Dec 1994; 179: 668-72.
18. Katkhouda N, Waldrep D, Feinstein D et al: Unresolved issues in laparoscopic splenectomy. Am J Surg Nov 1996; 72: 585-90.
19. Yoshizumi T, Iso Y, Yasunaga C et al: Laparoscopic splenectomy for splenic hamartoma. Surg Endosc Aug 1997; 11(8): 848-9.
20. Phillips E, Rosenthal R: Laparoscopic splenectomy. In: Phillips E tRosenthal: Operative strategies in laparoscopic surgery. Springer- Verlag,Berlin; 1995: pp 167-72.
21. Skandalakis J, Gray S, Rowe J:Complicaciones anatómicas en cirugía general. La edición. México Mc Graw-Hill, 1984. Pp 175-187.
22. Gigot J, Ville de Goyet J, Van Beers B et al: Laparoscopic splenectomy in adults and children: Experience with 31 cases. Surgery Apr 1996; 119(4): 384-9.
Correspondencia:
Doctor Natan Zundel, Carrera 9 No. 117-20 Consultorio 920. Santafé de Bogotá, D.C., Colombia.
Doctores: Natan Zundel, Consultor de Cirugía Mínimamente Invasora de la FSFB, Coordinador del Comité de Cirugía Endoscópica de la SCC; Hernán Restrepo, Cirujano General del Hospital Pablo Tobón Uribe de Medellín; Juan David Hernández, Residente de Cirugía General del Hospital Universitario de la Samaritana, Bogotá, D.C., Colombia.