Síntomas
Los síntomas de la MG tienen ciertas características que, en los casos típicos, facilitan el diagnóstico en forma directa. El cuadro cardinal consiste en debilidad y fatigabilidad de los músculos esqueléticos. La debilidad tiende a incrementarse con la actividad repetida, y a desaparecer con el reposo. La ptosis palpebral y la diplopía ocurren tempranamente en la mayoría de los pacientes. Cuando los músculos faciales y bulbares están afectados, puede presentarse una risa característicamente deprimida o a manera de discurso nasal y, además, dificultad para masticar o deglutir (41). La diplopía se manifiesta particularmente durante la convergencia y la mirada fija hacia arriba. Estas alteraciones oculares, casi siempre ocurren durante la lectura o con motivo de grandes bebidas. La debilidad generalizada se desarrolla aproximadamente en 85% de los pacientes. Puede afectar los músculos de las extremidades en una distribución proximal, así como también el diafragma y los extensores del cuello. Si la debiIidad de los músculos respiratorios es demasiado severa para requerir ventilación mecánica, se dice que el paciente está en crisis miasténica. Pueden ocurrir exacerbaciones con el embarazo, las infecciones, los problemas emocionales, la menstruación y la exposición al calor o al sol.
Otra característica de la debilidad miasténica es la rápida pero corta mejoría como respuesta a las drogas colinérgicas (ej.: edrofonio). Se observan dramáticos resultados cuando hay signos objetivos tales como ptosis u oftalmoplejía o cuando la enfermedad se encuentra en estados tempranos.
Signos
Al examen físico, los hallazgos están limitados al sistema motor sin alteración del sensorio, pérdida de los reflejos o de la coordinación. Por lo tanto, el examen físico es muy poco demostrativo en un paciente por lo demás sano y con miastenia. Hay que comprobar objetivamente la debilidad muscular, espontánea o por medio de inducción y excluir otras enfermedades neurológicas que la imiten. Las fuerzas deben ser documentadas cuantitativamente para la evaluación posterior del tratamiento. Las medidas cuantitativas más útiles, incluyen la abducción hacia adelante, la capacidad vital y la dinamometría de músculos selectivos. Durante el examen neurológico, los hallazgos positivos dependen de la debilidad muscular tal como la ptosis y la mirada fija paralítica. La respuesta pupilar está preservada. La boca puede estar abierta y el labio inferior evertido. La mandíbula puede caer. La palabra, en ocasiones, es disártrica y disfónica y la deglución difícil. En la historia y durante el examen, el clínico debe buscar siempre signos y síntomas de enfennedades que se asocian con miastenia gravis y anotarlos en la historia (Nomenclatura 1).

Material y Métodos
Desde 1985 a 1997, es decir, en un período de 12 años, hemos reunido 95 casos de timectomías, efectuadas como protocolo para el tratamiento de la miastenia gravis. Ocheta y tres se llevaron a cabo en el Hospital San Juan de Dios de Bogotá, y 12 en el Hospital de Santa Clara de esta ciudad. Las cifras indican que en ese lapso hubo un promedio de 8 casos por año. No se tuvieron en cuenta 65 intervenciones efectuadas con anterioridad, por fallas en las historias clínicas. Los casos más numerosos ocurrieron en mujeres, 76, y en 19 hombres. Las edades oscilaron entre 15 y 55 años, con una edad promedio de 32. Los signos y síntomas predominantes se caracterizaron por ptosis, diplopía, debilidad generalizada, especialmente en las extremidades. En algunos prevalecieron los síntomas respiratorios. En un alto porcentaje, 90%, desde la iniciación de los síntomas y la realización de la timectomía, transcurrieron aproximadamente 14 meses, los cuales fueron cubiertos con el tratamiento médico. La electromiografía y la prueba del edrofonio (Tensilon) fueron constantes para confirmar el diagnóstico. No en todos los casos fue posible la determinación de los títulos de anticuerpos antirreceptores de acetilcolina. En la mayoría, si no en todos, de rutina se efectuó la tomo grafía axial computarizada (TAC) del tórax. La timectomía transesternal ampliada fue la técnica proconizada.
En las mujeres jóvenes se prefirió una incisión transversa submamaria bilateral, por razones estéticas. La casuística muestra 3 timomas en 2 hombres y l mujer. El resultado final en el seguimiento de la miastenia gravis, señala I caso bueno, 1 regular y I malo (el ocurrido en la mujer). Los demás estudios histológicos fueron registrados como hiperplasia tímica. Mortalidad O, morbilidad quirúrgica muy baja. Los resultados obtenidos indican una remisión en 30 a 60% de los casos; sin cambios en 5 a 10%; y empeoramiento en pocos casos.
Clasificación
La severidad clínica de la miastenia gravis generalmente es graduada, funcional y regionalmente, de acuerdo con una escala aconsejada por Osserman (69). Es la clasificación más ampliamente usada, la cual es particulannente útil para medidas terapéuticas (Nomenclatura 2). Pero la enfermedad también ha sido clasificada en varias formas de acuerdo con la edad de iniciación, la severidad, la tasa de progresión, la distribución de la debilidad muscular y si el paciente tiene o no serología positiva para anticuerpos contra los receptores de acetilcolina (AChR).

También se ha clasificado de acuerdo con la causa (Nomenclatura 3). Esta clasificación tiene implicaciones diagnósticas y terapéuticas. La MG inducida por drogas es rara. La historia del uso de la droga es esencial en el estudio de cualquier paciente con MG. Ellas no sólo pueden conducir a una enfermedad parecida a la MG, sino que la pueden exacerbar.

Autoinmune
La MG inducida por la penicilina fue documentada primero por Bucknall y colaboradores en pacientes con art¡itis reumatoidea (15). Más tarde se informó en pacientes con escleroderma y enfermedad de Wilson. La MG inducida por la Gpenicilamina, con frecuencia es ocular y se resuelve cuando se suspende la droga. Esta forma de MG es similar a la autoinmune idiopática desde el punto de vista electrofisiológico e inmunológico, y puede tener niveles séricos elevados de anticuerpos contra los receptores de acetilcolina (AChR). El tratamiento de esta modalidad es la suspensión del medicamento. En ocasiones la recuperación es lenta. Se recomienda que, si los síntomas no mejoran después de 1 año, el paciente sea tratado con drogas inmunosupresoras. Los inhibidores de la colinesterasa alivian la enfermedad (3, 21).
Diagnóstico
Es esencial establecer el diagnóstico de MG en forma inequívoca, excluyendo otras condiciones que imiten la enfermedad, y buscar desórdenes asociados que puedan influenciar la escogencia del tratamiento. La historia y el examen físico, suministran la guía más importante (Guía de diagnóstico 1). Las pruebas de laboratorio, confirman la impresión clínica y excluyen otras posibilidades (Guía de diagnóstico 2). En general, cualquier paciente con debilidad muscular que afecte los músculos de los ojos con fluctuaciones, con reflejos y sensorio normales, se le debe considerar portador de MG hasta cuando se demuestre lo contrario.

Las pruebas de laboratorio son esenciales y se sugiere seguir un orden: las pruebas de anticolinesterasa permiten que la acetilcolina que es liberada de la terminación nerviosa, interactúe con el limitado número de receptores de acetilcolina de las uniones, con la resultante de que se intensifican las fuerzas de los músculos miasténicos. El inhibidor de la estearasa de la acetilcolina (AChE) más comúnmente usado es el edrofonio (Tensilon), debido a la rápida iniciación de su acción (30 segundos) y a la corta duración de sus efectos (5 minutos). Fue introducido como prueba diagnóstica en 1952 por Osserman y Kaplan (70). La prueba es sencilla, rápidamente disponible y barata. Se puede efectuar en el consultorio, excepto en pacientes con enfermedad pulmonar crónica o con arritmias cardíacas. Se considera positiva cuando la mejoría es dramática e inequívoca para debilidad muscular objetiva (Figura 1). No todos los músculos raccionan lo mismo.
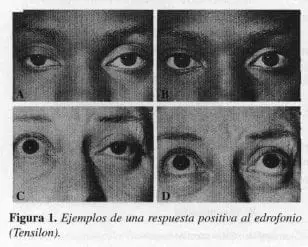
Diez mg de edrofonio generalmente están contenidos en 1 mL; una jeringa adicional con 1 mg de atropina debe estar disponible. La dosis de prueba es administrada intravenosamente. Los signos de hipersensibilidad son: broncoespasmo, bradicardia, náuseas y debilidad profunda (25).
Una prueba positiva del edrofonio debe ser interpretada en el contexto clínico, debido a que la prueba puede ser positiva en otras enfermedades neuromusculares o del tallo cerebral.
Pueden usarse agentes como el metilsulfato de neostigmina (prostigmina) para el diagnóstico de MG, y su acción se inicia a los 5 o 10 minutos. Si se administra intravenosamente sus efectos se observan 1 a 2 minutos después:
A- Ptosis bilateral
B- Recuperación normal de la elevación de los párpados
C- Ptosis unilateral y parálisis bilateral para la elevación
D- La administración de edrofonio elimina la ptosis y restaura los movimientos verticales de los ojos.
Estudios electro fisiológicos. Estimulación nerviosa repetitiva. En esta prueba, el estímulo eléctrico es derivado hacia el nervio, en un índice de 3 por segundo y los potenciales de acción son registrados desde electrodos de superficie sobre el músculo. Una rápida reducción de la amplitud (Figura 2) de los potenciales evocados de la acción muscular (respuesta disminuida del 15%) se considera una respuesta positiva (25). La prueba no es positiva en todos los músculos; se incrementa si el nervio proximal y distalmente es estimulado, si la temperatura intramuscular se alimenta o la prueba es conducida bajo condiciones isquémicas.
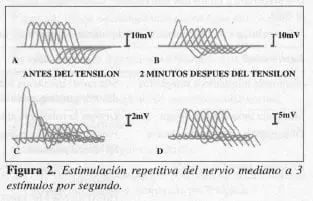
En la figura se observa:
A- Registro de un individuo normal
B- Disminución de la amplitud en 40% en un hombre con MG conocida
C- Una mujer de 19 años con miastenia gravis severa, muestra el estímulo repetitivo sobre el nervio cubital y el registro del músculo abductor, antes del edrofonio.
D- Dos minutos más tarde, después de 10 mg intravenosos de tensión.
Estudios para demostrar una respuesta anormal inmuneanticuerpos antirreceptores acetilcolina. Las pruebas anticolinesterasa y la estimulación repetitiva de nervios, son las menos sensibles y específicas para la MG. La determinación de los niveles plasmáticos de anticuerpos contra los receptores de acetilcolina tiene más especificidad, pero sólo son detectables en el 85% de los pacientes con miastenia gravis generalizada y son más bajos aún en los portadores (50%) con debilidad puramente ocular (56, 97). El grado de positividad de los niveles, no se correlaciona con la severidad de la enfermedad. El nivel, sin embargo, disminuye con la memoria clínica cuando el paciente está recibiendo prednisona u otras drogas inmunosupresoras o ha sido sometido a timectomía y después de plasmaféresis (52).
Los pacientes miasténicos seronegativos (15-20%), son similares en la presentación clínica a los seropositivos y en los hallazgos electrofisiológicos. La terapia para ambas formas es similar. El suero de miasténicos seronegativos, puede producir, experimentalmente, miastenia gravis.
Anticuerpos estriados. Los anticuerpos estriados fueron introducidos en el diagnóstico de la MG, por Straus y col (90). Ochenta por ciento de los pacientes con timoma y MG, Y sólo el 24% sin timoma, tienen pruebas serológicas positivas para anticuerpos antimúsculo estriado (str-ab), pero una prueba serológica negativa no excluye el timoma. Los falsos positivos se observan en pacientes con carcinoma de células pequeñas del pulmón, en los que se hallan en tratamiento con penicilina y en los que han recibido trasplante de médula ósea.
Otros anticuerpos que frecuentemente son detectados en el suero de pacientes con MG son: los anticuerpos contra las células del neuroblastoma, contra las células epiteliales tímicas y los anticuerpos antinúcleos. Los antitiroideos y anticélulas parietales del estómago, son a menudo detectados en la miastenia ocular (79).
Diagnóstico Diferencial
En el diagnóstico diferencial de la MG deben considerarse otras entidades que causan debilidad muscular, por ser este un estado patológico que se le conoce como imitador de muchas enfermedades neuromusculares y no neuromusculares. En esos desórdenes se incluyen síndromes miasténicos congénitos, miastenia droga-inducida, hipertiroidismo, botulismo, síndrome miasténico de la Lambert-Eaton, etc. (Nomenclatura 4). Los síndromes miasténicos congénitos son raros; generalmente empiezan en la primera infancia y requieren pruebas inmunohistoquímicas para su comprobación. La función tiroidea debe investigarse en todos los pacientes con MG.
Fisiopatología
Anatomía normal de la unión neuromuscular
La unión neuromuscular normal en el músculo esquelético, consiste en un nervio terminal o membrana presináptica que contiene mitocondrio, retículo endoplasma rugoso y vesículas sinápticas. Cada vesícula contiene moléculas del neurotransmisor acetilcolina (ACh). Las vesículas con las moléculas de acetilcolina, son lIamadas quantas, las cuales son empacadas en la zona activa (Figuras 3 y 4).
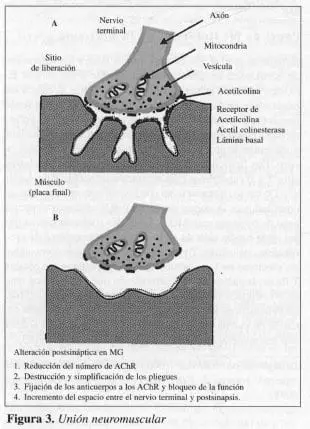
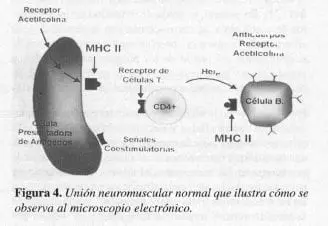
El nervio motor terminal en la unión neuromuscular reposa dentro de pliegues o indentaciones en la superficie de las fibras musculares. El espacio entre estas dos membranas, es referida como hendidura sináptica. La zona activa está constituida por salidas de voltaje de canales de calcio. Los múltiples pliegues de la membrana muscular o postsinápticas incrementan grandemente la superficie y están orientados en forma perpendicular al eje longitudinal de la terminación nerviosa suprayacente. Los rece!Jtores de acetilcolina están localizados (AChR) en el vértice del pliegue. La estearasa de acetilcolina (AChE), lo está en el fondo del pliegue.
A. Unión neuromuscular
B. Unión neuromuscular de un paciente con miastenia gravis.
La espontánea liberación de ACh, produce un subumbral de potencial conocido como miniatura EPP. Cuando el número de quantas liberadas por la sinapsis bajo la acción del nervio produce un potencial fuerte (supra umbral), genera una EPP que origina qna contracción muscular. El magnesio y el calcio intracelular, influencian la liberación de ACh.
La secuencia de la transmisión neuromuscular normal se esquematiza en la Nomenclatura 5.

La unión neuromuscular en la miastenia gravis
La anomalía básica en la miastenia gravis es una disminución
en el número de receptores de acetilcolina (Figura 3B). Esto fue demostrado por primera vez por el uso de la toxina de serpiente, la alfa bungarotoxina, marcada radioactivamente, la cual se une específica, cuantitativa e irreversiblemente a los receptores de acetilcolina del músculo esquelético (22). Estudios de especímenes de músculo, obtenidos por biopsia, mostraron que las uniones neuromusculares de pacientes con miastenia gravis, tienen sólo una tercera parte de los receptores de una persona sana, tomada como control (74). En general, el grado de reducción de los receptores de acetilcolina, se correlacionan con la severidad de la enfermedad. También se observan cambios morfológicos de simplificación del patrón de los pliegues de la membrana postsináptica y un aumento del espacio entre la terminación del nervio y la membrana postsináptica (34).
Estos cambios en la unión neuromuscular explican completamente el cuadro clínico y electrofisiológico de la MG. El principio básico es que la contracción muscular depende de una transmisión neuromuscular efectiva, y la efectividad de la neurotransmisión depende del número de interacciones entre las moléculas de acetilcolina y los receptores de ésta. En las uniones neuromusculares normales los potenciales en la placa terminal son más que suficientes para generar potenciales de acción muscular consistentemente, sin fallas. En las uniones miasténicas la disminución del número de receptores de acetilcolina resulta en disminución de la amplitud de los potenciales en la placa final con fallas para producir potenciales de acción en algunas fibras. Cuando la transmisión falla en muchas uniones, el poder del músculo está reducido, con la manifestación clínica de debilidad. Cuando las contracciones son repetidas, el poder del músculo progresivamente declina como resultado de la falla de la transmisión en más y más uniones neuromusculares. Esta es la consecuencia de la reducción de los receptores de acetilcolina en las uniones miasténicas (32).
Los receptores de acetilcolina
El receptor nicotínico de acetilcolina del músculo esquelético es el blanco de la respuesta autoinmune en la miastenia gravis. Este receptor normalmente recibe renovación continua en la unión neuromuscular. Los nervios motores tienen un papel importante en este proceso regulando la síntesis, la composición de sus subunidades, distribución y degradación de esos receptores. Existe evidencia sustancial de que la transmisión neuromuscular, tiene un papel clave en la regulación neural de estos fenómenos (102).
El deterioro de la transmisión, induce a transcripción incrementada de genes de acetilcolina. Este proceso de cambio y renovación de los receptores de acetilcolina, permiten su recuperación completa en pacientes con miastenia gravis, una vez que el ataque autoinmune ha sido controlado. Uno de los más importantes avances en la biología de los receptores, ha sido la secuencia y clonación de genes para todas las subunidades del receptor de todas las especies, incluyendo a los humanos (23, 65). Por medio del uso de la ingeniería genética, es posible producir ahora fusión de proteínas consistentes en grandes estiramientos o subunidades enteras de los receptores de acetilcolina. Han sido producidos receptores estructural y funcionalmente intactos insertando subunidades mensajeras de RNA (mRNA) dentro de las células. Estos receptores generados por la biotecnología moderna, pueden ser importantes en forma extrema, en las estrategias terapéuticas futuras.
Los anticuerpos reducen el número de receptores de acetilcolina disponibles por tres mecanismos: acelerada endocitosis con degradación; bloqueo funcional de los sitios de unión de la acetilcolina; y daños mediados por el complemento. De manera interesante los anticuerpos de algunos pacientes tienen un efecto más pronunciado en la degradación, mientras que otros producen un bloqueo más marcado de dichos receptores. La capacidad que tienen para unirse al complemento, indudablemente contribuye a su patogenicidad.
Papel de los linfocitos en la miastenia gravis
Aunque la producción de anticuerpos contra los receptores de acetilcolina es directamente atribuible a las células B, existen extensas evidencias de que las células T, tienen un papel clave en la respuesta de anticuerpos en la miastenia gravis (1, 55). Así, las células T de pacientes con esta enfermedad, responden al estímulo con receptores de acetilcolina y aumentan la producción de anticuerpos antirreceptores in vitro. Los linfocitos de la sangre periférica, incluyen linfocitos T y B específicos para receptores de acetilcolina. La línea T o c1onos que reactivan con los otros receptores, han sido aislados de la sangre periférica o más eficientemente del timo de pacientes con MG (45, 58). En contraste con su papel en la producción de anticuerpos antirreceptores de acetilcolina, las células T probablemente no actúan como células efectoras en la miastenia gravis. En realidad las células T de estos pacientes, han demostrado que responden a más de 30 péptidos derivados de los receptores de acetilcolina. La evidencia de la heterogenicidad de las células T, debe ser tenida en cuenta cuando sean diseñadas las vías de acceso con inmunoterapia específica dirigida a estas células (63).
La segunda parte de este trabajo aparecerá publicada en la siguiente entrega de CIRUCIA (Vol. 13 No. 2 – Abril-Junio 1998).

