Síndrome de Hiperinmunoglobulinemia M
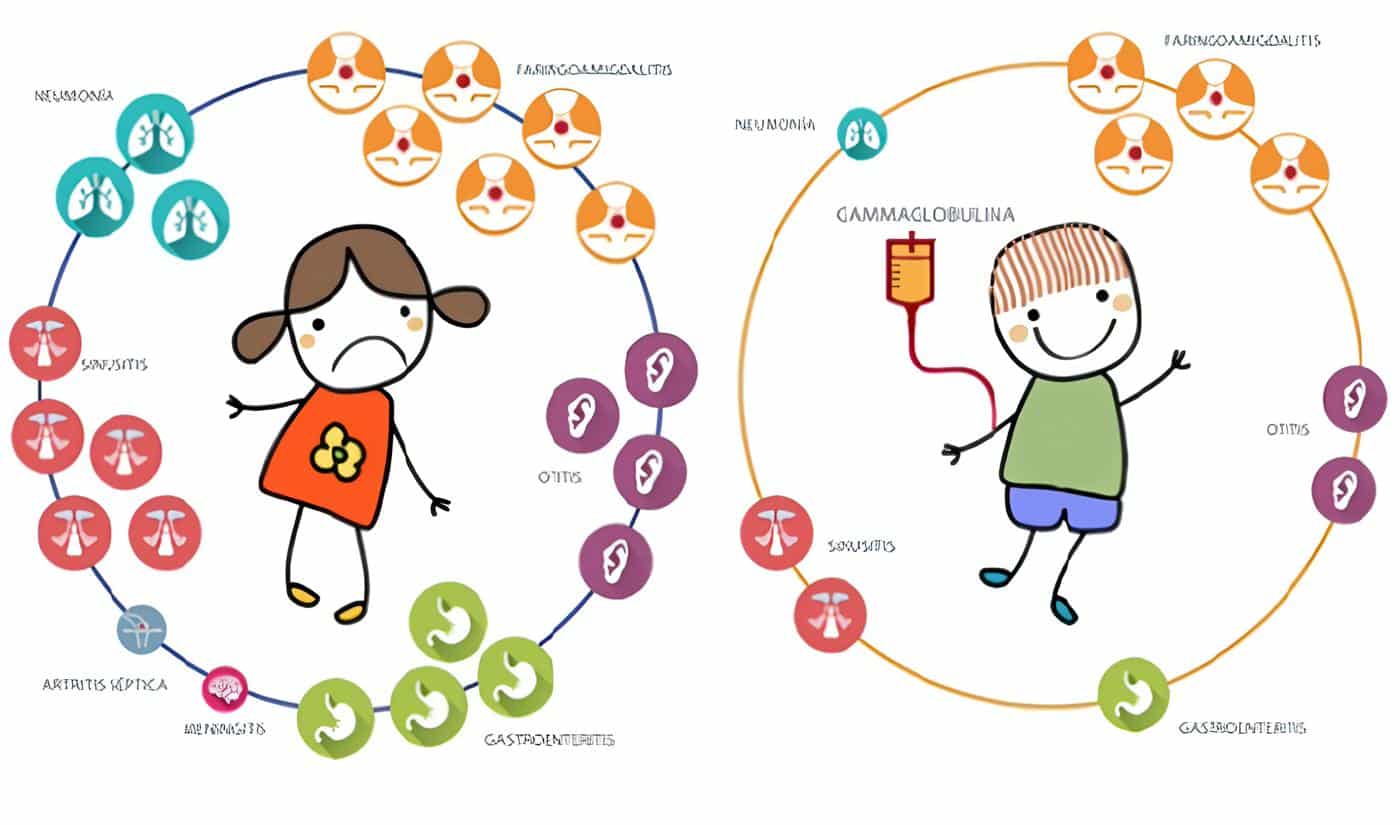
La forma más frecuente (70%) del síndrome de hiperinmunoglobulinemia M es una variante ligada al cromosoma X que afecta a niños varones a partir del 1º al 2º año de vida, con infecciones piógenas recurrentes que incluyen otitis media, sinusitis, neumonía y tonsilitis. Como su nombre lo indica, se detectan concentraciones normales o marcadamente elevadas de IgM policlonal con títulos muy bajos de IgG, IgA e IgE.
El gen defectuoso fue localizado en el brazo largo del cromosoma X y codifica para CD40L. Dada la importancia de esta molécula en la interacción entre las células T y B, los linfocitos B de estos pacientes exhiben incapacidad para cambiar de isotipo y sólo producen IgM (42).
La histología de los ganglios linfáticos muestra ausencia de la formación de los centros germinales y áreas dependientes del timo normales. Se han diseñado pruebas para detectar portadores y realizar diagnóstico prenatal en esta condición (43).
Existen otras formas del síndrome de hiper-IgM debidas a defectos genéticos diferentes a mutaciones en el gen de CD40L; tales alteraciones pueden comprometer a hombres y mujeres y la molécula defectuosa es el CD40.
Deficiencia de Adhesión Leucocitaria (DAL) Tipo 1
La DAL tipo I es un desorden caracterizado por retardo en la caída del cordón umbilical, onfalitis, gingivitis, infecciones cutáneas, otitis media recurrente, neumonía, septicemia, ileocolitis, peritonitis, abscesos perianales y retardo en la cicatrización de heridas.
El gen mutado se localiza en el brazo largo del cromosoma 21, el cual codifica para CD18, la cadena común de las b2 integrinas. Los individuos afectados presentan marcada neutrofilia, aun en períodos libres de infecciones, a causa de la incapacidad de los leucocitos para migrar al compartimento extravascular. En las formas severas de la entidad, las infecciones bacterianas y micóticas amenazan la vida y explican la alta mortalidad (42).
Hogg y col describieron un paciente con un fenotipo compatible con LAD-1 moderadamente severa, quien expresaba LFA-1 y MAC-1 en un 40% a 60% de los niveles normales; dichos niveles de expresión son suficientes para que las integrinas mencionadas funcionen normalmente. Sin embargo, LFA-1 y MAC-1 eran incapaces de unirse a ICAM-1 y al fibrinógeno, respectivamente.
El secuenciamiento de los dos alelos CD18 reveló mutaciones en los nucleótidos que codifican para los residuos que intervienen en las interacciones adhesivas dependientes de cationes divalentes; es decir, en este paciente las b2 integrinas se expresaban en un nivel normal, pero no eran funcionales (44).
Aterosclerosis
Aunque controvertida, existe la noción de considerar la aterosclerosis como una enfermedad autoinmune, puesto que hay evidencia creciente de la activación del sistema inmune durante esta entidad. De particular interés ha sido el hallazgo que los diferentes tipos celulares que en concierto constituyen la placa ateromatosa (macrófagos, células T, células endoteliales, fibroblastos y células del músculo liso) expresan las moléculas CD40 y CD40L.
Las interacciones CD40/CD40L son cruciales en la producción de citoquinas, metaloproteinasas y moléculas de adhesión que están normalmente presentes en el ateroma humano (33). La activación de las células T y la expresión de CD40L puede hacerse por mecanismos dependientes e independientes del antígeno.
No se han identificado inequívocamente autoantígenos en la formación de la placa, pero se ha sugerido que las LDL modificadas por la oxidación, antígenos virales y proteínas de choque térmico pueden desencadenar la activación inmune (45).
Aplicaciones
Entre las numerosas aplicaciones derivadas de la explosión en el conocimiento de las importantes funciones inmunorreguladoras de las moléculas accesorias, vale la pena destacar la manipulación de dichas moléculas en el diseño de estrategias para la lucha contra las enfermedades infecciosas y el cáncer.
En efecto, la administración conjunta de plásmidos que portan genes para la expresión de CD86 y antígenos HIV-1 produjo un incremento dramático en la inducción de linfocitos T citotóxicos y en la proliferación de células T ayudadoras, sin apreciarse cambios significativos en la respuesta inmune humoral. Esta aproximación puede ser valiosa en inmunoterapia y en el desarrollo racional de vacunas (46).
Correspondencia:
Adriano Martínez Villarreal. Laboratorio de Inmunología, Facultad de Medicina – Universidad de Antioquia. Carrera 51 D No. 62-29, oficina 206. Medellín. Teléfono: 510 60 57
E-mail: adriano@catios.udea.edu.co
Referencias Bibliográficas
- 1. Bluestone JA, Khattri R, van Seventer GA. Accesory Molecules. In: Paul WE, ed. Fundamental Immunology. Fourth Edition ed. Phildelphia: Lippincott-Raven Publishers, 1999:449-78.
- 2. Henao J, Montoya CJ. Moléculas de adhesión : bases fisiológicas y modelos fisiopatológicos para su estudio. Revista de la Asociación Colombiana de Alergia, Asma e Inmunología. 1999;8:34-40.
- 3. Sixth International Workshop on Human Leukocyte Differentiation Antigens. CD antigens: the list hits166. Immunol Today 1997;18:100-1.
- 4. Linsley PS, Ledbetter JA. The role of the CD28 receptor during Tcell responses to antigen. Annu Rev Immunol 1993;11:191-212.
- 5. Green JM, Zheng X-G, Shimizu Y, Thompson CB, Turka LA. Tcell receptor stimulation, but not CD28 costimulation, is dependent on LFA-1-mediated events. Eur J Immunol 1994;24:265-272.
- 6. Bretscher P. The two- signal model of lymphocyte activation twenty-one years later. Immunology Today 1992;13:74-76.
- 7. June CH, Bluestone JA, Nadler LM, Thompson CB. The B7 and CD28 receptor families. Immunol Today 1994;15:321-31.
- 8. June CH, Ledbetter JA, Linsley PS, Thompson CB. Role of the CD28 receptor in T-cell activation. Immunology Today 1990;11:211-16.
- 9. Woerly G, Roger N, Loiseau S, Dombrowicz D, Capron A. Expression of CD28 and CD86 by human eosinophils and role in the secretion of type 1 cytokines (interleukin 2 and interferon gamma): inhibition by immunoglobulin a complex. J Exp Med 1999;190:487-95.
- 10. Cai YC, Cefai D, Schneider H, Raab M, Nabavi N, Rudd CE. Selective CD28 pYMNM mutations implicate phosphatidylinositol 3 kinase in CD86-CD28 mediated costimulation. Immunity 1995;3:417-26.
- 11. Cefai D, Cai YC, Hu H, Rudd C. Co-stimulatory regimes differ in their dependence on phosphatidylinositol 3- kinase: common co-signals induced for CD80 and CD86. Int Immunol 1996;8:1609-16.
- 12. Cantrell D. T cell antigen receptor signal transduction pathways. Annu Rev Immunol 1996;14:259-74.
- 13. August A, Dupont B. Activation of extracellular signal- regulated protein kinase (ERK/MAP kinase) following CD28 cross-linking: activation i cell lacking p56lck. Tissue-Antigens 1995;46:155-62.
- 14. Martínez A, Montoya CJ. Transducción de señales generadas a partir del receptor antigénico de los linfocitos T. Iatreia 1999;12:168-77.
- 15. Lenschow DJ, Walunas TL, Bluestone JA. CD28/B7 System of TCell Costimulation. Annu Rev Immunol 1996;14:233-58.
- 16. Seder RA, Germain RN, Linsley PS, Paul WE. CD28 mediated costimulation of interleukin 2 (IL-2) production plays a critical role in T cell for IL-4 and interferon gamma production. J Exp Med 1994;179:299-304.
- 17. Schwartz RH. Costimulation of Lymphocytes: The Role of CD28, CTLA-4, and B7/BB1 in Interleukin-2 Production and Immunotherapy. Cell 1992;71:1065-68.
- 18. Fernandez-Ruiz E, Somoza C, Sanchez-Madrid F, Lanier LL. CD28/CTLA-4 ligands: the gene encoding CD86 (B70/B7.2) maps to the same region as CD80 (B7/B7.1) gene in human chromosome 3q13-q23. Eur J Immunol 1995;25:1453-56.
- 19. Jeannin P, Herbault N, Delneste Y, et al. Human Effector Memory T Cells Express CD86: A Functional Role in Naive T Cell Priming. J Immunol 1999;162:2044-48.
- 20. Fujihara M, Takahashi TA, Azuma M, et al. Decreased Inducible Expresion of CD80 and CD86 in Human Monocytes After Ultraviolet- B Irradiation: Its Involvement in Inactivation of Allogenecity. Blood 1996;87:2386-93.
- 21. Nuriya S, Yagita H, Okumura K, Azuma M. The differential role of CD86 and CD80 co-stimulatory molecules in the induction and the effector phases of contact hypersensitivity. Int Immunol 1996;8:917-26.
- 22. Lanier LL, O´Fallon S, Somoza C, et al. CD80 (B7) and CD86 (B70) provide similar costimulatory signals for T cell proliferation, cytokine production, and generation of CTL. J Immunol 1995;154:97-105.
- 23. Jaffar ZH, Stanciu L, Pandit A, Lordan J, Holgate ST, Roberts K. Essential role for both CD80 and CD86 costimulation, but not CD40 interactions, in allergen-induced the cytokine production from asthmatic bronchial tissue: role for alphabeta, but not gammadelta, T cells. J Immunol 1999;163:6283-91.
- 24. Ueda Y, Levine BL, Huang ML, et al. Both CD28 ligans CD80 (B7-1) and CD86 (B7-2) activate phosphatidylinositol 3 kinase and wortmannin reveals heterogeneity in the regulation of T cell IL-2 secretion. Int Immunol 1995;7:957-66.
- 25. Slavik JM, Hutchcroft JE, Bierer BE. CD80 and CD86 are not equivalent in their ability to induce the tyrosine phosphorylation of CD28. J Bio Chem 1999;274:3116-24.
- 26. Nunes JA, Battifora M, Woodget JR, Truneh A, Olive D, Cantrell DA. A comparison of B7-1 and B7-2 regulation of the MAP kinases: ERK 2 and Jun kinases. Mol Immunol 1996;33:63-70.
- 27. Penninger JM, Timms E, Shahinian A, et al. Aloreactive gamma delta thymocytes utilize distinct costimulatory signals from peripheral T cells. J Immunol 1995;155:3847-55).
- 28. Mackey MF, R.J. B, Noelle RJ. The role of CD40/CD154 interactions in the priming, diffentiation, and effector funcion of helper and cytotoxic T cell. Journal of Leukocyte Biology 1998;63:418-428.
- 29. Young LS, Eliopoulos AG, Gallagher NJ, Dawson CW. CD40 and epithelial cells: across the great divide. Immunol Today 1998;19:502-6.
- 30. Foy TM, Aruffo A, Bajorath J, Buhlmann JE, Noelle RJ. Immune Regulation by CD40 and its Ligand GP39. Annu Rev Immunol 1996;14:591-617.
- 31. Lafage-Pochitaloff M, Herman P, Birg F, et al. Localization of the human CD40 gene to chromosome 20, bans q12-q13.2. Leukemia 1994;8:1172-75.
- 32. Aruffo A, Farrington M, Hollenbaugh D, et al. The CD40 ligand, gp 39, is defective in activated T cells from patient with X-linked hyper-IgM syndrome. Cell 1993;72:291-300.
- 33. Grewal IS, Flavell RA. CD40 and CD154 in cell-mediated immunity. Annu Rev Immunol 1998;16:111-135.
- 34. Kelly TA, Jeanfavre DD, McNeil DW, et al. Cutting edge: a small molecule antagonist of LFA-1 mediated cell adhesion. J Immunol 1999;163:5173-77.
- 35. Sedwick CE, Morgan MM, Jusino L, Cannon JL, Miller J, Burkhardt JK. TCR, LFA-1, and CD28 play unique and complementary roles in signaling T cell cytoskeletal reorganization. J Immunol 1999;162:1367-75.
- 36. Salomon B, Bluestone JA. LFA-1 interaction with ICAM-1 and ICAM-2 regulates Th2 cytokine production. J Immunol 1998;161:5138-42.
- 37. Rey-Ladino JA, Huber M, Liu L, Damen JE, Krystad G, Takei F. The SH2 containing inositol-5´-phosphatase enhances LFA-1- mediated cell adhesion and defines two signaling pathways for LFA-1 activation. J Immunol 1999;162:5792-99.
- 38. Shier P, Ngo K, Fung-Leung WP. Defective CD8+ T cell activation and cytolytic function in the absence of LFA-1 cannot be restored by increased TCR signaling. J Immunol 1999;163:4826-32.
- 39. Ohteki T, Maki C, Koyasu S, Mak TW, Ohashi PS. Cutting edge: LFA-1 is required for liver NK 1.1+ TCR alpha beta+ cell. J Immunol 1999;162:3753-56.
- 40. Ni HT, Deeths MJ, Li W, Mueller DL, Mescher MF. Signaling pathways activated by leukocyte function-associted Ag-1- dependent costimulation. J Immunol 1999;162:5183-89.
- 41. O´Rourke AM, Shao H, Kaye J. A role for p21ras/MAP kinase in TCR- medited activation of LFA-1. J Immunol 1998;161:5800-03.
- 42. Buckley RH. Primary Immunodeficiency Diseases. In: Paul WE, ed. Fundamental Immunology. Philadelphia: Lippincott-Raven, 1999:1427-53.
- 43. Disanto JP, Markierwicz S, Gauchat J, Bonnefoy J, Fischer A, de Saint Basile G. Brief report: prenatal diagnosis of X-linked hyper IgM syndrome. N Engl J Med 1994;330:969-73.
- 44. Hogg N, Stewart MP, Scarth SL, et al. A novel leukocyte adhesion deficiency caused by expressed but nonfunctional beta 2 integrins Mac-1 and LFA-1. J Clin Invest 1999;103:97-106.
- 45. Laman JD, de Smet BJGL, Schoneveld A, van Meurs M. CD40-CD40L interactions in atherosclerosis. Immunology Today 1997;18:272-77.
- 46. Kim JJ, Bagarazi ML, Trivedi N, et al. Engineering of in vivo immune response to DNA immunization via codelivery of costimulatory molecule genes. Nat Biotechnol 1997;15:641-46.