CD40 y CD40L pertenecen a la familia del TNF-R y TNF respectivamente. Otros miembros representativos de la familia del TNF-R son CD30, 4-1BB, CD27, Fas y OX40. Además del CD40L, la familia del TNF incluye al TNFa, TNFb, CD30L, 4-1BBL y FasL (1).
El CD40 es una proteína integral de membrana de 40 a 45 KDa que contiene 4 dominios extracelulares ricos en cisteína de 45 aminoácidos cada uno, propios de la familia del TNF-R (1). Su expresión es ubícua, hallándose en todas las células presentadoras de antígenos (células B, células dendríticas, monocitos/macrófagos), células T, epitelio tímico, endotelio vascular, keratinocitos y fibroblastos (28).
También, se ha encontrado en varios tipos de carcinomas como el de ovario, nasofaringe, hígado, vejiga y mama (29). La cola citoplasmática del CD40 se asocia a segundos mensajeros de la familia TRAF (factor asociado al receptor del TNF), los cuales transducen vías de señales que activan los factores NF-kB, AP-1 y NF-AT con la consiguiente transcripción génica.
Dicha asociación modula la actividad de kinasas y fosfatasas que afectan el ciclo celular y regulan positivamente factores de supervivencia como bcl-2 y bcl-xL que protegen a las células B de la apoptosis (1, 30). Usando técnicas de hibridación in situ se logró localizar al gen del CD40 en el brazo largo del cromosoma 20 humano (31).
El CD40L (CD154, gp39) es una proteína integral de membrana de 32 a 39 KDa que se expresa predominantemente en linfocitos T CD4 activados, pero también se ha descrito en células T CD8, eosinófilos, mastocitos, basófilos, células asesinas naturales y células dendríticas. (28). Su gen se localiza en el brazo largo del cromosoma X humano (32).
Desde el punto de vista estructural:
CD40L forma un trímero y CD40 se une a dicho trímero en la interfase entre dos monómeros (30). Las interacciones CD40/CD40L son claves en la regulación de numerosos procesos de activación del sistema inmune; la expresión de estas moléculas en diversos tejidos así lo confirma.
En la inmunidad humoral, la unión del CD40 con el CD40L es importante en la respuesta inmune primaria y secundaria a los antígenos T dependientes, en la creación de células B de memoria y en la generación y mantenimiento de los centros germinales (30, 33).
De igual forma, las interacciones de este par ligando-receptor están involucradas en la actividad de otras células presentadoras de antígenos como las células dendríticas, donde modulan la producción de ciertas citoquinas (IL-8, MIP-1a, TNFa e IL-12) y en monocitos donde el estímulo con la proteína quimérica CD154-CD8 induce la expresión de CD54, moléculas del CMH clase II y CD40 (33).
Los estudios que han investigado el papel de las interacciones CD40/CD40L en la maduración tímica de los linfocitos sugieren que gp39 puede participar en el proceso de selección negativa sólo cuando el superantígeno usado se expresa de forma endógena. Resultados similares se obtuvieron con la utilización de ratones transgénicos (30).
Numerosos ensayos in vivo e in vitro indican que la expresión de CD154 en células T CD4 y CD8 es importante para su sensibilización, expansión y maduración hacia células efectoras capaces de producir citoquinas y tener actividad lítica (28).
También se ha encontrado que el estímulo a través del CD40 es fundamental para la maduración de las células dendríticas y las células B, y podría intervenir en el aumento de la supervivencia de las células T (28).
La coestimulación por medio de CD40/CD40L:
Regula la producción de IL-12 por las células dendríticas y macrófagos, necesaria para el desarrollo de las respuestas Th1.
Si bien no se ha observado en todos los sistemas, el bloqueo de las interacciones CD40/CD40L desvía el patrón de producción de citoquinas hacia Th2, un fenómeno que en algunos animales de experimentación mejora la sintomatología clínica de algunas enfermedades autoinmunes como la colitis, y en otros modelos como la infección por Leishmania causa susceptibilidad a la infección por este parásito intracelular (28, 33).
También se han investigado los efectos de las interacciones CD40/CD40L en el control de las funciones efectoras de algunas células inmunes.
La ligación del CD40 en monocitos es importante para la producción de IL-1a, IL-1b, TNFa, IL-6 e IL-8, así como para el rescate de los monocitos circulantes de la muerte apoptótica. En macrófagos, la unión CD40/CD40L se requiere para la producción de óxido nítrico e IL-12.
Así mismo, las células NK que expresan CD40L lisan células blanco que expresan CD40 (33). Se ha visto además que durante su expansión las células T pueden, en algunos casos, requerir la coestimulación CD40/CD40L para madurar hacia células efectoras, y que los linfocitos T efectores deben encontrar secundariamente el antígeno en el contexto de este par ligando-receptor para iniciar la secreción de citoquinas (28).
(Lea También: Enfermedades en las que se Encuentran Comprometidas las Moléculas Accesorias)
LFA-1 e ICAM-1
LFA-1, también conocida como aLb2, pertenece a la superfamilia de las integrinas. Como todas las integrinas, se expresa en la membrana en forma de un heterodímero compuesto por una subunidad a (aL ó CD11a) y una subunidad b (b2 ó CD18). LFA-1 aparece constitutivamente en todas las células de la línea linfoide y la mayoría de las mieloides, se incrementa en linfocitos después de la activación y permanece elevada (aproximadamente dos veces) en células T de memoria (1).
Al igual que las otras b2 integrinas (MAC-1, P150/95 y aDb2), LFA-1 participa en la adhesión firme de los leucocitos al endotelio de las zonas inflamadas durante el proceso de extravasación. Así mismo, LFA-1 está involucrada en la facilitación de la adhesión o la migración de las células T vírgenes y de memoria a los órganos linfoides secundarios.
Recientemente, se demostró que compuestos de bajo peso molecular, no cargados, biodisponibles por vía oral como el BIRT 377 tienen valor terapéutico potencial al inhibir los efectos adhesivos de LFA-1 (34).
Sin embargo, las integrinas no sólo funcionan mediando interacciones adhesivas, sino que también desencadenan señales de activación celular que van del exterior al interior y del interior al exterior de las células.
Dichas señales implican la fosforilación y activación de numerosos blancos intracelulares:
Que resultan en cambios de la organización del citoesqueleto y la motilidad celular, así como proliferación y producción de citoquinas (1). Sedwick y col mostraron que la unión de LFA-1 con ICAM-1 induce la polarización de la talina, una proteína de unión a la actina (35).
En lo que respecta a la producción de citoquinas, se ha visto que los sistemas de coestimulación CD28/B7 y LFA-1/ICAM tienen papeles opuestos en la regulación del desarrollo del patrón Th2, con incremento en la producción de IL-4 e IL-5 por parte del primer sistema y disminución por el segundo (36).
Se ha explorado la cascada de señalización de adentro hacia fuera, observándose que la fosfatasa 5’ inositol que contiene dominios SH2 (SHIP) puede regular dos vías de transducción de señales distintas y que su actividad fosfatasa es importante para cada unas de ellas (37).
Usando el modelo de las células T 2C, las cuales carecen de la expresión de LFA-1, se ha visto que esta integrina es esencial para la activación óptima de las células T CD8+ y su función efectora (38).
Por otra parte, Ohteki y col reportaron que LFA-1 se requiere para el desarrollo de las células NKT hepáticas, pero no para su migración y posterior establecimiento en dicho órgano (39).
ICAM-1, el ligando predominante y de mayor afinidad de LFA-1:
Es una glicoproteína con 5 dominios extracelulares tipo Ig. Se expresa en células T activadas, células B, macrófagos y células dendríticas. Es inducida en el endotelio vascular y los fibroblastos por las citoquinas proinflamatorias IL-1, IFNg y TNFa.
Usando ligandos purificados, se ha mostrado que ICAM-1 y B7.1 proporcionan coestimulación comparable para la proliferación de las células T CD8+. Y que ambos ligandos regulan positivamente las actividades de la PI-3K, esfingomielinasa y JNK.
Estas vías son distintas de las activadas por el TCR y se han implicado en la regulación positiva de la producción de IL-2 en respuesta a la interacción CD28-B7 (40, 41).
Regulación de la Expresión entre las Moléculas Accesorias
Un modelo de las interacciones finas entre las moléculas accesorias que contribuyen a la activación de los linfocitos es el siguiente (figura 3): primero, la unión del TCR con el complejo CMH-Ag en la APC, junto con LFA-1, induce la expresión de CD40L en la célula T respondedora. Seguidamente, CD40L interactúa con CD40 presente en la APC causando la regulación positiva de B7.1 y B7.2, las cuales se unen a CD28 en las células T. La ligación simultánea del TCR y CD28 lleva a la activación del linfocito T y previene la inducción de la anergia.
A su vez, el CD40L permite que la célula T provea la ayuda necesaria a los linfocitos B para la producción de anticuerpos (15, 30).
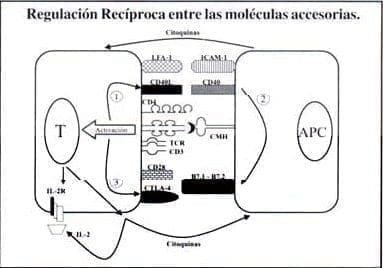
Figura 3. Señales que conducen a la activación completa de las células T y las células presentadoras de antígenos. Se requiere inicialmente de la interacción cognada (TCR-CMH-péptido) y la activación consecutiva de las distintas moléculas accesorias presentes en las membranas de ambas células, así como de las citoquinas producidas por ellas.
Uno a tres días después de la activación antigénica, CTLA-4 es regulado positivamente en las células T. Puesto que CTLA-4 tiene mayor afinidad por B7.1 y B7.2 que CD28, estos ligandos coestimuladores pueden actuar preferentemente con CTLA-4 en las células T activadas y regular negativamente la respuesta inmune, ya sea induciendo la apoptosis o compitiendo con CD28 por sus ligandos. Previniendo la regulación positiva de factores protectores como bcl-xL.