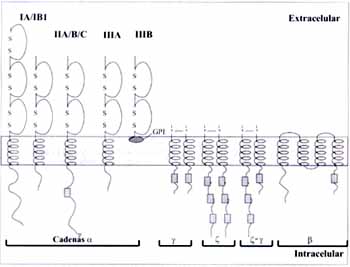
El FcgRII (CD32) es una glicoproteína de 40 kD con capacidad de unir complejos de IgG con una constante de afinidad baja. Se han identificado tres genes, FcgRIIA, B y C, localizados en el cromosoma 1q 23-24 (17), los cuales codifican para seis isoformas de este receptor FcgRIIA1, A2, B1, B2, B3 y C1 (Tabla 1 y Figura 1).
El gen FcgRIIA produce dos transcriptos distintos. La isoforma A1 es un receptor de membrana mientras que la isoforma A2 es una proteína soluble que se diferencia de la isoforma A1 solo en la falta del dominio transmembrana.
El gen B transcribe tres ARN mensajeros que codifican tres isoformas. Cada una de estas proteínas contiene dos dominios tipo inmunoglobulina, un dominio transmembrana y un dominio intracitoplasmático de longitud variable para cada isoforma. Las isoformas B2 y B3 son idénticas excepto en su secuencia líder la cual es eliminada en los receptores maduros.
Se ha propuesto que el gen FcgRIIC es el resultado de un evento de entrecruzamiento desigual ente los genes FcgRIIA y B (18). Pues la especificidad de unión de esta isoforma es parecida a la de la isoforma FcgRIIB, mientras que la señalización es similar a la que presenta el FcgRIIA (10).
Este gen C genera un trascripto único, sin embargo, no se descarta la posibilidad de que existan isoformas de este receptor. A este respecto Metes y colaboradores reportaron la presencia de cuatro transcriptos de FcgRIIC en células NK; un primer transcripto de FcgRIIC1 que corresponde a la forma previamente descrita, mientras que los otros tres (IIC2, IIC3 y IIC4) serían productos de cortes y empalmes alternativos del único ARN mensajero.
Los FcgRIIC1, IIC2 y IIC3 se expresan como proteínas transmembrana, mientras que el FcgRIIC4 parece ser una forma soluble del receptor (19).
El sitio de unión del FcgRII a la IgG:
Se ha localizado en un segmento de ocho aminoácidos en el segundo dominio extracelular, sin embargo, hay evidencias que sugieren la participación del primer dominio y de dos regiones más en el segundo dominio de este receptor (20). Por su parte, la porción citoplasmática de los FcgRII es codificada por tres exones, distinto a lo que ocurre con los FcgRI y FcgRIII.
Esto hace que los FcgRIIA y IIB sean particulares entre los receptores Fc, porque tanto la unión al ligando como la señalización pueden ser realizadas por la misma proteína. Estas porciones citoplasmáticas tienen un alto grado de heterogeneidad (21-23) y por tanto la señalización desencadenada por los receptores FcgRIIA y FcgRIIB es distinta.
El FcgRIIA interviene en la activación y liberación de mediadores inflamatorios por parte de los neutrófilos; por el contrario, el entrecruzamiento de FcgRIIB junto al BCR, genera una señal que inhibe la activación, la proliferación y la secreción de anticuerpos por el linfocito B (24).
Al igual que la cadena g, la porción citoplasmática del FcgRIIA posee motivos activadores tipo ITAM que le permiten mediar directamente la señalización intracelular; sin embargo, para llevar a cabo algunas de sus respuestas biológicas necesita de la interacción con la cadena g (25).
Por su parte el FcgRIIB contiene un único dominio de señalización ITIM esencial para la regulación negativa de las señales desencadenadas por otros FcgR en los linfocitos B (24, 26, 27).
El FcgRIIA posee dos formas alélicas codominantes que difieren en un solo aminoácido en la posición 131 del segundo dominio extracelular del receptor. Las dos formas son:
FcgRIIALR y FcgRIIAHR. La primera tiene una arginina (R) en la posición 131 (FcgRIIAR131) mientras la otra tiene un residuo de histidina (H) en la misma posición (FcgRIIAH131).
El FcgRIIAR131 interactúa con mayor afinidad con la IgG1 de ratón, por lo que originalmente fue denominado HR (por High Responder), mientras que FcgRIIAH131 se une débilmente a esta inmunoglobulina, por lo que fue llamado LR (por Low Responder). Contrario a esto, el isotipo LR (H131) es el único de los dos que une eficazmente la IgG2 humana (28).
Igualmente la unión de IgG3 humana es más eficiente a FcgRIIAH131 que a FcgRIIAR131 (29). También se ha descrito que la sustitución de un residuo de glutamina (Q) por uno de lisina (K) en la posición 127 le confiere al isotipo FcgRIIAR131 la habilidad de interactuar con la IgG2 humana; además aumenta la actividad fagocítica de monocitos y neutrófilos (30).
De otro lado, se ha descrito un segundo polimorfismo en la posición aminoacídica 27 del FcgRIIA; en esta posición se puede encontrar el aminoácido glutamina o el triptófano. Este polimorfismo parece no tener repercusión en la función del receptor (28).
(Lea También: Vasculitis y Trombocitopenia Inducida por Heparina (TIH))
FcgRIII
El FcgRIII (CD16) es una glicoproteína con un peso molecular que varía entre 50 y 80 kD dependiendo del grado de glicosilación. Este receptor es codificado por dos genes distintos, FcgRIIIA y B, ambos localizados en el cromosoma 1q23-24 (Tabla 1). Cada uno de estos genes está compuesto por cinco exones, los cuales codifican un solo trascripto por gen.
El FcgRIIIA es una molécula con dos dominios extracelulares tipo Ig, una porción transmembrana y una intracelular (31) (Figura 1).
El transcripto de la isoforma FcgRIIIB se diferencia de la isoforma A en la sustitución de diez nucleótidos y aunque la mayoría de estas diferencias no modifican la secuencia de aminoácidos, la sustitución de una fenilalanina en la posición 203 en la isoforma A por una serina en la isoforma B, tiene una consecuencia grande. Este cambio hace que el FcgRIIIB no sea una proteína integral de la membrana celular y que se una a ésta por una molécula glicosilil fosfatidil inositol (GPI).
El FcgRIIIA requiere la asociación de la cadena g o de la cadena z para su expresión en la membrana (32), sin embargo, la fagocitosis por FcgRIIIA dependiente de la cadena g es más eficiente que la mediada por la cadena z.
El FcgRIIIA interactúa tanto con IgG monomérica como con IgG agregada, mientras que el FcgRIIIB presenta baja afinidad por la IgG monomérica (33).
Se han descrito dos polimorfismos para el FcgRIIIA.
La primera variante alélica se genera por un cambio en el residuo aminoacídico 158, donde una posee valina (V) y la otra fenilalanina (F). El FcgRIIIA158V se une a IgG1, IgG3 e IgG4 con más afinidad en comparación con el alelo FcgRIIIA158F (34).
El segundo es un polimorfismo trialélico que se debe a cambios en el aminoácido 48, en el cual se puede encontrar residuos de leucina (L), histidina (H) o de arginina (R). Aparentemente este polimorfismo no altera la afinidad por las distintas subclases de IgG (35).
En el FcgRIIIB también se han identificado varias formas alélicas. Dos de ellas denominadas NA (por Neutrophil Antigen) 1 y 2.
Estas dos formas difieren en cuatro aminoácidos ubicados en el dominio extracelular del receptor, lo cual conduce a un cambio en el patrón de glicosilación de estas moléculas (35). Tanto la IgG1 como la IgG3 interactúan con mayor afinidad con el alotipo NA1 que con el NA2 (29). Recientemente se ha reportado otra forma alélica en pacientes con neutropenia aloinmune cuyos anticuerpos reconocían un antígeno en FcgRIIIB. Este aloantígeno se denominó SH, y se demostró que posee una asparagina (N) en vez de alanina (A) en la posición 60.
Es probable que el antígeno SH haya sido el resultado de un polimorfismo en el gen FcgRIIIBNA2 (36). Los neutrófilos de individuos homocigotos para la forma NA2 unen IgG3 con menos eficiencia y presentan niveles menores de fagocitosis de eritrocitos sensibilizados con anticuerpos monoclonales de isotipo IgG1 e IgG3 dirigidos contra el antígeno Rh (37).
Además, la fagocitosis de bacterias opsonisadas con IgG1 por parte de neutrófilos que expresan FcgRIIIBNA2 está reducida en comparación con los neutrófilos que expresan la isoforma NA1, pero no hay diferencias cuando las bacterias son opsonizadas con IgG2 (38).
Transducción de señales por FcgR
Las respuestas celulares asociadas con los FcgRs activadores incluyen degranulación, fagocitosis, citotoxicidad celular dependiente de anticuerpos (CCDA), rearreglos del citoesqueleto, transcripción de genes de citoquinas y sus receptores, así como síntesis y liberación de metabolitos del ácido araquidónico, histamina y de otros mediadores inflamatorios (39).
Estas respuestas dependen de una serie de señales que se transmiten al interior de las células para desencadenar diferentes cambios en el metabolismo y la expresión genética.
Tras la unión de un complejo inmune a los receptores Fcg se desencadenan una serie de señales intracitoplasmáticas que incluyen fosforilación y desfosforilación de proteínas, liberación de segundos mensajeros y activación de factores de transcripción.
En relación con este fenómeno se reconocen dos clases de FcgR; los receptores de activación, que se caracterizan por tener dominios ITAM asociados al receptor y los receptores inhibidores que están asociados o contienen dominios ITIM (40).
El entrecruzamiento de los FcgR:
En los leucocitos con la IgG desencadena una plétora de respuestas celulares que juegan papeles muy importantes en la inflamación y la inmunidad.
Después de la activación del FcgR, por el entrecruzamiento con complejos inmunes o con partículas opsonizadas, algunos residuos de tirosina de los dominios ITAM presentes en estas moléculas son fosforilados dando lugar a sitios con los que pueden interactuar tirosina quinasas de las familias Syk y ZAP-70.
La activación de estas quinasas cataliza la fosforilación y activación de distintos sustratos entre los que se incluyen: la fosfolipasa Cg (PLCg), la fosfatidilinositol-3 quinasa (PI3K), algunas proteínas intercambiadoras de GDP como Ras y proteínas quinasas activadoras de mitógenos (MAPK), entre otras.
La activación de estas proteínas lleva al aumento del calcio intracelular, a la activación de factores de transcripción y a su translocación al núcleo, lo que en última instancia conduce a un incremento de la expresión de nuevas proteínas.
Los dominios ITAM:
Están formados por dos secuencias repetidas YxxL (Tirosina, seguida por dos aminoácidos cualquiera y luego Leucina) separadas por 7 u 8 aminoácidos variables. Existen motivos ITAM en las subunidades de transducción asociadas a los FcgR (cadena g, z y b) y en el FcgRIIA.
La unión del ligando al dominio extracelular de los receptores activadores resulta en la fosforilación de los ITAMs mediada por miembros de la familia Src quinasa. A su vez estos residuos fosforilados sirven como sitios de unión para proteínas quinasas, lo cual ocurre por medio de dominios SH2. Dependiendo del tipo particular de célula activada por el FcR, participan diferentes quinasas como lck, lyn, hck, syk y ZAP70.
Los eventos tempranos inducidos por el reclutamiento de las distintas quinasas incluyen: activación de la fosfatidilinositol trifosfato quinasa lo que conduce a la producción de fosfatidilinositol trifosfato (PIP3), reclutamiento de la fosfolipasa C gamma (PLCg) y de las Tec kinasas (39). Estas señales permiten el aumento del calcio intracelular y el reclutamiento de otras proteínas como las ras y las MAPK (Mitogen-Activated Protein Kinase).
En conjunto estas señales llevan a la activación y traslocación al núcleo de diferentes factores de trascripción como son AP-1 (factores JUN y FOS asociados), el factor nuclear de células T (NFAT) y el NFkB, los que se encargan de inducir la transcripción de genes para citoquinas y sus receptores, entre otros.
Además, la activación de los receptores activa otras moléculas como las de la familia Rho, que participan en la fagocitosis junto con la PKC y las proteínas con actividad motriz (miosinas I, II, V y IX) (41) (Figura 3).
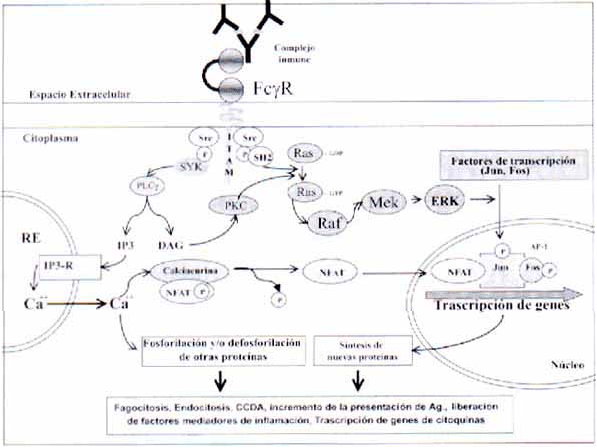
Figura 3. Mecanismos de señalización intracelular en respuesta al receptor FcgR.
Como se mencionó antes, el FcgRIIB tiene en su porción intracelular un motivo ITIM. Este receptor es expresado por linfocitos B, macrófagos, neutrófilos y mastocitos.
Las funciones de este receptor se han estudiado ampliamente en las células B donde la fosforilación de los motivos ITIM ocurre después de la unión del ligando al BCR y es requerida para su actividad inhibitoria.
Dicha fosforilación permite la activación de una molécula de señalización inhibitoria conocida como SHIP (haemopoietic-restricted Src homology 2-containing inositol 5′-phosphatase). Que conlleva a la abolición de la señal activadora de los ITAM por hidrólisis de PIP3 (42). La actividad inhibitoria de este receptor en las células B puede mediar la inhibición de la movilización de calcio generada por el BCR y por tanto la proliferación celular (24).
La fosforilación de FcgRIIB detiene la señal de proliferación del BCR al interrumpir la activación de MAPK y el reclutamiento de proteínas anti-apoptóticas como Akt (43). La ausencia de PIP3 conduce a una inhibición del influjo de calcio extracelular y por tanto a la señalización mediada por éste.
En las otras células donde se expresa este receptor, su activación inhibe la degranulación, la fagocitosis, la CCDA, la liberación de citoquinas y activación proinflamatoria (44).
FcgR y Enfermedad
Dada la cantidad de funciones que tienen los FcgR, se podría suponer que estos receptores están asociados a un gran número de enfermedades o a la susceptibilidad para desarrollarlas.
El hecho que existan distintos receptores con distribución tisular variada y que además compartan algunas funciones, explica porque no siempre aparece una alteración obvia en los individuos que evidencian defectos genéticos en los genes que codifican estos receptores.
Los datos que se tienen hasta el momento muestran que la deficiencia de alguno de los receptores no es suficiente para que haya un aumento de la incidencia de infecciones, lo que podría tener explicación en la compensación que hacen los otros FcR cuando falta alguno de ellos.
Estudios de asociación clínica que han evaluado las distintas formas alélicas de los FcgR muestran una correlación entre algunas de ellas y la susceptibilidad a algunas enfermedades.
Por ejemplo, las distintas isoformas de los receptores FcgR de baja afinidad, además de diferenciarse en sus actividades biológicas, presentan diferentes asociaciones a infecciones o enfermedades autoinmunes que a las vez varían entre los diferentes grupos étnicos (38). Las isoformas “desventajosas” de estos receptores, se han asociado con distintos cuadros clínicos, como se muestra en la Tabla 2.
Tabla 2. Relación entre las distintas formas alélicas de los FcgR conalgunos cuadros clínicos
Alelelo |
Entidades clínicas con las que existe relación |
| FcgRIIA R/R131 FcgRIIA H/H131 | Choque séptico por meningococo (44, 55, 56) Bacteremia por neumococo (57) Infección recurrente del tracto respiratorio (58) Granulomatosis de Wegener (49) LES y complicaciones renales )59, 60) Trombocitopenia inducida por heparina (50, 51, 61) Síndrome de Guillan Barre (62) Miasthenia gravis (63) Infección por Haemophilus influenzae (64) |
| FcgRIIIA F/F158 FcgRIIIA V/V158 FcgRIIIA NA2/ NA2 | Periodontitis (65) Sarcome de Kaposi en pacientes infectados por VIH (34) Artritis Reumatoide (66)Periodontitis (67) |
Infecciones por Bacterias Encapsuladas
El FcgRIIAH131 es el único de los FcgR que interactúa de forma eficiente con IgG2, y esta inmunoglobulina cumple un papel fundamental en la defensa contra las bacterias encapsuladas (por ejemplo, neumococo, meningococo y la especies invasivas de Haemophilus influenzae), de tal manera que una fagocitosis poco eficaz de estas bacterias opsonizadas con IgG2 incrementa el riesgo de infección por ellas, hecho que se evidencia en los individuos homocigotos para el alelo FcgRIIAR131 (1).
Los pacientes que presentan deficiencia de alguno de los componentes finales de la cascada del complemento no forman adecuadamente el complejo de ataque de membrana y por tanto no son capaces de lisar de forma efectiva las bacterias Gram negativas.
Estos pacientes dependen de la fagocitosis para defenderse adecuadamente de estos patógenos, lo cual los hace particularmente susceptibles a la infección por el meningococo.
Tanto la incidencia como la gravedad de la infección por este microorganismo son mayores si además los pacientes presentan los fenotipos FcgRIIAR131/R131 o FcgRIIANA2/NA2 (44).
La infección por neumococo en los pacientes con lupus eritematoso sistémico se ha asociado con el alelo FcgRIIAR131 (45).
La periodontitis es otra enfermedad que se asocia con los distintos polimorfismos de los FcgR. Se ha documentado una relación del fenotipo FcgRIIAR131 con el desarrollo de esta enfermedad de forma temprana. Mientras que los individuos homocigotos para el FcgRIIANA2 presentan mayor recurrencia de esta enfermedad (1).
Infecciones Virales
Se han publicado trabajos que demuestran como los FcgR pueden ser relevantes durante las infecciones virales. Al parecer el virus del sarampión inhibe la producción de anticuerpos al inducir una señalización mediada por el FcgRIIB en las células B (46).
De otro lado, muchos de los efectos patológicos de la infección por el virus del dengue parece estar mediada por FcgR (1, 47). Pues la presencia de anticuerpos específicos de este virus facilitan la infección de fagocitos mononucleares y por tanto potencian los cambios inmunológicos asociados a este proceso.
Lupus Eritematoso Sistémico (LES)
El LES representa el prototipo de las enfermedades autoinmunes mediadas por inmunocomplejos. El depósito de complejos inmunes en los tejidos y la subsiguiente respuesta inflamatoria son los responsables de los síntomas clínicos.
Se ha propuesto que la disminución en la eliminación de los complejos inmunes es un factor relevante en la patogénesis del LES (48). Varios estudios documentan la importancia de los polimorfismos en los FcgR y la susceptibilidad al LES; por ejemplo, se ha demostrado que los pacientes con LES tienen una mayor frecuencia del alelo FcgRIIAR131.
Además, este genotipo FcgRIIAR131 parece asociarse con una prevalencia más alta de manifestaciones como proteinuria, reducción en la depuración de creatinina, un inicio temprano de la enfermedad, anemia hemolítica autoinmune, artritis, hepatitis, linfopenia, disminución en los factores del complemento y títulos más altos de autoanticuerpos (1).
Sin embargo, estos resultados no son constantes en todos los estudios y poblaciones. Lo cual podría ser atribuido a factores como la variación en los criterios clínicos utilizados y a diferencia entre los distintos grupos étnicos (1).