Pablo Javier Patiño G, MD, MSC, PhD.
Grupo de Inmunodeficiencias Primarias
Laboratorio de Inmunología
Facultad de Medicina
Universidad de Antioquia
Medellín, Colombia
Juan Carlos Hiromi López T., estudiante de Medicina
Grupo de Inmunodeficiencias Primarias
Laboratorio de Inmunología
Facultad de Medicina
Universidad de Antioquia
Medellín, Colombia
Laboratorio de Inmunología
Facultad de Medicina, Universidad de Antioquia
Carrera 51D No. 62-29
Medellín, Colombia
Correspondencia:
Juan Carlos Hiromi López T.
jchiromi@hotmail.com
Grupo de Inmunodeficiencias Primarias
Laboratorio de Inmunología
Carrera 51 D, No.62 – 29.
Facultad de Medicina
Universidad de Antioquia
Los receptores para la porción Fc de las inmunoglobulinas de isotipo G permiten una conexión entre el sistema inmune innato y el adaptativo.
Tras la interacción de estos receptores con las inmunoglobulinas se inicia una amplia gama de respuestas biológicas, que incluyen la fagocitosis, la citotoxicidad dependiente de anticuerpos y la liberación de mediadores de la inflamación.
Se distinguen tres grupos de estos receptores: FcgRI, FcgRII y FcgRIII; todos pertenecen a la superfamilia de las inmunoglobulinas y se expresan en distintas células del sistema inmune.
Cada grupo de estos receptores es codificado por varios genes y a su vez estos presentan distintos polimorfismos, lo que se puede traducir en varias isoformas con afinidad, estructura y respuestas biológicas diferentes.
Por sus características, algunas isoformas de los receptores se han asociado a enfermedades autoinmunes e infecciosas.
El estudio de las interacciones entre los anticuerpos y sus receptores y de las vías de señalización que se desencadenan tras su interacción, es un campo de investigación intensa, pues se consideran como un blanco de intervención terapéutica con el fin de modular la respuesta inmune.
Palabras clave: Receptores Fcg, Polimorfismos, enfermedad, inmunoglobulinas
Abstract
The receptors for the Fc portion of the IgG provide a link between innate and adaptative branchs of the immune system. After the interaccion of these receptors with antibodies a wide range of biological responses begin, that include phagocytosis, antibody dependent cellular cytotoxicity and relase of inflammatory mediators.
There are three diferents groups of these receptors: FcgRI, FcgRII and FcgRIII.These FcRs belong to the immunoglobulin superfamily and they are expressed in different cells of the immune system.
Each group of these receptors are encoded by several genes and these display different polymorphisms, which can be translated in several isoforms with different affinity, structure and biological activity.
The expression of some isoforms of these receptors have been associated to autoimmune and infectious diseases.
The study of the interactions between antibodies and their receptors and the signal transduction that is triggered after their interaction is an area of intense research. These biological phenomenons are considered possible target for therapeutic intervention in order to modulate the immune response.
Key words: Fcg receptors, polymorphisms, disease, immunoglobulins.
Introducción
En los seres humanos, como en todos los organismos multicelulares, es indispensable un sistema dinámico de comunicación entre las células para garantizar su supervivencia y homeostasis.
Dicha comunicación depende de la interacción específica entre una variedad muy amplia de moléculas.
La unión de una molécula a su receptor específico en la membrana celular inicia una cadena de reacciones intracelulares que culminan con una respuesta celular.
En el sistema inmune se encuentran distintas formas de comunicación intercelular mediadas por diferentes tipos de receptores y ligandos.
Por ejemplo, encontramos comunicaciones por contacto directo célula-célula, como ocurre durante la interacción del receptor de célula T (TCR) y el complejo mayor de histocompatibilidad (CMH) o durante la interacción de los leucocitos y el endotelio vascular mediada por moléculas de adhesión.
La comunicación intercelular también puede ser llevada a cabo por moléculas secretadas por una célula que actúan sobre un receptor específico ubicado en la misma célula o en otra distante, como es el caso de las citoquinas que se encargan de activar respuestas biológicas diversas, que van desde la proliferación celular a la diferenciación en células con una potente actividad efectora.
La eficacia de la respuesta inmune depende en gran medida de las interacciones que se establecen entre los sistemas inmune innato y adaptativo.
A su vez, esta respuesta depende de varios mecanismos, entre los que se encuentran las interacciones entre los anticuerpos y los receptores para la porción Fc (FcRs) de estas moléculas.
Células Hematopoyéticas
Los FcRs son glicoproteínas de membrana que se expresan en todas las células hematopoyéticas a excepción de los eritrocitos y son esenciales para los mecanismos efectores de los anticuerpos.
Una vez han reconocido al antígeno, los anticuerpos interactúan con estos receptores para activar las distintas células efectoras que hacen parte de los mecanismos de defensa del organismo.
Por tanto, la interacción entre los anticuerpos y sus receptores Fc en los leucocitos es de gran importancia para obtener una pronta eliminación del antígeno. Así mismo tienen un papel fundamental en la regulación de la respuesta inmune.
La interacción de estos receptores con las inmunoglobulinas desencadena múltiples respuestas entre las que se incluyen la fagocitosis, la citotoxicidad celular dependiente de anticuerpos (CCDA), la liberación de factores mediadores de inflamación y el incremento de la presentación de antígenos.
Generalidades
Los receptores para las IgG, conocidos como FcgR, están expresados en una amplia variedad de células, incluidos los leucocitos tanto del linaje linfoide como mieloide, células endoteliales, tejido placentario, células sinoviales y mesangiales.
Genética y estructuralmente se distinguen dos grupos de FcgR. Las células endoteliales, el sincitiotrofoblasto placental y el epitelio del tracto digestivo de los neonatos de algunas especies de mamíferos expresan un grupo de FcgR, el cual participa del transporte de IgG de las madres a sus fetos y protegen a la IgG del catabolismo proteico.
Este tipo receptores consisten en una cadena similar a la cadena pesada del complejo mayor de histocompatibilidad tipo I (CMH I), e igual que ésta se complementa con la b2 microglobulina (1).
Por su parte, los FcgR presentes en los leucocitos pertenecen a la superfamilia de las inmunoglobulinas y existen tanto como receptores de membrana como moléculas solubles; estas formas solubles son producidas por procesamiento alternativo de los transcriptos de los FcR o por proteólisis de los receptores de membrana (2).
Los FcR hacen parte de los inmunorreceptores, entre los que se encuentra el receptor de células B (BCR), el cual se encuentra en las membranas de los linfocitos B y permite el reconocimiento de antígenos nativos, y el receptor de células T (TCR), presente en la superficie de los linfocitos T y que reconoce péptidos presentados por el complejo mayor de histocompatibilidad (CMH) clase I o II.
Mientras que el TCR y el BCR tienen una distribución clonal, los FcR tienen una amplia distribución en las células mieloides y linfoides, además una única célula puede presentar más de un tipo de FcR.
Además de los receptores para la porción cristalizable de la IgG:
Que son los más comunes y mejor estudiados, existen receptores que se unen a Fc de otros isotipos de inmunoglobulinas. Dependiendo del isotipo de inmunoglobulina al que se una al receptor Fc se le asigna la letra del alfabeto griego que corresponde a ese isotipo, así: FcgR, receptor para IgG; FcaR, receptor para IgA; FcdR, receptor para IgD; FceR, receptor para IgE y FcmR, receptor para IgM (3).
Según la afinidad con la que la inmunoglobulina se une al receptor, los FcR se clasifican como receptores de alta afinidad o de baja afinidad.
Los de alta afinidad se unen a inmunoglobulinas monoméricas y por convención se denominan FcRI. Mientras que los de baja afinidad se unen a inmunoglobulinas que interactúan con antígenos multivalentes y se denominan FcRII y FcRIII. Existen receptores de alta afinidad para IgA, IgE e IgG.
De baja afinidad hay del tipo FcRII para IgE e IgG y del tipo FcRIII solo para IgG. Además de esta nomenclatura los FcR se les ha asignado en el humano un número CD (Cluster of differentiation) y son usados como marcadores fenotípicos de poblaciones celulares; de tal forma que a FcgRI, FcgRII, FcgRIII, FcaRI y FceRII les corresponden las siguientes denominaciones CD64, CD32, CD16, CD89 y CD23, respectivamente.
Los genes que codifican para estos receptores se denominan igual que su producto, pero su escritura se hace con letras itálicas. Por ejemplo los genes de los receptores de inmunoglobulina G se denominan: FcgRI, FcgRII y FcgRIII.
Si existe más de un gen que codifica para receptores de un mismo isotipo de inmunoglobulina, se deben diferenciar con letras mayúsculas que se colocan después del número romano que indica la afinidad.
Cuando un mismo gen produce más de una isoforma:
Éstas se deben indicar con un número arábigo a continuación de la letra que indica el gen que lo codifica.
A los genes con distintas formas alélicas se hace referencia con un superíndice que lo señala, tanto en el gen como en el producto proteico.
Distintos polimorfismos determinados genéticamente han sido descritos para los diferentes FcgR, algunos polimorfismos funcionales de estos receptores se han asociado y podrían contribuir como factores de riesgo o de susceptibilidad a enfermedades infecciosas o autoinmunes como se discutirá más adelante.
Receptores FcgFcgR)
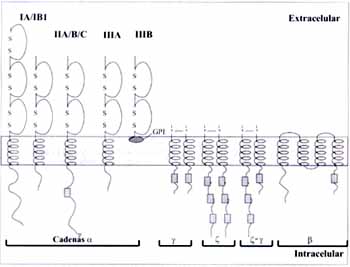
La estructura básica de los FcgR consiste en una cadena que une el ligando denominada cadena a, cuya porción extracelular se compone de 2 ó 3 dominios tipo Ig; posee además una porción transmembrana y una región intracitoplasmática que varía de tamaño según el FcgR.
En general las porciones intracitoplasmáticas de las cadenas a carecen de motivos que les permitan realizar la señalización intracelular por lo tanto, para la transducción de señales requieren la asociación con otras cadenas que posean esta capacidad.
Estas subunidades son denominadas g, z y b. Las cadenas g y z fueron originalmente identificadas como parte del FceRI y del TCR, respectivamente.
Ninguna de estas cadenas accesorias pertenece a la superfamilia de las inmunoglobulinas. Las cadenas g y z pueden estar presentes en la membrana como homodímeros o heterodímeros (1).
La cadena g se expresa en varias células del linaje linfoide. Esta subunidad tiene 5 aminoácidos en su dominio extracelular, 21 en el transmembrana y 42 en el intracitoplasmático.
El dominio intracitoplasmático de los FcgRIIIA y FcgRIA contiene una secuencia de retención que evita que el receptor sea ubicado en la membrana si no se ha asociado previamente a la cadena g en el retículo endoplásmico (4, 5).
De otro lado, la molécula b se expresa específicamente en mastocitos (6) donde se encuentra asociada al FcgRIIIA; sin embargo, esta cadena b no es necesaria para la expresión del FcgRIIIA, pues no se ha encontrado asociado a él en otras células.
Aunque la cadena a de FcgRIIA tiene motivos con la capacidad de mediar la señalización intracelular, también se asocia a la cadena g en algunas líneas celulares (7) (Figura 1).
Los mecanismos de transducción de señales activados por los FcgR:
Dependen de motivos ITAM (motivos de activación en inmunorreceptores basados en tirosina) o ITIM (motivos de inhibición en inmunorreceptores basados en tirosina) presentes en las porciones citoplasmáticas de los receptores o de las cadenas accesorias al receptor. El FcgRIIB es el único de estos
receptores que contiene en su porción citoplasmática un ITIM, el cual le permita modular de forma negativa la señalización realizada a través de los ITAM, lo cual se discutirá más adelante.
A continuación se hará una descripción de las características estructurales y funcionales mas relevantes de los FcgR.