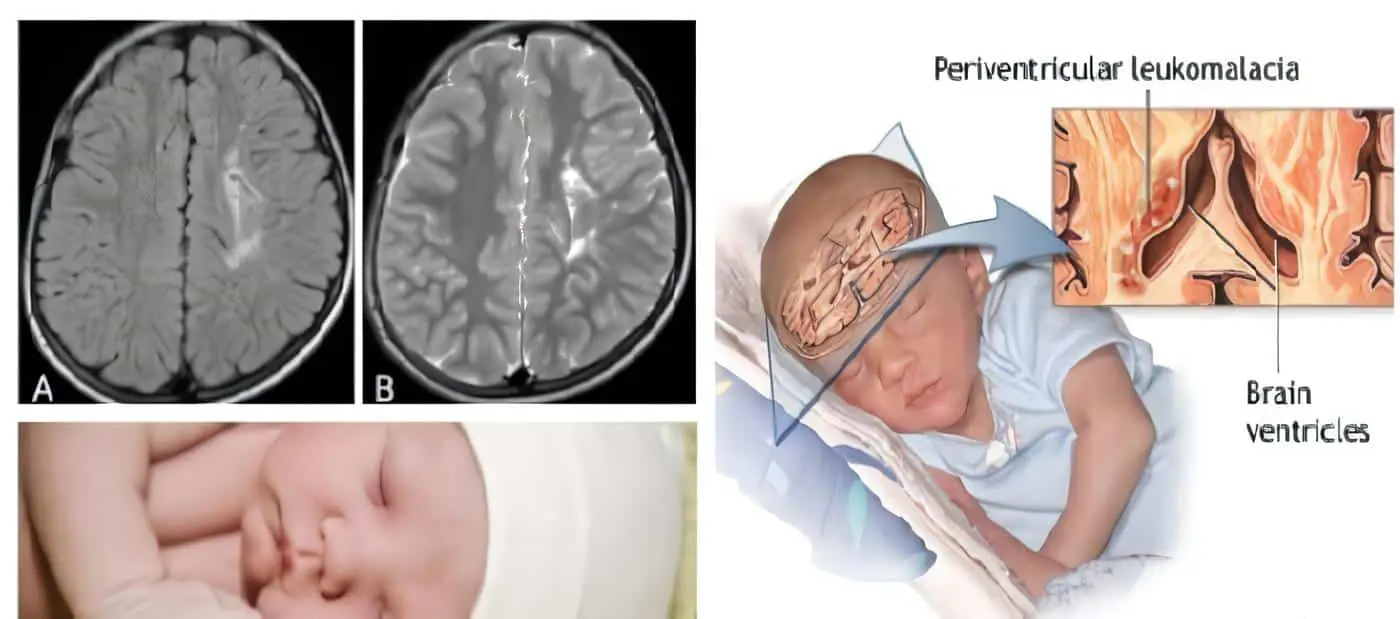
La leucomalacia periventricular es una afección que afecta el cerebro de los recién nacidos prematuros, donde se produce una degeneración de la materia blanca cerca de los ventrículos cerebrales. Esto puede causar problemas neurológicos y de desarrollo en los bebés afectados. La presencia de VIH en un recién nacido prematuro complica aún más la situación, ya que el VIH puede afectar el sistema inmunológico y aumentar la susceptibilidad a otras enfermedades e infecciones.
Resumen leucomalacia periventricular
Consta de una necrosis de la sustancia blanca periventricular adyacente a los ángulos externos de los ventrículos laterales. Es la principal lesión isquémica cerebral de los prematuros. Los cuadros patológicos incluyen lesiones focales y difusas. Se inicia como áreas focales de necrosis de coagulación, seguido por infiltración de la microglia y proliferación astrocitaria.
Por último las bandas de gliosis forman áreas de pérdida de mielina y agrandamiento secundario de los ventrículos laterales. Si la necrosis es extensa ocurren lesiones quísticas formadas en el sitio de las lesiones. Luego con el tiempo disminuirán de tamaño según la progresión de la gliosis. Pueden ocurrir hemorragias secundarias.
Por lo que la lesión afecta fibras de la región de extremidades inferiores de la corteza motora, la secuela clínica es la diplejía espástica. Con extensiones laterales de la lesión se involucrarán los brazos resultando en cuadriplejía espástica.
Otras posibles secuelas son los déficit visuales posiblemente relacionados con compromiso de las radiaciones ópticas. La incidencia de leucomalacia periventricular es incierta. Pero se ha descrito que aproximadamente entre el 25 al 40% de los niños con muy bajo peso que murieron evidenciaron esta lesión.
Solo el 30-40% de las lesiones fueron detectadas por TAC y se detectan solo si las lesiones son de >0,5 cm de diámetro presentadas usualmente como quistes bilaterales adyacentes a los ángulos externos de los ventrículos laterales. Eventualmente los quistes resuelven y el agrandamiento ventricular se presenta.
Se pueden ver al nacer por lesiones in útero o a la segunda o tercera semana de vida postnatales (8). La etiología de la leucomalacia periventricular es incierta. La antenatal se ha asociado con RCIU, gestaciones múltiples, oligo-hidramnios, o uso materno de cocaína durante el embarazo.
Eventos perinatales asociados con leucomalacia periventricular
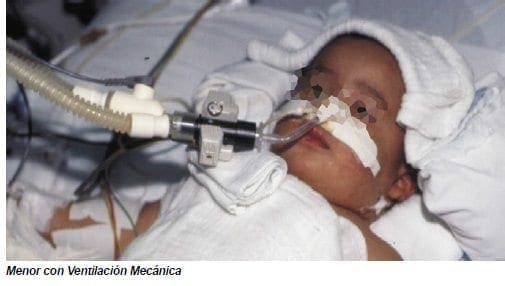
Incluyen ruptura prolongada de membranas, corioamnionitis materna, hemorragia periparto, sepsis neonatal, hipocapnia asociada con ventilación mecánica y apneas recurrentes y bradicardia.
Por lo que no hay un tiempo óptimo para detectarla se debe realizar TAC en niños de alto riesgo antes de la salida del hospital.
Si hay quistes o dilatación ventricular se deben realizar evaluaciones del neurodesarrollo para paresia espástica, lesión visual, o déficit intelectual.
Clasificación de la leucomalacia periventricular
Por muchos años se ha utilizado la clasificación descrita originalmente por la Dra. Papile (8).
Hemorragia leve
-Grado I: Hemorragia aislada de la matriz germinal.
-Grado II: Hemorragia intraventricular con tamaño ventricular normal.
Hemorragia moderada
-Grado III: Hemorragia intraventricular con dilatación ventricular aguda.
Hemorragia severa
GradoIV: hemorragia intra-ventricular con hemorragia parenquimatosa.
Presentación clínica de la leucomalacia periventricular
Es diversa. Puede ser asintomática o presentar síntomas como fontanela abombada, caída súbita del hematocrito, apnea, bradicardia, acidosis, convulsiones, cambio en el tono muscular, o en los niveles de conciencia.
Un síndrome catastrófico esta caracterizado por rápida producción de estupor y coma, anormalidad respiratoria, convulsiones tónicas, postura de descerebración, pupilas fijas a la luz, ojos fijos a la estimulación vestibular y cuadriparesia flácida.
Los síntomas y los signos pueden semejar otros desórdenes comunes neonatales como disturbios metabólicos, asfixia, sepsis o meningitis.
Un dx basado en síntomas clínicos es inadecuado:
Infantes dx con HIV confirmado con TAC, solo en el 60% de los casos fueron predichos en base a criterios clínicos.
Infantes sin HIV documentada con TAC, 25% tuvieron juicio de HIV por criterio clínico.
Diagnóstico de la leucomalacia periventricular
Por lo que es difícil realizar el diagnóstico únicamente por clínica se recurre a imágenes y paraclínicos.
Lea También: Tratamiento Específico de la Hemorragia Periventricular e Intraventricular
Laboratorio
El examen del LCR es normal en cerca del 20% de niños con HIV.
El LCR puede mostrar elevación de las células rojas y blancas, con elevación de las proteínas e incluso disminución posterior de la glucosa por lo que en ocasiones se puede confundir con LCR traumático o infeccioso. El cultivo negativo descarta meningitis (8).
Estudios radiológicos en leucomalacia periventricular
La ecografía es el estudio más utilizado. Se usa la fontanela anterior como ventana para la detección de la HIV. La ventaja mayor es que es portátil y se lleva el equipo hasta la cama del RN.
Desventajas incluyen que no detecta pequeñas cantidades de sangrado en los ventrículos laterales, especialmente si estos son de tamaño normal, y que no distingue pequeñas hemorragias subependimarias de la matriz germinal.
Tiene especificidad y sensibilidad altas suficientes para garantizar su uso como la técnica de elección para el diagnóstico de la HIV. El tiempo óptimo para realizarla es a los siete días de edad. Si es normal no se requieren otros estudios.
Se detecta HIV se debe realizar nueva ecografía a las dos semanas para valorar la extensión de la hemorragia y presencia de dilatación ventricular. Si está presente, una ecografía semanal será útil para detectar si la dilatación ventricular es transitoria, estática o progresiva.
Un TAC de seguimiento posterior será requerido para diagnosticar leucomalacia periventricular u otras lesiones asociadas.
Escreening para ecografía transfontanelar cerebral
Se deben tener en cuenta los siguientes aspectos:
- Debe realizarse en todos los menores de 1500 gramos al nacer.
- En niños mayores está indicada si hay factores de riesgo, evidencia de hipertensión endocraneana o hidrocefalia.
- La edad óptima del dx de HIV es entre los 4 a 7 días de vida, y para el seguimiento a los 14 días.
- La edad óptima para el dx de hidrocefalia es a los 14 días con seguimiento hasta los 3 meses.
- La RMN es una alternativa aceptable, pero es más costosa y más compleja. Tambien el traslado del paciente interfiere con el estudio y hace difícil su realización en el neonato.
Prevención y tratamiento de la leucomalacia periventricular
Por la etiopatogénesis multifactorial, no existe la medida única para la prevención o el tratamiento de la HIV.
Estrategias de prevención antenatal, prevención del parto prematuro
Al disminuir los partos prematuros y prevenir la ocurrencia de asfixia perinatal se pueden evitar muchos de los casos de HIV.
Otras medidas antenatales
El monitoreo fetal óptimo para la detección de la asfixia fetal en forma temprana con la instauración del manejo apropiado, pueden asegurar el nacimiento del prematuro en condiciones óptimas.
Fase activa del parto y vía del parto
Los reportes sugieren una mayor incidencia de HIV temprana con la fase activa del parto por vía vaginal.
Sin embargo, el efecto negativo se atenúa por la aplicación de fórceps de salida, lo que permite realizar una transición controlada del expulsivo. El parto por cesárea con fase latente o sin trabajo de parto parece proteger contra la ocurrencia de la HIV temprana al compararla con parto vaginal sin fórceps.
Sin embargo, aún en la ausencia de fase activa del parto, la cesárea no ha demostrado protección contra la HIV tardía (3).
Tipo de anestesia y riesgo de HIV
Se ha reportado una mayor incidencia de HIV cuando se usa anestesia general durante la cesárea respecto a la anestesia epidural probablemente debido a un mayor compromiso de la circulación fetoplacentaria en la primera (15).
Agentes farmacológicos antenatales
Aunque se han considerado diferentes estrategias para la prevención farmacológica de la HIV hasta el momento presente no existe una terapia con aceptación general y evidencia científica sólida.
-Vitamina K. Un estudio aleatorizado en menores de 32 semanas mostró una reducción de la HIV del 36 al 16%, con una mejoría significativa en el tiempo de protrombina. Sin embargo, estudios de mayor tamaño, con medición de los factores de coagulación fetales son necesarios para corroborar estos resultados (16).
-Fenobarbital. Aun cuando inicialmente se sugirió que podría ser útil para la prevención de la HIV un estudio reciente multicéntrico prospectivo aleatorizado de la red neonatal del NICHD no mostró efecto protector con la administración del medicamento (7).
-Esteroides antenatales. Por el efecto de maduración sobre el pulmón en desarrollo, al prevenir el síndrome de distres respiratorio, se disminuye el riesgo de HIV. Por otra parte en forma directa promueven la maduración de los vasos de la matriz germinal, de la barrera hematoencefálica, y favorecen la proliferación y diferenciación celular y la regulación de neurotransmisores.
La evidencia muestra que los esteroides antenatales disminuyen el riesgo de HIV especialmente de los grados severos III y IV (10). La incidencia de HIV temprana se disminuye aún más cuando los esteroides antenatales se usan en conjunto con parto por cesárea (14).
Estrategias de prevención/intervención postnatal medidas postnatales preventivas y de soporte
Entre las medidas efectivas se incluyen:
Mantener una adecuada perfusión cerebral y ventilación pulmonar con un estado ácido base neutro con adecuada PaO2 y PaCO2; el manejo de osmolalidades normales; el evitar la fluctuación de las presiones venosas o arteriales (hipotensión o picos de hipertensión o los volúmenes de expansión rápidos); la prevención de la ocurrencia de síndrome de escape de aire (neumotórax y otros); el limitar la manipulación y los procedimientos agresivos; el manejo adecuado de las alteraciones de la coagulación (trombocitopenia o CID); si se sospecha actividad convulsiva su control mediante medicación anticonvulsivante.
Medidas parmacológicas postnatales
-Pancuronio
Se han publicado estudios mediante parálisis en las primeras 72 horas de vida en prematuros extremos con enfermedad de membrana hialina severa. Pacientes ventilados que tuvieron amplias fluctuaciones de la presión arterial y de los parámetros del LCR.
Se observó una disminución en la frecuencia y severidad de la hemorragia. Sin embargo, aproximadamente el 30% de los niños tratados con pancuronio desarrollaron HIV después de cesar la parálisis.
En niños extrema-damente inmaduros se ha asociado con efectos adversos severos, incluyendo edema y falla renal por lo cual no se aconseja su uso rutinario.
-Indometacina
Un meta-análisis de los estudios concluye que su uso está asociado con una significativa disminución en la frecuencia y severidad de la hemorragia en prematuros a quienes se les suministró la droga 24 horas después del nacimiento (13).
La valoración del neurodesarrollo hacia los 4 a 5 años de edad demostró que a pesar de la baja frecuencia de la HIV, los niños que recibieron indometacina tuvieron la misma rata de resultados adversos neuro-motores que los controles. Un estudio aleatorizado colaborativo reciente documentó una reducción significativa en la incidencia de HIV a una dosis baja (0,1 mg/kg/día x 3 días).
Sin embargo, por otra parte el uso de indometacina profiláctica pudiera aumentar la incidencia de enterocolitis necrotizante, enfer-medad pulmonar crónica o incluso de parálisis cerebral, aspectos que han limitado su uso actual (5).
-Ethamsilato
Aunque los estudios iniciales mostraron disminución en la frecuencia de la HIV, el estudio multicéntrico reciente del grupo de estudio europeo, que reclutó 334 prematuros menores de 32 semanas no mostró impacto ni en la frecuencia ni en la severidad de la HIV (6) (11).
-Vitamina E
Su efecto neuroprotector se relaciona con su propiedades antioxidantes potentes. Por actuar como barredor de radicales libres, la vitamina E protege las células endoteliales de la matriz germinal de las lesiones hipoxico-isquemicas (9).
Aún cuando un estudio demostró una disminución en la frecuencia de HIV moderada o severa el grupo control presentó una frecuencia excesivamente alta de HIV (12). Otros estudios no han mostrado beneficio (2).
-Vitamina K
Estudios recientes fallaron en mostrar efecto benéfico sobre la frecuencia o severidad de la HIV.
-Fenobarbital postnatal
La mayoría de los estudios no han demostrado una reducción en la frecuencia o severidad de la HIV (3).
Preguntas frecuentes
¿Cómo se ve la leucomalacia periventricular?
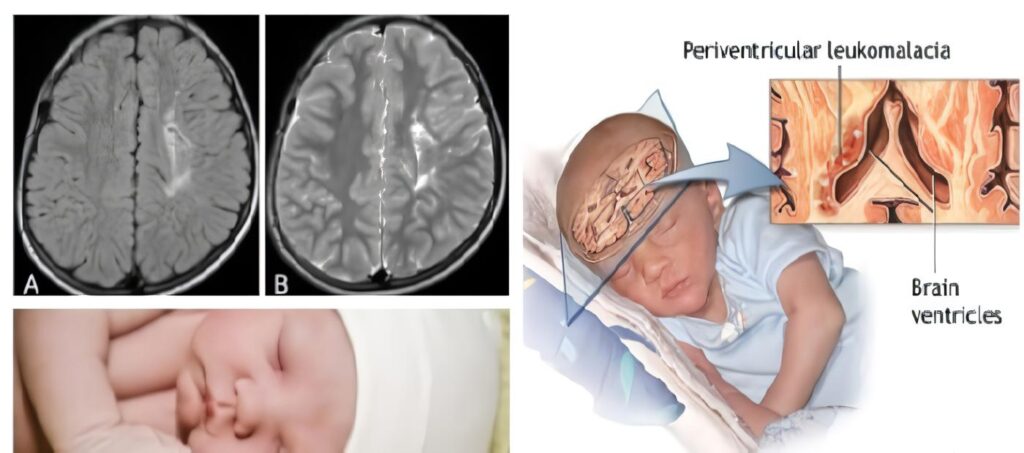
La leucomalacia periventricular generalmente no se puede ver a simple vista, ya que afecta principalmente la materia blanca del cerebro, que no es visible externamente. Sin embargo, en estudios de neuroimagen como la resonancia magnética (RM) o la ecografía cerebral, se pueden observar áreas de lesión o daño en la materia blanca cerca de los ventrículos cerebrales.
Estas lesiones aparecen como áreas de hipointensidad en la resonancia magnética y como áreas hipoecoicas en la ecografía cerebral. La leucomalacia periventricular se caracteriza por la formación de quistes periventriculares, lo que puede ser visible en estos estudios de neuroimagen.
Además, los síntomas clínicos que pueden indicar la presencia de leucomalacia periventricular incluyen retrasos en el desarrollo, problemas de tono muscular, convulsiones y discapacidades motoras o cognitivas.
¿Cómo son los niños con leucomalacia periventricular?
Los niños con leucomalacia periventricular pueden presentar una variedad de síntomas y características, dependiendo de la gravedad y la extensión del daño cerebral. Por ejemplo:
Retrasos en el desarrollo motor y cognitivo: pueden tener dificultades para alcanzar hitos del desarrollo, como sentarse, gatear, caminar o hablar.
Problemas de tono muscular: pueden tener músculos rígidos (hipertonía) o débiles (hipotonía), lo que puede afectar su capacidad para moverse y controlar sus movimientos.
Problemas de coordinación y equilibrio: pueden tener dificultades para coordinar sus movimientos y mantener el equilibrio, lo que puede afectar su capacidad para realizar actividades motoras finas y gruesas.
Convulsiones: algunos niños con leucomalacia periventricular pueden experimentar convulsiones, que son episodios de actividad eléctrica anormal en el cerebro que pueden provocar movimientos involuntarios, pérdida de conciencia o cambios en el comportamiento.
Problemas sensoriales: pueden experimentar dificultades con la percepción sensorial, como sensibilidad táctil, visual o auditiva.
Discapacidades cognitivas: pueden presentar dificultades en áreas como la atención, la memoria, el razonamiento y el aprendizaje.
Es importante tener en cuenta que la presentación clínica de la leucomalacia periventricular puede variar ampliamente de un niño a otro. El pronóstico también puede depender de otros factores, como la intervención temprana, el acceso a la terapia y el apoyo médico adecuado.
¿Qué es leucomalacia cerebral neonatal?
La leucomalacia cerebral neonatal es una afección que afecta el cerebro de los recién nacidos, especialmente los prematuros. Se caracteriza por la muerte o la degeneración de las células nerviosas en la sustancia blanca del cerebro, especialmente alrededor de los ventrículos cerebrales, que son las cavidades llenas de líquido en el cerebro.
Esto puede ocurrir debido a la falta de oxígeno o flujo sanguíneo insuficiente hacia el cerebro, lo que puede suceder durante el parto prematuro o debido a otras complicaciones neonatales.
La leucomalacia cerebral neonatal puede tener consecuencias graves en el desarrollo neurológico del niño afectado. Puede resultar en retrasos en el desarrollo motor y cognitivo, convulsiones, problemas de tono muscular, dificultades en la coordinación y equilibrio, así como discapacidades sensoriales y cognitivas.
Los bebés prematuros tienen un mayor riesgo de desarrollar leucomalacia cerebral neonatal debido a la inmadurez de su sistema nervioso central y otros factores relacionados con su nacimiento prematuro, como la exposición a infecciones, la hipoxia (falta de oxígeno) y la hipoperfusión (flujo sanguíneo reducido).
El diagnóstico de la leucomalacia cerebral neonatal generalmente se realiza mediante estudios de neuroimagen, como la resonancia magnética cerebral, que pueden revelar áreas de lesión o daño en la sustancia blanca del cerebro. El tratamiento se centra en la gestión de las complicaciones y en la intervención temprana para ayudar al niño a alcanzar su máximo potencial de desarrollo.
¿Qué provoca la leucomalacia?
La leucomalacia cerebral, ya sea neonatal o en otros casos, puede ser causada por diversos factores que afectan el suministro de oxígeno y nutrientes al cerebro, especialmente durante el período prenatal o neonatal. Algunas de las causas y factores de riesgo comunes son:
Prematuridad: los bebés prematuros tienen un mayor riesgo de desarrollar leucomalacia cerebral debido a que su sistema nervioso central está menos desarrollado y son más susceptibles a lesiones cerebrales debido a la falta de oxígeno y flujo sanguíneo insuficiente durante el parto prematuro.
Hipoxia-isquemia: la falta de oxígeno y/o flujo sanguíneo insuficiente al cerebro, conocida como hipoxia-isquemia, es una causa importante de leucomalacia cerebral. Esto puede ocurrir durante el parto, especialmente en casos de complicaciones como sufrimiento fetal, placenta previa, desprendimiento prematuro de la placenta, o en casos de parto prolongado o complicado.
Infecciones intrauterinas: algunas infecciones maternas durante el embarazo, como la infección por citomegalovirus (CMV) o la toxoplasmosis, pueden aumentar el riesgo de leucomalacia cerebral en el feto.
Factores maternos: factores maternos como la preeclampsia, la eclampsia o el consumo de drogas o alcohol durante el embarazo pueden aumentar el riesgo de leucomalacia cerebral en el feto.
Lesiones cerebrales traumáticas: lesiones cerebrales traumáticas durante el parto, como el uso de fórceps o ventosas, pueden aumentar el riesgo de leucomalacia cerebral.
Factores genéticos: algunas condiciones genéticas y trastornos metabólicos pueden aumentar el riesgo de leucomalacia cerebral en ciertos individuos.
Es importante destacar que la leucomalacia cerebral puede ser multifactorial y que en muchos casos pueden estar involucrados múltiples factores de riesgo simultáneamente. El cuidado prenatal adecuado y la atención médica especializada durante el parto y el período neonatal pueden ayudar a prevenir o mitigar el riesgo de leucomalacia cerebral en los recién nacidos.
¿Cómo se detecta la leucomalacia?
La leucomalacia cerebral se detecta principalmente a través de estudios de neuroimagen y evaluaciones clínicas como:
Resonancia magnética (RM) cerebral: la resonancia magnética es una herramienta de diagnóstico muy útil para detectar lesiones en el cerebro, incluyendo la leucomalacia. La RM puede mostrar áreas de degeneración o muerte de la materia blanca cerebral, especialmente alrededor de los ventrículos cerebrales.
Ecografía cerebral: en el caso de recién nacidos, la ecografía cerebral puede ser una herramienta útil para detectar la leucomalacia cerebral. Se puede realizar una ecografía transfontanelar, que utiliza una sonda de ultrasonido colocada a través de la fontanela (abertura en el cráneo de un bebé), para examinar las estructuras cerebrales y detectar anomalías, incluidas las lesiones de la leucomalacia.
Evaluación clínica: los médicos también pueden realizar una evaluación clínica del bebé para detectar posibles signos y síntomas de leucomalacia cerebral. Esto puede incluir observar el desarrollo motor, el tono muscular, la coordinación, la respuesta a estímulos y otros aspectos del funcionamiento neurológico del bebé.
Es importante destacar que el diagnóstico de leucomalacia cerebral a menudo implica una combinación de estos métodos. La resonancia magnética cerebral es la herramienta de diagnóstico más precisa y detallada, pero la ecografía cerebral puede ser útil en el caso de recién nacidos debido a su disponibilidad y facilidad de uso.
Además, la evaluación clínica es importante para detectar cualquier signo o síntoma de leucomalacia cerebral que pueda no ser evidente en los estudios de neuroimagen.
¿Cómo pueden afectar las lesiones cerebrales en la vida?
Las lesiones cerebrales pueden tener una variedad de efectos en la vida de una persona, dependiendo de factores como la ubicación, el tamaño y la gravedad de la lesión, así como la edad en la que ocurrió y el tratamiento recibido. Algunos de los efectos potenciales de las lesiones cerebrales son:
Problemas cognitivos: las lesiones cerebrales pueden afectar funciones cognitivas como la memoria, la atención, el lenguaje, el razonamiento y la resolución de problemas.
Dificultades motoras: dependiendo de la ubicación de la lesión, puede haber problemas con el control motor, la coordinación y la movilidad.
Problemas sensoriales: las lesiones cerebrales pueden afectar la percepción sensorial, incluida la vista, el oído, el tacto y el gusto.
Cambios emocionales y conductuales: las lesiones cerebrales pueden afectar la regulación emocional y el comportamiento, lo que puede manifestarse en cambios de humor, irritabilidad, impulsividad, ansiedad, depresión u otros problemas emocionales.
Discapacidades físicas: las lesiones cerebrales graves pueden causar discapacidades físicas, como parálisis, dificultades para tragar o problemas de control de la vejiga y los intestinos.
Impacto en la vida diaria: las lesiones cerebrales pueden afectar la capacidad para llevar a cabo actividades de la vida diaria, como vestirse, comer, bañarse, trabajar o conducir.
Cambios en las relaciones interpersonales: los cambios en el comportamiento y la capacidad para comunicarse pueden afectar las relaciones con familiares, amigos y cuidadores.
Necesidades de atención a largo plazo: algunas personas con lesiones cerebrales pueden necesitar cuidados a largo plazo, rehabilitación y apoyo continuo para mantener la funcionalidad y la calidad de vida.