RESULTADOS
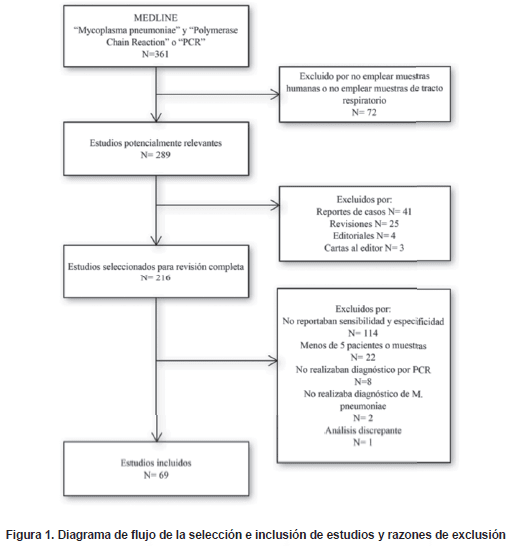
De 361 referencias se seleccionaron 97 artículos para su revisión completa. De estos, 28 artículos reportaron datos insuficientes para calcular la sensibilidad y especificidad de la PCR para el diagnóstico de M. pneumoniae.
Un total de 69 estudios publicados entre noviembre de 1989 hasta Junio de 2009 cumplieron con los criterios de inclusión para el meta-análisis (5,20-87).
El criterio más frecuente de exclusión de los estudios fue la insuficiencia de datos para calcular la sensibilidad y especificidad (42%); seguido de artículos que eran revisiones, comentarios, cartas o reporte de casos (25%), estudios que no utilizaron muestras respiratorias (24%), estudios con resultados de menos de 10 pacientes o muestras (7,5%) y estudios con análisis discrepante (0,5%).

Criterios de calidad de los estudios: Ninguno de los 69 estudios cumplió con todos los criterios de reporte y métodos de investigación para evaluar la PCR como prueba diagnóstica (Tabla 1).
Los estudios fueron estratificados por número de muestras (36%) y pacientes (64%), para un total de 5237 y 6111, respectivamente. Los estudios que reportaron los parámetros de exactitud por número de pacientes fueron el principal objeto del análisis de este estudio dado que estos estudios contribuyen con mejor evidencia para la evaluación de la validez de la PCR en la práctica clínica.
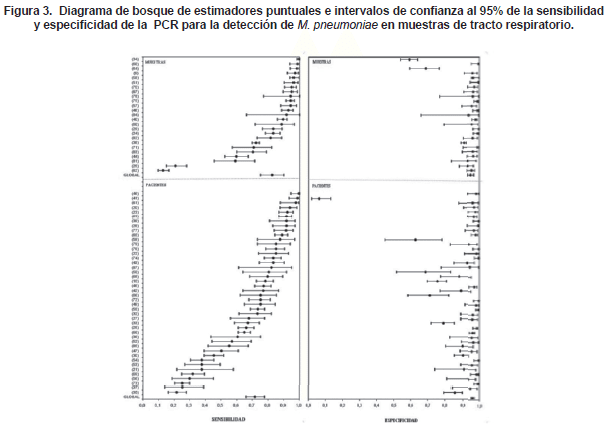
Sensibilidad y especificidad de la PCR. Tanto la sensibilidad como la especificidad de la PCR fueron altamente variables con amplios intervalos de confianza (Figura 3). Comparado con la especificidad, los resultados de sensibilidad fueron más variables y bajos.
Veintidós estudios tuvieron sensibilidad y especificidad superior a 90%, de los cuales 9 reportaron los resultados en número de pacientes. En 68% de los estudios, la sensibilidad fue inferior a 90%, mientras que 38% de los estudios presentaron especificidades menores a 90%.
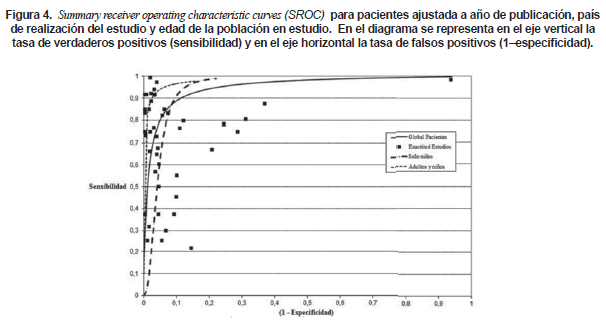
El 77% de los estimadores de precisión se localizaron en el cuadrante superior derecho del espacio ROC (Figura 4). Estudios que incluyeron adultos demostraron tener mayor exactitud diagnóstica (sensibilidad [83,6%] y especificidad [96,6%]) en comparación con estudios que solo incluyeron muestras provenientes de niños (sensibilidad [65,8%] y especificidad [96%]).
En este caso el RDOR (4,85) mostró diferencias en exactitud diagnóstica entre los grupos de edad (estudios que incluyeron niños y adultos versus estudios de solo niños p=0,025) (Tabla 2).
Exactitud diagnóstica de PCR por tipo de espécimen respiratorio. Los estudios que utilizaron exclusivamente muestras del tracto respiratorio superior presentaron una exactitud diagnóstica (sensibilidad [67,5%] y especificidad [96,3%]) similar a los estudios que utilizaron muestras conjuntas de tracto respiratorio superior y/o inferior (sensibilidad [79,6%] y especificidad [94,8%]). El RDOR (0,87) no demostró diferencia estadística significativa (p=0,736) entre muestras del tracto respiratorio superior e inferior (Tabla 2).
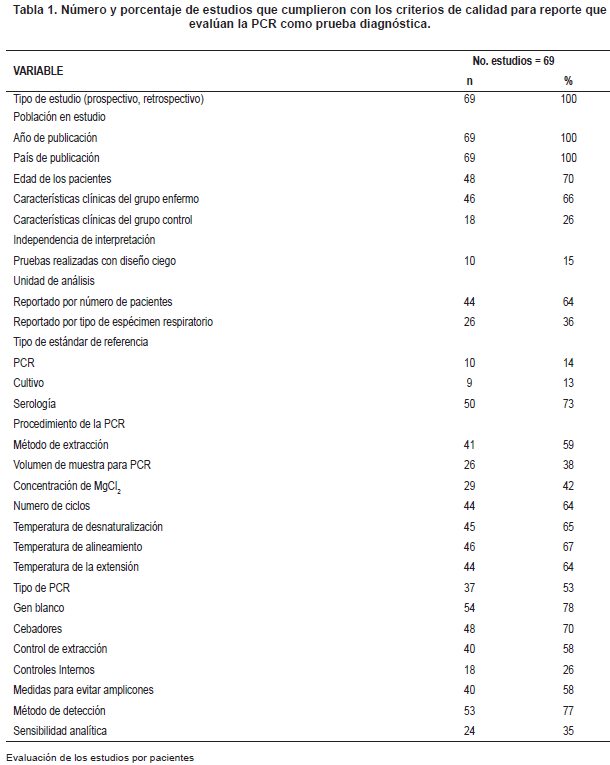
Extracción de datos y evaluación de la calidad: Dos autores realizaron la extracción de 27 variables incluidas en la revisión de los artículos (Tabla 1). Estas variables incluyen características de publicación de los artículos, cualidades técnicas de la PCR, estándar de referencia, e información clínica y demográfica de los pacientes con infección respiratoria.
No se asignó puntuación de calidad a los estudios debido a que todas las variables fueron incluidas en el modelo de meta-regresión. Dado que actualmente no hay consenso acerca del estándar de referencia para el diagnóstico de M.pneumoniae el estándar de referencia utilizado en la de forma independiente los criterios de inclusión de cada estudio.
Las diferencias entre los resultados de los dos autores fueron discutidas y acordadas con otro autor. Una lista de los estudios y las razones por las que fueron excluidos se encuentran disponibles por parte de los autores.
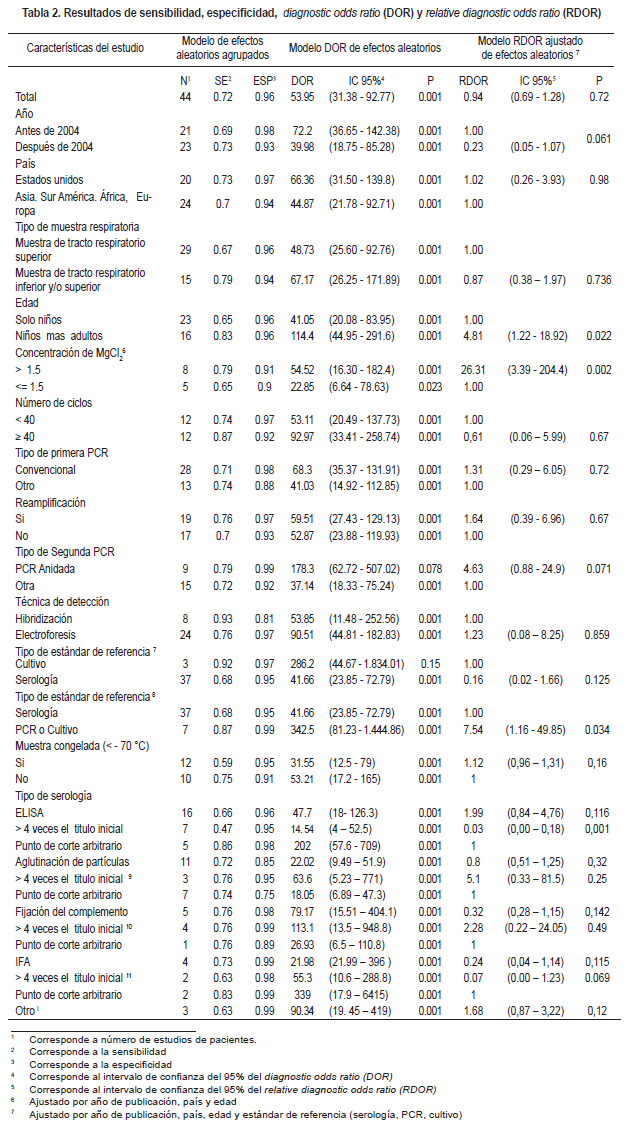
Efecto de las características de diseño de los estudios y el estándar de referencia. La exactitud diagnóstica de la PCR no fue diferente en estudios con diseño ciego en la metodología, comparados con los estudios que no lo realizaron (RDOR de 8,53; p=0,796).
Tampoco se observaron diferencias en los estimadores entre el grupo de estudios prospectivos en comparación con estudios retrospectivos (RDOR de 1,07; p=0,503). El tipo de estándar de referencia más frecuentemente utilizado fue la serología (73%). Sin embargo, algunos de los estudios también utilizaron el cultivo o una PCR de otro tipo como estándar de referencia.
Al comparar pruebas de evidencia directa de colonización por M. pneumoniae (cultivo y PCR) no se observó diferencia en la exactitud de la PCR (RDOR de 2,83; p=0,4).
Pero al comparar los estudios que utilizaron como estándar de referencia cultivo o PCR versus serología, se evidenció mayor exactitud diagnóstica con pruebas de evidencia directa de la presencia del agente (RDOR de 7,54; p=0,034) (Tabla 2).
Al comparar los estudios que utilizaron cultivo (prueba con menor exactitud teórica) como estándar de referencia con estudios que utilizaron serología no se observaron diferencias estadísticas en la exactitud (RDOR de 0,16; p=0,125).
Al evaluar el efecto del tipo de serología, no se encontraron diferencias estadísticamente significativas ni en la sensibilidad ni en la especificidad (RDOR de 1,02; p=0,84). Sin embargo, al valorar el efecto del punto de corte empleado para ELISA, se encontró que un incremento de 4 o más veces en el título de anticuerpos representaba una menor exactitud de la prueba de PCR versus otro punto de corte (RDOR de 0,03; p= 0,001) (Tabla 2). Para las demás pruebas no se encontró diferencia, sin embargo éstas carecen de ajuste como se indica en la Tabla 2.
Efecto de las características de la PCR: Estudios que utilizaron concentraciones de MgCl2 superiores a 1,5mM en comparación con estudios que utilizaron concentraciones iguales o inferiores a 1,5mM, mostraron mayor exactitud (RDOR de 26,31; p=0,002).
No se encontraron diferencias estadísticamente significativas en exactitud diagnóstica en cuanto a las técnicas de detección de los productos de amplificación o bien mediante hibridización o sembrándolos en gel de agarosa coloreados con bromuro de etidio, ni cambiando el número de ciclos, temperatura de desnaturalización o el tipo de gen blanco.
Sesgo de publicación: La prueba de Egger demostró que los estudios incluidos en este metaanálisistenían sesgo con tendencia a publicar estudios con sensibilidades (p=0,034) y especificidades altas (p=0,009).
Evaluación de los estudios por muestras
Sensibilidad y especificidad en estudios analizados por muestras: Entre los 25 estudios que reportaron datos en número de muestras se obtuvo una especificidad similar (94,5%) y sensibilidad mayor (82,5%) que la obtenida entre los estudios reportados por pacientes (Tabla 2).
En general, el patrón de resultados por muestras no mostró diferencias al comparar con estudios que reportaron en número de pacientes (RDOR 2,33 con p=0,172). Sin embargo, los resultados de los estudios por número muestra no evidencian diferencias cuando se utilizan concentraciones de MgCl2 superiores a 1,5mM (RDOR 0,92, p= 0,533).
La PCR convencional presentó mayor exactitud diagnóstica que los otros tipos de PCR utilizados (RDOR de 1,5 con una p=0,01). Además, los resultados por muestras no evidencian diferencias entre estudios con solo niños y aquellos que incluían también adultos (RDOR de 0,23; p=0,195), los resultados de los estudios por muestras se encuentran disponibles a través del autor principal.
1 Corresponde a número de estudios de pacientes.
2 Corresponde a la sensibilidad
3 Corresponde a la especificidad
4 Corresponde al intervalo de confianza del 95% del diagnostic odds ratio (DOR)
5 Corresponde al intervalo de confianza del 95% del relative diagnostic odds ratio (RDOR)
6 Ajustado por año de publicación, país y edad
7 Ajustado por año de publicación, país, edad y estándar de referencia (serología, PCR, cultivo)
8 Ajustado por año de publicación, país y edad
9 Ajustado por año de publicación y edad
10 Ajustado por año de publicación
11 Sin ajuste

