RESULTADOS
La EGB afecta aproximadamente al 0,5% de la población y es la causa que explica entre el 50-80% de todos los casos de hipertiroidismo; se origina como consecuencia de la presencia de anticuerpos IgG circulantes que se unen y activan a la proteína-G acoplada del receptor de Tirotropina (TSH). Dicha activación lleva a la hiperplasia e hipertrofia folicular, que luego se traduce clínicamente en bocio, con aumento en la producción de las hormonas tiroideas Triyodotironina (T3) y Levotiroxina (T4). El espectro clínico de la enfermedad es amplio, y aunque tradicionalmente la tríada de exoftalmos, bocio y dermopatía ha definido la EGB, un número importante de pacientes puede manifestarse con síntomas y signos aislados (taquicardia, diarrea o pérdida de peso inexplicable). Bioquímicamente, la EGB se expresa con una supresión de la TSH, con niveles de T3 y T4 usualmente elevados en el contexto de un hipertiroidismo primario clásico, aunque también se puede manifestar con TSH suprimida y con T3 y T4 normales, haciendo parte de un hipertiroidismo subclínico. Ocasionalmente el paciente tiene manifestaciones clásicas de la enfermedad (bocio difuso, exoftalmos y dermopatía) y niveles normales de TSH, T4 y T3, aunque con una expresión clara y marcada de los anticuerpos contra el receptor de TSH, estado clínico que se denomina “Enfermedad de Graves eutiroidea”. La oftalmopatía tiroidea en la EGB se evidencia en el 30-50% de los pacientes y su frecuencia es mayor cuando de forma intencional se busca por medio de imágenes específicas para la órbita; a través de dichas imágenes la oftalmopatía se detecta hasta en el 80% de los pacientes. La Dermopatía Tiroidea (DT) es una manifestación extra-tiroidea poco frecuente de la enfermedad, consiste en un engrosamiento localizado de la piel, usualmente en el área pretibial, por lo que es llamada con frecuencia “mixedema pretibial” aunque puede tener otros sitios de aparición. El bocio es con mucho la manifestación más frecuente de la tríada clásica, usualmente es difuso y no doloroso y su tamaño guarda una relación estrecha con la severidad de la enfermedad, incluso, puede tomarse como valor predictivo de la respuesta terapéutica a las tionamidas. El tratamiento de la enfermedad se basa en tres aspectos principales: Manejo con tionamidas, terapia con Yodo Radioactivo (I-131) y cirugía.
RESEÑA HISTÓRICA
En el Papiro de Ebers aparece información de lo que corresponde actualmente al bocio. Abulcasis –de Córdoba- hizo una descripción de la punción tiroidea, supo diferenciar el cáncer tiroideo del bocio, y parece que fue el primer cirujano en intervenir un bocio. Vara Thorbeck dice que el procedimiento se describe en “El saber médico” (libro del galeno árabe, disponible en Granada, versión en inglés): “Se trataba de un bocio intratorácico, que fue abierto, esterilizado en su parte intratorácica y luego cauterizado para así disminuir el tamaño del bocio, sin extirpación del tiroides” (www.seclaendosurgery. com). Laurentius también hizo una descripción en su obra “De Mirabili Strumas Sanadi”, publicada en París en 1609. Pero en cuanto al tema que nos ocupa, las reseñas más acertadas fueron hechas en el siglo XIX por clínicos europeos.
Enfermedad de Flajani- Parry-Graves- Basedow
Los italianos Giuseppe Flajani en el año 1802 (1) y Antonio Giuseppe Testa (2) en 1810 (que con este libro de texto citado hizo germinar la semilla de la cardiología) describieron pacientes con palpitaciones, aprehensión, temblor, nerviosismo y alteraciones sicóticas. En 1825, Caleb Hillier Parry hizo una reseña clásica del bocio exoftálmico (3); diez años después Robert James Graves publicó la que para muchos se tiene como la primera descripción precisa del mal (4). En 1840 Carl Adolph von Basedow dio a conocer en una revista germana un artículo titulado “Exoftalmos por hipertrofia del tejido orbitario”, donde no sólo describe sus observaciones acerca de 4 pacientes seguidos por él durante años, sino que hace planteamientos sobre una causa extraorbitaria y la conecta en los tres puntos de la triada de Merseburg (población donde el autor ejercía), es decir, exoftalmos, palpitaciones y bocio (5), similar a la descrita por Graves (4,6).
La publicación del alemán se realizó sin embargo cinco años después de la de Graves. La trascendencia de los tres últimos autores mencionados había determinado que el bocio exoftálmico se identificara indistintamente como enfermedad de Parry, de Graves o de von Basedow. Aunque es bien sabido que en países de habla inglesa se utiliza generalmente el nombre de Enfermedad de Graves, en la mayoría de los países europeos se refieren a la entidad como enfermedad de von Basedow; con este último epónimo se identifica también en Alemania la dermopatía tiroidea o mixedema pretibial. Actualmente existe poca controversia en el hecho de que Parry fue quien primero describió la enfermedad, aunque ha sido realmente poco el reconocimiento histórico que se le ha hecho; la respuesta a lo anterior puede surgir de la explicación suministrada por algunos de los biógrafos de Robert Graves, y es que éste muy hábilmente había contratado los servicios de Armand Trousseau, un profesor muy influyente que lo dio a conocer en Francia; era el jefe del servicio de medicina en el Hotel-Dieu en París y fue un gran admirador de Graves, y citaba a menudo su trabajo en sus conferencias clínicas y en sus múltiples publicaciones. Cuando el libro de Graves fue traducido al francés, Trousseau elogió al autor y de hecho utilizó por primera vez el epónimo “Enfermedad de Graves- Basedow” (como lo enunciamos en América Latina). Trousseau tiene su propio epónimo en un signo de la tetania hipocalcémica latente, pero recordemosque fue él quien también popularizó en Europa “la Enfermedad de Addison”, ya que le puso este nombre a la entidad. Obviamente se anota que la gran mayoría de publicaciones respecto a esta enfermedad pertenece a la literatura angloamericana, lo que ha perpetuado el nombre de “Enfermedad de Graves”. De esta forma, el bocio difuso hipertiroideo de origen autoinmune debería llamarse desde un punto de vista histórico, descriptivo y en pos de la justicia como “Enfermedad de Flajani-Parry-Gravesvon Basedow”. Otros nombres de la EGB que se describen en la literatura médica –cuando era moda usar epónimos- son entre otros, enfermedad de March, enfermedad de Parsons, enfermedad de Flajani y enfermedad de Begbie (6,7).
EPIDEMIOLOGÍA
Aunque la EGB puede presentarse a cualquier edad, el pico de incidencia se sitúa entre la quinta y la séptima década de la vida, la relación Mujer:Hombre es de 5-10:1. La mayoría de las series reportan una tasa de incidencia de 15 a 50 por 100.000 personas/ año de seguimiento; no obstante, estudios basados en población inglesa reportan una tasa de incidencia de 80 por 100.000 mujeres/año y de 10 por 100.000 hombres/año. La prevalencia de la enfermedad en la población general es de 0,5-1,0% (8,9). En la Encuesta Nacional sobre Salud y Nutrición (NHANESIII) se demostró que en individuos mayores de 12 años la prevalencia general de hipertiroidismo fue de 1,3%, con una menor prevalencia en hispanos (0,7%) y una mayor para personas de raza blanca (1,4%). En el estudio “The Nurses’ Health Study” la incidencia general de hipertiroidismo por EGB fue de 4,6 por 1.000 mujeres durante 12 años de seguimiento; hay pocos datos comparables de incidencia en hombres. En el estudio “Rochester Epidemiology Project” la incidencia ajustada por edad de oftalmopatía por EGB fue cinco veces más alta en mujeres de raza blanca que en hombres −16 por 100.000 pacientes/año y 2,9 por 100.000 pacientes/año, respectivamente- (10). En Estocolmo, en un estudio de cohorte realizado entre los años 2003 y 2005 se encontró que en la población con edad superior a 18 años la incidencia total de hipertiroidismo fue de 32,7/100.000 pacientes/año, de los cuales el 75% tenía EGB (11). El aumento en la ingesta de yodo se ha planteado como un factor que afecta la incidencia de EGB en la población, por ejemplo, en sitios como Japón donde la ingesta de yodo en la dieta puede ser mucho más alta que en la mayoría de los países, la incidencia puede alcanzar cifras de 200 por 100.000; además, el suplemento de yodo en la dieta en poblaciones con deficiencia leve a moderada puede aumentar el número de casos de la enfermedad. Por otra parte, se ha podido demostrar que en algunas áreas con cierto grado de deficiencia de yodo el suplemento del mismo se asocia con una disminución de hasta un 33% en la incidencia de EGB (12).
GENÉTICA Y ETIOPATOGENIA
La ocurrencia familiar de los desórdenes tiroideos autoinmunes es frecuente en individuos con EGB. por ejemplo, en aquellos con oftalmopatía por EGB el 36% tiene un familiar de primer o segundo grado afectados, bien sea por EGB o por otra Enfermedad Tiroidea Autoinmune (ETAI). Estudios de cohorte en gemelos han encontrado una tasa de concordancia de 0,36 y 0,03 para Monocigotos (MZ) y dicigotos (DZ) respectivamente; es más, se ha podido establecer que el 79% de la predisposición al desarrollo de EGB se atribuye a factores genéticos, con factores medioambientales no compartidos que explican el porcentaje restante, demostrando así la importancia de la expresión genética de la enfermedad (13). Los estudios en familias y en gemelos han demostrado claramente que la EGB no es causada por un defecto en un único gen (definiéndola como una entidad poligénica), en realidad se considera que tiene un patrón complejo de herencia, producto de la interacción de múltiples genes con efectos individuales muy modestos; de hecho, la mayoría de los loci identificados confieren un bajo riesgo de enfermedad (entre 1,2 y 1,5).
Desde el punto de vista genético, los estudios intentan detectar asociaciones entre uno o más polimorfismos genéticos y la presencia de un rasgo característico. Los estudios de asociación difieren de los de ligamiento, en el que el mismo alelo (o alelos) están asociados con ese rasgo de manera similar en toda la población, mientras que los estudios de ligamiento permiten que diferentes alelos estén asociados con ese rasgo en familias diferentes.
Los análisis de asociación se basan en comparar la frecuencia de una variante en pacientes con un desenlace determinado y en controles “apareados” étnicamente; si una diferencia estadísticamente significativa en la frecuencia de una variante es observada entre los casos y los controles entonces se concluye que dicha variante está asociada con la enfermedad o el desenlace (14,15).
El tipo más común de variabilidad genética en humanos se presenta en sitios del genoma en los que ocurren variaciones de nucleótidos individuales de un miembro a otro de la población.
Estos sitios se denominan Polimorfismos de Nucleótidos Individuales –SNPs- (16,17). Grandes progresos se han hecho en el entendimiento de los mecanismos inmunogenéticos que conllevan a la ETAI, la identificación de genes de enfermedades complejas envuelven cuatro fases: (Fase 1: Análisis de genes candidatos. Fase 2: Estudios de vínculo de genoma-total. Fase 3: Estudios de asociación de genoma-ampliado, y Fase 4: Secuencias de genoma-completo).
La aplicación de dichas tecnologías ha permitido avanzar en este aspecto, llevando a la identificación de al menos siete genes cuyas variantes se han asociado con ETAI, entre estos se encuentran: Elgen del HLA-DR, genes inmuno-reguladores (CTLA- 4, CD 40, PTPN-22 y CD 25) y genes específicos del tiroides –gen de la Tiroglobulina y el gen del TSHR- (18).
Gen del HLA-DR: Las moléculas del complejo mayor de histocompatibilidad (CMH), también llamadas Antígenos Leucocitarios Humanos (HLA), son el producto de un conjunto de genes responsables que los linfocitos rechacen tejidos trasplantados y detecten elementos extraños. Desde hace más de 3 décadas la evidencia disponible sugiere que la región HLA (6p21) predispone a la ETAI, los alelos dentro de la región HLA clase II (genes DRB1 y DQA1 son los que se han asociado con mayor fuerza en EGB), también se ha encontrado una importante asociación en la región HLA clase I, HLA-C y HLAB. Los pacientes caucásicos con EGB tienen una prevalencia incrementada del haplotipo DRB1*03 DQA1*05y DQB1*02, aunque no siempre están presentes en otros grupos étnicos; de hecho, en población Asiática se ha encontrado que el HLADPB1* 05:01 es el gen mayor que predispone a EGB en una sub-población de pacientes Chinos, con un OR=2,3 y un riesgo atribuible poblacional de48%. Otras variantes de susceptibilidad con efectos independientes incluye el B*46:01, DRB1*15:02 y 16:02, mientras que el DRB1*12:02 y el DQB1*03:02 confieren protección. Recientemente se ha identificado a la arginina en la posición 74 de la cadena HLA-DRb1 (DRb-Arg74) como el aminoácido DR crítico que confiere la susceptibilidad a la EGB; por otra parte, la presencia del aminoácido glutamina en la posición 74 de la cadena DRb1 confiere protección para la EGB (13,15).
CTLA-4 (Antígeno 4 Asociado al Linfocito T Citotóxico): El CTLA-4 es un atenuador de la actividad de las células T. Su homología estructural al CD28, tanto en la localización cromosómica como en la organización exón-intrón, sugiere que ambos genes provienen de un ancestro común.
La CD28 es una glicoproteína de membrana de 44 KD con una secuencia de 202 aminoácidos, cuyo gen se localiza en el brazo largo del cromosoma 2. La CD28 se encuentra en el 80% de las células T de sangre periférica humana, distribuyéndose en el 95% de linfocitos T CD4 y en el 50% de los CD8, su presencia en la membrana se incrementa transitoriamente después de la activación de las células T, seguida por una disminución cuando se produce la unión con su ligando. La CD28 es la principal molécula co-estimuladora en la activación de las células T, donde cumple un amplio espectro de funciones; uno de los efectos más importantes que se observan es el incremento dramático en la producción de IL-2, 4, 5 y 13, y de otras citoquinas como el factor de necrosis tumoral alfa –TNFα-, entre otras. El CTLA-4 se expresa en células T CD4 y CD8 activadas, en niveles 10 a 100 veces menores que los correspondientes a CD28, pero se une a CD80 y CD86 con una constante de disociación 20 a 50 veces más alta (13,18). Aunque inicialmente se le atribuyó un papel semejante a la CD28 en la activación de las células T, los hallazgos experimentales más recientes le adjudican un papel regulador negativo.
Existen relaciones coordinadas entre la expresión y función de CD28 y CTLA-4; por ejemplo, la presencia en la membrana y el estímulo de CD28 son esenciales para la expresión máxima y la regulación eficiente del RNA mensajero de CTLA-4. Algunos estudios han establecido que el CTLA-4 es un gen que confiere susceptibilidad para EGB; en población China por ejemplo, los polimorfismos A49G y CT60 se asocian con un aumento en la susceptibilidad para EGB el Odds Ratio (OR) resumido para A49G fue de 1,49 –y para CT60 fue de 1,45- teniendo en cuenta la alta heterogeneidad de los estudios que han documentado esta asociación (18,19).
CD 40: De los genes de susceptibilidad identificados en EGB el CD40 es el único que se involucra en la regulación de la respuesta de las células B. La molécula de CD40 es miembro de la familia de las moléculas del receptor del Factor de Necrosis Tumoral (TNF-R), el ligando fisiológico para la CD40 es la molécula CD154 (CD40L) la cual se expresa sobre la superficie de las células T ayudadoras. La unión de CD40 y CD40L genera señales que ayudan a la célula B a pasar del estado G0 al ciclo celular, por lo que juega un papel esencial en la activación y proliferación de los linfocitos B. La molécula CD40 es una de las candidatas para EGB sobre la base de estudios de genoma-ampliado, estos han implicado la región cromosómica 20q11, denominada GD-2, como un locus de susceptibilidad. El alelo C del rs 1883832 se ha encontrado que confiere un OR= 1,6 para EGB entre población caucásica, aunque también se ha encontrado dicha asociación en población Japonesa (19,20).
Gen de la PTPN22 (Protein Tyrosine Phosphatase Nonreceptor-22): La PTPN22 está involucrada en la respuesta adaptativa al antígeno por medio de la defosforilación y la inactivación del receptor de células T. El gen de la PTPN22 se ha asociado con la presencia de ETAI y con otras enfermedades autoinmunes, se localiza en el cromosoma 1p13, y codifica la proteína de señalización celular denominada Fosfatasa Tirosina Linfoide (FTL), la cual es una potente reguladora de la activación de células T, ésta proteína inhibe la activación de células T por medio de la unión a moléculas de transducción de señales como la Csk quinasa, la cual media la activación de células T. La asociación mejor documentada de las variantes de la PTPN22 con enfermedades autoinmunes, incluyendo la EGB es con rs2476601 (C1858T). Este polimorfismo se ha estudiado y considerado como un gen de susceptibilidad candidato para ETAI en diferentes grupos étnicos (especialmente en caucásicos). El polimorfismo PTPN22 C1858T origina un cambio en la posición 620 de una Arginina a Triptófano, lo que causa una unión eficientemente menor a la Csk quinasa; como resultado, las células T expresan alelos T que pueden ser hipersensibles y producir desórdenes autoinmunes. Sin embargo, la asociación de este polimorfismo con aumento en la susceptibilidad en ETAI ha sido variable, en parte por la heterogeneidad genética entre las poblaciones estudiadas y en parte por otros factores de confusión potenciales (13,20).
Gen del Receptor α de Interleuquina-2 (IL- 2RA): Este codifica la cadena α del complejo del receptor de la IL-2 (IL-2R) que también se conoce como CD25, el cual tiene un papel central en laregulación inmune como un modulador importante de auto-tolerancia y de inmunidad. El gen de la IL- 2RA se ha asociado con EGB (15,19).
Tiroglobulina (Tg): La Tg representa uno de los auto-antígenos mayores involucrados en la ETAI, los auto-anticuerpos contra la Tg (TgAb) no son específicos, y se presentan en el 80-90% de los pacientes con enfermedad de Hashimoto y en el 50-70% de los pacientes con EGB (usualmente en bajas concentraciones). La asociación de polimorfismos de la Tg con EGB se ha encontrado con recaída de la enfermedad después del tratamiento con anti-tiroideos; sin embargo, dichas conclusiones se basan en estudios con tamaños muestrales pequeños, los cuales no han sido uniformemente replicados (14,18).
Familia del gen similar al receptor Fc (FCRL):Este gen codifica productos que juegan un papel fundamental en el control de señales de las células B, se ha demostrado su asociación con varias enfermedades autoinmunes. El FCRL3 es uno de los cinco genes que se expresan de manera preferencial en los linfocitos B y tienen una alta homología estructural con los receptores Fc. El FCRL3 tiene un papel inhibitorio en el proceso de señalización de las células B, lo que origina un desajuste en la tolerancia y actividad de las mismas. La asociación del SNP rs7528684 fue replicada en japoneses con EGB y Lupus Eritematoso Sistémico. La citobanda 1p21-23, en la cual la familia FCRL reside, se ha identificado como un locus candidato para el aumento en la susceptibilidad para EGB en población japonesa, llevando a considerar que el origen de la asociación es un SNP regulador en la región promotora de FCRL3. El SNP rs7522061 en el gen FCRL3 también se ha asociado con ETAI en caucásicos, y más recientemente el SNP rs3761959 y el rs7522061 también se han asociado con EGB (19,20).
Receptor de la TSH (TSHR): El TSHR y su ligando −la TSH- son reguladores claves de la actividad tiroidea; los auto-anticuerpos que estimulan el TSHR simulan la acción de la TSH, originando el estado hipertiroideo característico. El TSHR está compuesto por 10 exones que codifican a 764 aminoácidos de aproximadamente 95 kDa. Las variantes genéticas localizadas dentro del TSHR probablemente estimulan la autoinmunidad en EGB, especialmente en aquellos individuos que poseen otros loci de riesgo autoinmune general; por lo que, las variantes genéticas dentro del TSHR influencian los cambios post-translacionales en el TSHR y/o la expresión génica, incrementando el riesgo que el TSHR sea un blanco inmunológico. El Anti-TSHR se encuentra en el 95-96% de los pacientes con EGB, aunque no en todas las personas que expresan al auto-anticuerpo se puede demostrar su funcionalidad (15,18).
La EGB posee un fuerte componente genético, conservando el antecedente de una historia familiar; la Colección Nacional de ADN de Enfermedades Autoinmunes Tiroideas del Reino Unido (The AITD UK National Collection of DNA) analizó 2.405 pacientes con EGB −2.020 mujeres y 385 hombres- y 400 pacientes británicos caucásicos con Enfermedad de Hashimoto (EH), en dicha serie, el 47,4% de las mujeres y el 40% de hombres con EGB y el 56,4% de mujeres y el 51,7% de hombres con EH reportaron una historia familiar de disfunción tiroidea. La interacción entre susceptibilidad genética y factores medioambientales es compleja y pobremente entendida; muchos de los genes identificados en conferir susceptibilidad para el inicio de la enfermedad se involucran con otras enfermedades autoinmunes, incluyendo la Diabetes Mellitus tipo 1, Artritis Reumatoide y Esclerosis múltiple. Esta aparente convergencia de susceptibilidad genética incrementa el riesgo de autoinmunidad, y cuando se combina con factores de riesgo específicos actúa como desencadenante de enfermedades autoinmunes (21).
Se han propuesto algunos factores que aumentanel riesgo de presentar EGB, entre éstos se describe el género (ya que la enfermedad es másfrecuente en mujeres que en hombres), infecciones previas por gérmenes como Yersinia enterocolítica, Yersinia pseudotuberculosis y Mycoplasma arthritidis, entre otros gérmenes. La forma como estosagentes infecciosos pueden desencadenar una respuesta específica de auto-antígeno es motivo de controversia, aunque un número importante de mecanismos puede aducirse. Dentro de esos se describe la inducción de una respuesta inflamatoria que conlleva a la producción de citoquinas pro inflamatorias que pueden causar la sobre-expresión aberrante del CMH clase II, lo que origina como consecuencia la presentación de auto-péptidos por medio de las moléculas del CMH, que causa activación de células T antígeno-específicas. La producción de citoquinas y el desbalance en las mismas causada por la infección puede llevar a la iniciación de la respuesta autoinmune. El periodo post-parto es un factor que puede considerarse “predisponente”, aunque es claro también que la mujer gestante regula algunas expresiones genéticas y autoinmunes que tienden a activarse una vez ha finalizado el mismo; por lo que, si bien la EGB es más probable que se manifieste en el periodo post-parto que en el periodo de gestación como tal, la explicación más plausible puede ser la “atenuación” de las manifestaciones autoinmunes propias en el embarazo más que un aumento del riesgo establecido por el periodo post-parto. Por otro lado, durante el embarazo las células fetales son capaces de alcanzar la circulación materna y de alguna forma pueden infiltrar una variedad de tejidos, a este proceso se le ha denominado “microquimerismo fetal”, la infiltración de los tejidos maternos por parte de las células fetales influencia la respuesta inmune materna, aunque en un grado difícil de cuantificar; estas células fetales son candidatas válidas para explicar la modulación autoinmune de la enfermedad tiroidea, tanto en el embarazo como en el estado post-parto (22). El uso de medicamentos como la amiodarona, derivados del litio, interferón-α, anti-retrovirales, y anticuerpos monoclonales, aumentan el riesgo de desarrollar EGB. El tabaquismo es otro factor asociado a la presencia de EGB, se ha establecido como un predictor de riesgo de hipertiroidismo por EGB; la relación existente es muy probable que sea dependiente del tiempo de exposición, los fumadores activos tienen un mayor riesgo que las personas que fumaron en el pasado y que en aquellas que nunca han fumado, dicha relación entre personas con esta costumbre también es dependiente de la dosis, ya que entre mayor sea el número de paquetes-año de cigarrillos fumados, mayor es la frecuencia de EGB, especialmente en mujeres con predilección por este hábito (22,23).
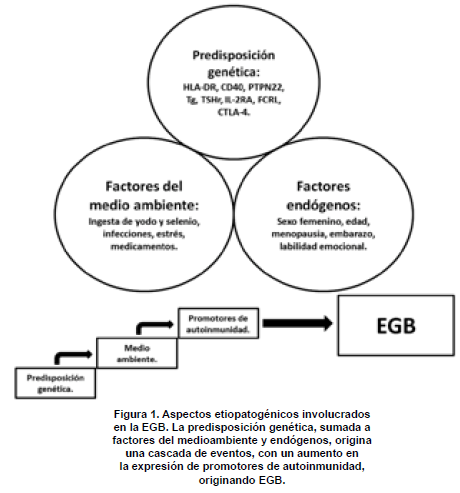
Ciertas vías neuroendocrinas podrían desencadenar o inducir recaídas en EGB, en la práctica clínica es frecuente determinar factores “estresantes” que se relacionan con la enfermedad; dentro de esos factores, la muerte de familiares cercanos, el divorcio, el estrés laboral y académico son los que, con mucho, se describen como probables desencadenantes, aunque la relación causal real de estos factores no ha sido aclarada. En resumen, la interacción entre factores genéticos, medioambientalesy factores endógenos son la base etiopatogénica de la EGB. La figura 1 resume los aspectos involucrados en la etiopatogenia de la EGB.