Perspectiva del Diagnóstico y Tratamiento del Cáncer de Mama
Cáncer de Seno: De la Cirugía y el Tamoxifen a la Terapia Dirigida en Pacientes con Tumores Her2 Positivo y Luminales
Hernán Carranza1
Resumen
El cáncer de mama es la neoplasia más común entre las mujeres y representa un problema global para la salud pública.
De acuerdo con estimaciones realizadas por la Organización Mundial de la Salud , en el año 2018 hubo a nivel mundial 2.1 millones casos nuevos y 627.000 muertes causadas por cáncer de mama. Históricamente el primer tratamiento considerado para cáncer de mama era quirúrgico.
Si bien la estratificación histológica sigue siendo una práctica común, los avances tecnológicos han desentrañado más complejidades con la aparición de al menos cinco subtipos moleculares distintos.
Sobre esta base, los análisis combinados genómico/transcriptómico de cánceres de mama han dado como resultado la identificación de diez subtipos distintos de cáncer de mama basados en grupos integrados.
En línea con estos avances, también se han realizado esfuerzos para segregar aún más algunos de los subtipos histológicos establecidos para los cánceres de mama ER-negativos y triple negativos.
En este artículo se presenta la evolución del manejo del cáncer de mama a la luz de los nuevos avances en el diagnóstico de la enfermedad.
Palabras clave: Cáncer de mama; tratamiento médico; terapia hormonal; receptor; terapia dirigida.
Breast Cancer: From Surgery and Tamoxifen to Targeted Therapy in Patients with Her2 Positive and Luminal Tumors
Abstract
Breast cancer is the most common neoplasm among women and represents a global problem for public health.
According to estimates made by the World Health Organization, in 2018, there were 2.1 million new cases worldwide and 627,000 deaths caused by breast cancer, Historically the first treatment considered for breast cancer was surgical.
Although histological stratification remains a common practice, technological advances have unraveled more complexities with the emergence of at least five different molecular subtypes.
This combined genomic/ transcriptomic analysis of breast cancers has identified ten distinct subtypes of breast cancer based on integrated clusters.
In accord with these advances, efforts have also been made to further segregate some of the established histologic subtypes for ER-negative and triple-negative breast cancers.
This article presents the evolution of breast cancer management in the light of new advances in diagnosing the disease.
Keywords: Breast cancer; medical treatment; hormonal therapy; receptor; targeted therapy.
Epidemiología
El cáncer de mama (CM) es la neoplasia más común entre las mujeres y representa un problema global para la salud pública (1).
De acuerdo con estimaciones realizadas por la Organización Mundial de la Salud (OMS), en el año 2018 hubo a nivel mundial 2.1 millones casos nuevos y 627.000 muertes causadas por CM, mientras la prevalencia alcanzó los 4.4 millones de casos (1).
Más de la mitad de los casos de cáncer de mama los casos ahora se diagnostican en países de bajos y medianos ingresos, donde una mayor proporción de casos (y a veces una marcada mayor proporción) son diagnosticados en etapas avanzadas, que están vinculadas a peor supervivencia (2).
El riesgo de desarrollar CM durante la vida es del 5% (1 de cada 5-7 mujeres) y la posibilidad de morir por la enfermedad después del diagnóstico es cercana al 30% (2,3).
En Colombia la tasa de incidencia anual estimada para el CM es de 36/100.000 mujeres, cifra inferior a la documentada en los países del primer mundo (3).
En relación con la mortalidad, el CM ocupa el tercer lugar en el país, valor precedido únicamente por el cáncer de cérvix y las neoplasias gástricas (4).
Y en nuestro entorno la distribución geográfica de la mortalidad muestra un mayor riesgo para las mujeres que viven en las capitales departamentales, hallazgo que se puede asociar al nivel de urbanización, por la disminución en la fecundidad y con el sedentarismo.
La tendencia de la mortalidad por CM en el país es creciente durante los últimos años (5,6) a pesar de que en algunas ciudades, y específicamente en Bogotá se observa un descenso (7).
Evolución del tratamiento quirúrgico de CM
Historicamente el primer tratamiento considerado para CM era quirúrgico, La medicina greco-latina se apunta a la cirugía de mama, a través de todo su recorrido, desde el Corpus Hippocraticum hasta el siglo I d.C., en el que Celso hace una mención de este tema en su obra y Leónidas describe concisamente la técnica de la mastectomía asociada a la cauterización (11) y es la radicalidad el eje fundamental del tratamiento quirúrgico hasta mediados del siglo XX.
Halsted, fue quien primero realizó una mastectomía radical en 1882, publicó sus resultados en 1894 (12). El enfoque halstediano siguió siendo el estándar de oro para el tratamiento quirúrgico de CM durante casi 80 años.
Durante los últimos 30 años, la gestión quirúrgica del CM ha pasado de enfoques radicales a procedimientos menos extremos para conservar la mama, aunque recientemente ha sido una tendencia de aumento de las tasas de mastectomía para casos inciertos (13). La evolución hacia procedimientos menos radicales ha sido evaluado con toda la rigurosidad necesaria.
Un ensayo aleatorio, NSABP B-04, que comenzó en 1971, comparó la mastectomía radical sin radiación vs. mastectomia simple con radiación vs. mastectomía simple sin radiación, reclutaron a 1.765 pacientes durante 126 meses, y la aleatorización se basó en parte en el estado ganglionar, con pacientes con enfermedad con ganglios linfáticos “clínicamente” positivos asignados al azar a mastectomía radical o mastectomía simple con radiación.
Los pacientes con ganglios “clínicamente” negativos fueron asignados aleatoriamente a cualquiera de los 3 grupos. No se observaron diferencias de supervivencia, sobrevida libre de enfermedad o sobrevida libre de enfermedad a distancia, y este estudio marcó el fin de la la mastectomía radical como base para el tratamiento quirúrgico del CM(14).
Comparación aleatoria de mastectomía frente a tumorectomía
Otro ensayo, NSABP B-06, incluyó una comparación aleatoria de mastectomía frente a tumorectomía sola frente a tumorectomía con radiación para pacientes que tenían enfermedad en estadio I o II con tumores de menos de 4 cm.
En total, se incluyeron 2.163 mujeres desde 1976 hasta 1984, con disección axilar que se realizó en todos los grupos. El seguimiento de 20 años de 1.851 pacientes se publicó en 2002. No hubo diferencias en la supervivencia general, pero si diferencias significativas en la recurrencia, con los grupos de tumorectomía sola con una tasa del 39,2% de recurrencia a los 20 años (15).
Por lo tanto, el estándar del cuidado de la cirugía conservativa de la mama se ha convertido en cuadrantectomía más radioterapia. Las contraindicaciones absolutas para la tumorectomía incluyen radioterapia previa, embarazo, tumor multicéntrico, incapacidad para obtener márgenes claras (tumor grande o invasión a estructuras adyacentes), e incapacidad física para tolerar la radioterapia.
Las contraindicaciones relativas incluyen tumor multifocal, enfermedad del tejido conectivo (16) y una gran cantidad de tumores en relación al tamaño de la mama. Las recurrencias deben ser manejadas con mastectomía.
El estado de los ganglios linfáticos axilares (ALN) determina la necesidad de radioterapia y terapia sistémica adyuvante. La disección de ALN en el momento de la cirugía fue la atención estándar hasta la década de 1990, pero a menudo resultó en dolor, entumecimiento, edema y disminución de la movilidad en el brazo afectado.

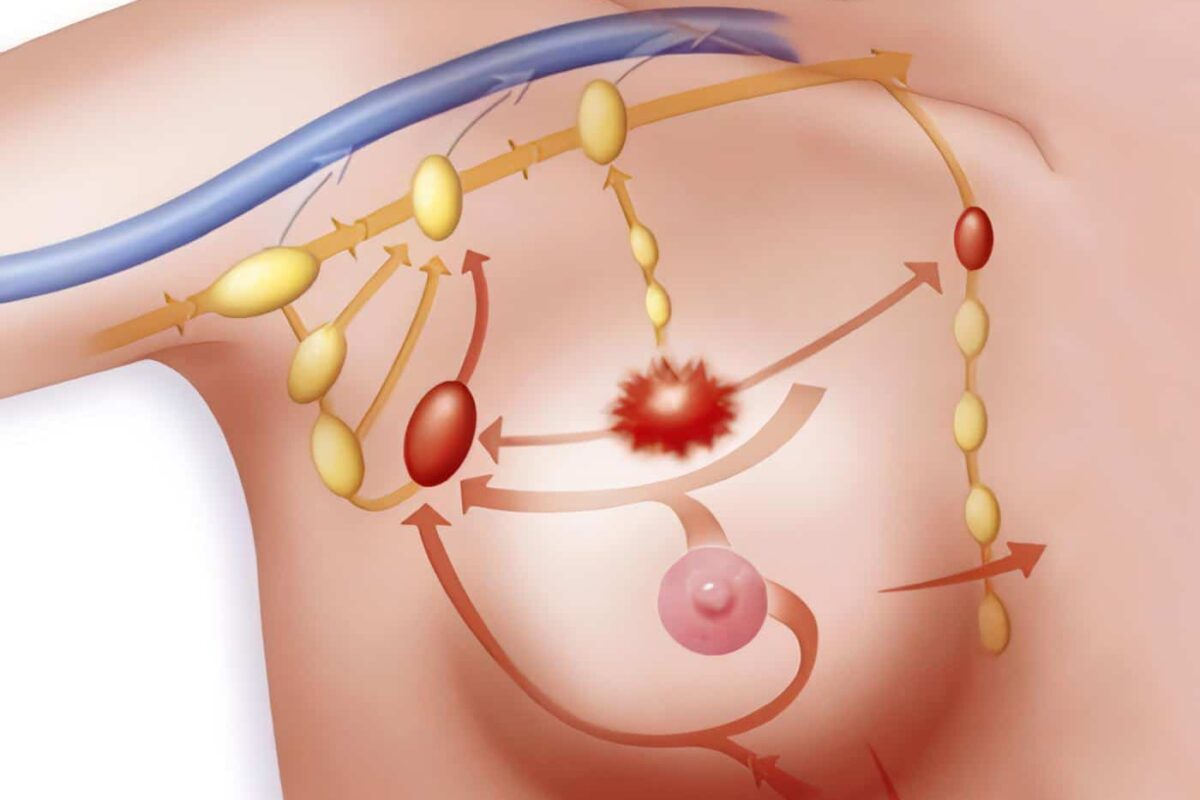
En pacientes con ganglios clínicamente negativos, una biopsia intraoperatoria de ganglio linfático centinela (SLN) negativa descarta la necesidad de disección de ALN.
La biopsia de SLN reduce los síntomas del brazo en comparación con la disección de ALN.
La biopsia del GLC tiene una sensibilidad de 95 a 100%, una tasa de falsos negativos del 5,5% (17), y un valor predictivo negativo del 98%. Un análisis prospectivo proporciona evidencia de que las pacientes con cáncer de mama en estadio temprano que tienen un SLN negativo tienen una mejor supervivencia libre de enfermedad y en general en comparación con las pacientes que tienen una disección de ALN negativa (18). Esto es más probable debido a una estadificación axilar más precisa en pacientes del grupo de SLN. La disección de ALN está indicada para todas las mujeres con ganglios linfáticos palpables o un SLN positivo.
Evolución del tratamiento sistémico de CM
Si bien la estratificación histológica sigue siendo una práctica común, los avances tecnológicos han desentrañado más complejidades con la aparición de al menos cinco subtipos moleculares distintos (Luminal A, Luminal B, Basal, HER2 enriquecido Clowdin Low) (8).
Sobre esta base, los análisis combinados genómico/ transcriptómico de cánceres de mama han dado como resultado la identificación de diez subtipos distintos de cáncer de mama basados en grupos integrados (9). En línea con estos avances, también se han realizado esfuerzos para segregar aún más algunos de los subtipos histológicos establecidos para los cánceres de mama ER-negativos y triple negativos.
Estos estudios han identificado al menos cuatro subtipos distintos de cáncer de mama ER negativo y seis subtipos de cáncer de mama triple negativo, respectivamente (10). El progreso realizado en estas áreas destaca la intrincada complejidad de los subtipos de cáncer de mama y es probable que en el futuro se descubran caracterizaciones más definidas y precisas basadas en nuevos parámetros (por ejemplo, metabolitos).
Sin embargo, cabe destacar que existe una brecha entre los métodos de investigación y la práctica clínica actual. Aunque la subtipificación intrínseca del CM se ha empleado en el ámbito de la investigación durante más de dos décadas.
Con la experiencia acumulada a lo largo de los años se ha evidenciado que no todos los CM tienen un comportamiento similar desde el punto de vista clínico:
Ya que las pacientes tienden a presentar respuestas diferentes frente a los tratamientos y resultados variables, a pesar de ser diagnosticadas en idéntico estadio tumoral.
A raíz de ello, se ha buscado introducir la información molecular en clasificación clínica (sistema TNM) para determinar el pronóstico y planificar el tratamiento de forma individualizada (19).
En la práctica, la información necesaria para identificar el subtipo molecular se obtienen antes de la cirugía, mediante el análisis inmunohistoquímico de la muestra histológica obtenida en la biopsia generalmente mediante aguja trucut .
Asimismo, la determinación del genotipo tumoral resulta de gran utilidad en las pacientes con cáncer de mama infiltrante en estadio precoz, proporciona información sobre la probabilidad de recidiva y, por tanto, sobre la conveniencia o no de recibir quimioterapia adyuvante.
Los tumores se pueden clasificar en subtipos que se distinguen por diferencias dominantes de los patrones de expresión genética (8) y estos subtipos se pueden inferir mediante el estudio de inmunohistoquímica de receptores hormonales, HER2 y KI 67.
El subtipo Luminal A Representa más del 50% de los CM, suele ser de grado histológico bajo y su pronóstico es el más favorable de todos, con una supervivencia a los 5 años mayor del 80% (20).
El porcentaje de tumores multifocales y multicéntricos es del 30-44% y el 9-37%, respectivamente. Las metástasis tienden a afectar con preferencia al hueso, el subtipo Luminal B. Su incidencia media es del 15%. Inicialmente se describían tasas de supervivencia a los 5 años del 40% (20).
Terapia de primera línea HER2 positivo
El receptor 2 del factor de crecimiento epidérmico humano (HER2) se ha identificado en aproximadamente el 20% de todos los pacientes con CM y corresponde a tumores de grado histológico intermedio o alto, con tendencia a ser multifocales.
Su supervivencia a los 5 años era del 31% antes de la introducción del trastuzumab. Las metástasis tienen predilección por el hueso, el cerebro, el hígado y el pulmón (21).
En los últimos 20 años, múltiples agentes anti-HER2 abarcan una serie de clases de fármacos incorporados a la práctica clínica, incluidos los anticuerpos monoclonales (trastuzumab y pertuzumab), los inhibidores de la tirosina quinasa intracelular de molécula pequeña (lapatinib y neratinib) y el fármaco de anticuerpos conjugado (ADC) ado-trastuzumab emtansina (T-DM1) (22).
El resultado del primer ensayo clínico de fase III proporcionado por Slamon et al. (23) en 2001, demostró que trastuzumab aumentó el beneficio clínico de la quimioterapia de primera línea en MBC que sobreexpresa HER2. Los pacientes con CMM HER2 positivo se dividieron al azar en dos grupos en la terapia de primera línea, uno fue quimioterapia con trastuzumab (n = 235) y el otro fue quimioterapia sola (n = 234). Una mejora significativa en el tiempo hasta la progresión (TTP) (7,4 frente a 4,6 meses; P <0,001) y SG (25,1 vs.20,3 meses; P = 0,01) se había obtenido con una mediana de seguimiento de 30 meses. El evento adverso más importante fue la disfunción cardíaca (23).
Se prueba trastuzumab
Luego, se probó trastuzumab en combinación con varios medicamentos de quimioterapia. Robert y col. asignaron al azar a 196 pacientes a trastuzumab y paclitaxel con o sin carboplatino. Sin embargo, la adición de carboplatino al paclitaxel y trastuzumab mejoró la tasa de respuesta objetiva (TRO) (52% frente al 36%) y la SLP (10,7 frente a 7,1 meses) en mujeres con cáncer de mama mestastásico (CMM) HER2 positivo, sin diferencias significativas en la SG (35,7 frente a 32,2 meses, (P = 0,76) y se observó mas toxicidad hematológica (24).
De manera similar, el estudio 007 del Breast Cancer International Research Group (BCIRG) evaluó trastuzumab y docetaxel con o sin carboplatino, y encontró que la adición de carboplatino no mejora la actividad antitumoral (25).
Dos ensayos de fase III compararon trastuzumab más taxano o vinorelbina como terapia de primera línea. Los tratamientos con trastuzumab / taxano y trastuzumab / vinorelbina fueron eficaces y tolerables para las pacientes CMM HER2 positivo. Y ambos esquemas pueden considerarse como una opción alternativa de tratamiento de primera línea (26,27).
Pertuzumab
Es un anticuerpo monoclonal humanizado recombinante que se une a un epítope de HER2 diferente al trastuzumab (28), en el ensayo de fase III CLEOPATRA, pertuzumab se agregó al estándar de tratamiento de primera línea de docetaxel más trastuzumab; pacientes con CMM HER2 positivo se aleatorizaron para recibir trastuzumab más docetaxel más placebo (grupo de control) o trastuzumab más docetaxel más pertuzumab (grupo de pertuzumab) como terapia de primera línea.
La mediana de la SLP evaluada de forma independiente para la adición de pertuzumab se prolongó en 6,1 meses (12,4 frente a 18,5 meses, P <0,001) (29). Los resultados finales preespecificados de SG con una mediana de seguimiento de 50 meses informaron 56,5 meses en el grupo de pertuzumab y mejoraron significativamente en comparación con 40,8 meses en el grupo de control (P <0,001) (30).
El ensayo MARIANNE ( 31) mostró que el grupo de T-DM1 y el grupo de T-DM1 más pertuzumab tenían una SLP no inferior en comparación con trastuzumab más taxano (T-DM1, 14,1 meses; T-DM1 más pertuzumab, 15,2 meses; trastuzumab más taxano, 13,7 meses). y ninguno de los brazos experimentales mostró superioridad en la SLP a trastuzumab más taxano para el tratamiento de primera línea de CMM HER2 positivo.
La incidencia de eventos adversos de grado ≥3 fue significativamente mayor en el grupo de trastuzumab más taxano (54,1%) que en el grupo de T-DM1 (45,4%) y el grupo de T-DM1 más pertuzumab (46,2%). En los brazos de T-DM1, hubo menos pacientes que interrumpieron el tratamiento debido a eventos adversos
Por lo tanto, actualmente pertuzumab, trastuzumab más docetaxel es el tratamiento estándar en la terapia de primera línea para CMM HER2 positivo, T-DM1 puede ser una alternativa.
Terapia de segunda línea HER2 positivo
Las opciones terapéuticas basadas en evidencia incluyen la continuación de trastuzumab con un compañero de quimioterapia diferente.
El ensayo de fase III del estudio German Breast Group 26 (32) demostró que la continuación de trastuzumab más capecitabina tuvo una mejora significativa en la respuesta general y TTP en comparación con capecitabina sola en pacientes con cáncer de mama HER-2 positivo que tuvieron progresión durante el tratamiento con trastuzumab, pero la diferencia de SG no fue estadísticamente significativa (25,5 frente a 20,4 meses, P = 0,257).
El lapatinib es un inhibidor de la tirosina quinasa de pequeña molécula dirigida al receptor del factor de crecimiento epidérmico (EGFR) y HER2 disponible por vía oral. El estudio MA.31 (33) comparó lapatinib con trastuzumab, ambos combinados con un taxano en primera línea metastásica demostró que lapatinib con la terapia con taxanos se asocia con una SLP más corta en comparación con trastuzumab con taxano .
Pero, lapatinib más capecitabina es una opción para los pacientes que progresaron con trastuzumab. Un ensayo de fase III de Geyer et al. (34) comparando lapatinib más capecitabina vs. capecitabina sola en pacientes que habían progresado con un tratamiento previo basado en trastuzumab, se encontró que había una mejoría significativa en la SLP (8,4 vs. 4,4 meses, P <0,001). Aunque la terminación prematura de la inclusión y el posterior cruce resultaron en un poder insuficiente para detectar diferencias en la SG, los análisis exploratorios finales demostraron una tendencia hacia una ventaja de supervivencia con lapatinib más capecitabina.
T-DM1
Es un conjugado de anticuerpo dirigido contra HER2 y emtamsine (antineoplásico DM1) que incorpora las propiedades antitumorales de trastuzumab dirigidas a HER2 con la actividad citotóxica del agente inhibidor de microtúbulos.
El ensayo EMILA (35), que comparó T-DM1 y lapatinib-capecitabina para pacientes que habían sido tratados previamente con trastuzumab y taxano, informó una ventaja de SG estadísticamente significativa a favor de T-DM1 en el segundo análisis intermedio en el año 2012, llevó al registro y rápida adopción clínica de T-DM1.
En 2017, el análisis final de EMILA mostró que la mediana de SG fue más prolongada con T-DM1 que con lapatinib- capecitabina (29,9 vs.25,9 meses), aunque 136 (27%) de 496 pacientes pasaron del control a T-DM1, después del segundo análisis de supervivencia global provisional.
Además, las tasas de eventos adversos de grado 3 o 4 fueron numéricamente más altas en lapatinib más capecitabina frente a T-DM1 (57% frente a 41%). Pero, la trombocitopenia y el aumento de los niveles séricos de aminotransferasas fueron mas frecuente para los pacientes que recibieron T-DM1.
Por lo tanto, en la actualidad, T-DM1 es el tratamiento estándar en la terapia de segunda línea para CMM HER2 positivo.
Rara vez se informa sobre un ensayo de fase III para la terapia anti-HER2 en el entorno de tercera línea.
En el estudio TH3RESA (36), incluyó pacientes (n = 602) tratados previamente con trastuzumab, lapatinib, un taxano y con progresión en dos o más regímenes dirigidos por HER2 en enfermedad avanzada. Los pacientes fueron aleatorizados en una forma 2: 1 a T-DM1 y la elección de la terapia por parte del médico.
En el punto de corte de los datos, el 47% de los pacientes del grupo de elección del médico habían pasado a T-DM1. La SG fue significativamente más prolongada con T-DM1 en comparación con el tratamiento control elegido por el médico (22,7 frente a 15,8 meses, P = 0,0007).
Nuevos agentes en anti-HER2
Neratinib es un inhibidor irreversible y activo por vía oral de la tirosina quinasa HER-2 que bloquea la transducción de señales a través de un amplio espectro de 3 receptores, erbB-1, erbB-2 y erbB-4 (37).
El primer ensayo abierto multicéntrico de fase II con neratinib en monoterapia para pacientes con cáncer de mama avanzado incluyó pacientes que se dividieron en dos cohortes, la cohorte con tratamiento previo con trastuzumab (n = 66) y la cohorte sin tratamiento previo con trastuzumab (n = 70).
Los resultados mostraron que las tasas de SLP a las 16 semanas fueron del 59% para los pacientes con tratamiento previo con trastuzumab y del 78% para los pacientes sin tratamiento previo con trastuzumab. La mediana de SLP fue de 22,3 y 39,6 semanas.
La diarrea fue el evento adverso mas frecuente, grados 3 a 4 , en el 30% de los pacientes con tratamiento previo con trastuzumab y en el 13% de los pacientes sin tratamiento previo con trastuzumab (38).
El ensayo clínico aleatorizado NEfERT-T (39) mostró que en las pacientes con CMM HER2 positivas de primera línea, neratinibpaclitaxel no era superior a trastuzumab-paclitaxel en términos de SLP. Pero neratinib-paclitaxel puede retrasar la progresión de la enfermedad a sistema nervioso central. Estos resultados deben ser confirmados por ensayos aleatorizados a gran escala.
Margetuximab
Es un anticuerpo anti-HER2 modificado con Fc que se une con elevada afinidad a las formas de menor y mayor afinidad de CD16A, importante para la citotoxicidad mediada por células dependiente de anticuerpos (ADCC) contra las células tumorales.
Un estudio de fase I en pacientes con CMM HER2 positivo mostró que el margetuximab se tolera bien y tiene una actividad prometedora como agente único. Se están realizando más esfuerzos de desarrollo de agentes únicos o en combinación con otros agentes terapéuticos (40)
MM-302 es un liposoma PEGilado dirigido a HER2 que encapsula la doxorrubicina para facilitar su administración a las células tumorales que sobreexpresan HER2.
Está en marcha un ensayo aleatorizado de fase 2 (HERMIONE) de MM-302 más trastuzumab vs. quimioterapia a elección del médico más trastuzumab en pacientes con CMM HER2 positivo, sin antraciclinas y previamente tratado (41,42)
Nuevas combinaciones (con inhibidores de mTOR o inhibidores de PI3K) en pacientes HER positivo
Las mutaciones en la vía PI3K son frecuentes en el cáncer de mama y provocan resistencia a los agentes dirigidos a HER 2. PI3K está aguas abajo de HER2 y mTOR está aguas abajo de PI3K, por lo tanto esta vía puede ser un paso importante para superar la resistencia a trastuzumab en CMM HER2 positivo.
En el estudio BOLERO-3 fueron asignados al azar everolimus o placebo en pacientes con CM avanzado resistente a trastuzumab y demostró que la adición de everolimus a trastuzumab más vinorelbine prolonga significativamente la SLP (7,0 frente a 5,78; p = 0,0067), pero con mayor frecuencia de eventos adversos (43).
El ensayo de fase III BOLERO-1 compara paclitaxel y trastuzumab con o sin everolimus para el tratamiento de primera línea de mujeres con CMM HER2 positivo (44). Aunque la SLP no fue significativamente diferente entre los grupos de la población completa, se observó una prolongación de 7,2 meses con la adición de everolimus en la población HER2 positiva y receptores hormonales negativos.
Pilaralisib (SAR245408) es un inhibidor de PI3K panclase I. Se realizó un estudio de fase I / II de pilaralisib en combinación con trastuzumab o paclitaxel más trastuzumab en pacientes con CMM HER2 positivo que habían progresado con un régimen previo que contenía trastuzumab y dio como resultado que pilaralisib en combinación con trastuzumab con o sin paclitaxel tuvo un nivel aceptable en el perfil de seguridad y con actividad clínica en el grupo de paclitaxel (45).
(Lea También: Historia del Cáncer de Pulmón)
Ca de mama receptor hormona positivo
La terapia hormonal tiene el propósito de prevenir la interacción entre los estrógenos y las vías dependientes de estrógenos para estimular las células neoplásicas. Se puede realizar a través de:
-
Bloqueo de la producción de estrógenos:
- inhibición ovárica:
– quirúrgico (ooforectomía);
– radiológico;
– químico (análogos de LH-RH);
– inhibidores de la aromatasa (conversión enzima de los precursores de andrógenos en estrógenos).
-
Bloquear la acción de los estrógenos sobre células tumorales:
- SERM: actúan como agonistas de estrógenos, antagonistas o ambos, según el objetivo tisular: tamoxifeno, toremifeno, raloxifeno;
- SERD – inhibición de la actividad de ER: fulvestrant, antagonista de ER sin efectos agonistas de estrógenos.
El análogo de LH-RH utilizado en la práctica actual es goserelina 3,6 mg, intradérmico a los 28 días.
Los inhibidores de la aromatasa que se utilizan actualmente son los inhibidores de la aromatasa no esteroideos de 3ª generación (reversibles): Anastrozol 1 mg / día p.o y Letrozol 2,5 mg / día p.o o esteroideos (irreversibles): Exemestan 25 mg / día p.o. Activo solo en pacientes posmenopáusicas.
No existe resistencia cruzada entre los dos tipos de inhibidores de la aromatasa. El tamoxifeno es el SERM más utilizado, activo en pre y posmenopausia en la dosis de 20 mg / día p.o; la respuesta al tamoxifeno varía según el porcentaje de ER y PR de las células de cáncer de mama HR +. El beneficio de la terapia con tamoxifeno continúa después de la finalización del tratamiento (46) y es independiente y se suma al beneficio de la quimioterapia.
Actúa como antagonista de estrógenos en células de cáncer de mama HR positivo, agonista de estrógenos parcialmente en células endometriales y agonista de estrógenos en células óseas. Oxford Review (2005-5) en ensayos clínicos aleatorizados mostró que la terapia adyuvante (46) ofrecía beneficio en sobrevida libre de progresión para las pacientes con tumores receptores hormonales positivos.
La terapia hormonal adyuvante está indicada en todas las pacientes con neoplasia de mama HR positivo.
No se recomienda su administración concomitante a la quimioterapia, pero puede administrarse durante la radioterapia. En la premenopausia consiste en Tamoxifeno +/- inhibición ovárica quirúrgica / química. Es equivalente a la quimioterapia CMF y puede reemplazarla.
También está indicado para pacientes premenopáusicas que no presentaron amenorrea después de la quimioterapia (47). Disminuye el riesgo de recurrencia en un 6% y el riesgo de muerte por cáncer de mama en un 6,3%. A diferencia de la inhibición quirúrgica o radiológica, la inhibición química ovárica no es definitiva, que es una ventaja en pacientes jóvenes, cuya fertilidad se conserva.
Por ahora, no se ha demostrado un beneficio claro de asociar el tratamiento con análogos de LH-RH al tamoxifeno en enfermedad adyuvante, pero según el consenso de Lisboa (2011), se recomienda utilizar la asociación de análogos de LH-RH en los dos primeros años de tratamiento en pacientes menores de 35 años con neoplasia de mama HR positivo, que reciben tratamiento adyuvante con Tamoxifeno (los dos primeros años representan el período con mayor incidencia de recidivas locales y/o distantes en la historia natural de un cáncer de mama).
En pacientes posmenopáusicas, la terapia hormonal adyuvante es el tamoxifeno o inhibidores de la aromatasa (8).
La terapia adyuvante con inhibidores de la aromatasa está indicada desde el inicio en pacientes de “alto riesgo” (por ejemplo Her2 positivo, invasión importante de ganglios linfáticos) o en pacientes con contraindicación para Tamoxifeno por comorbilidad. Hay estudios que demostraron el beneficio de la terapia adyuvante en la posmenopausia con Tamoxifeno 2-3 años, seguido de Exemestan 3-2 años (48).
Además, teniendo en cuenta la larga historia natural del cáncer de mama HR positivo, donde las recidivas suelen aparecer entre los años 6-15, existen estudios clínicos que demostraron el beneficio del tratamiento adyuvante con un inhibidor de la aromatasa durante 5 años, después de 5 años. período de un año de tratamiento adyuvante con tamoxifeno (49).
Casi la mitad de las pacientes con neoplasia de mama HR positivo tienen resistencia de novo o adquirida a la terapia hormonal, siendo uno de los mecanismos de resistencia a la terapia hormonal la activación de la vía celular mTor. La quinasa beta-1 S6, el sustrato del complejo mTor, fosforila el dominio activador independiente del ligando de ER. El inhibidor de mTor Everolimus bloquea la reacción y puede revertir la resistencia a la terapia hormonal.
El ensayo clínico Bolero 2 demostró que la asociación de Everolimus 10 mg / día VO con Exemestane 25 mg / día VO en pacientes con HR positivo, su cáncer de mama 2- metastásico en progresión bajo un inhibidor de aromatasa no esteroideo duplica SLP comparado con Exemestane solo (50).
Las quinasas dependientes de ciclina 4 y 6, que regulan el crecimiento y la división celular, son inhibidas por Palbociclib.
Los estudios clínicos demostraron que las pacientes sin tratamiento hormonal con cáncer de mama HR positivo, Her2- avanzado que recibieron 125 mg / día de palbociclib y 2,5 mg / día de letrozol por vía oral tuvieron una SLP de 24,8 meses en comparación con 14,5 meses para las pacientes que recibieron solo letrozol. (Paloma 2), (51) y pacientes con HR positivo, Her2 – neoplasia de mama metastásica en progresión en terapia hormonal el ribociclib ha demostrado mejoría en la sobrevida global (52).
Conclusión
En conclusión, me gustaría citar al profesor Gabriel Hortobagyi del MD Anderson Cancer Center: “El cáncer de mama es un conglomerado de síndromes múltiples definidos molecularmente, que son diferentes en cuanto a su historia natural, evolución clínica y sensibilidad a agentes terapéuticos externos”.
Referencias
-
1. Bray F, Ferlay J, Soerjomataram I, Siegel R, Torre L, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA A Cancer J Clin.2018;68(6):394-424.
-
2. Ginsburg O, Bray F, Coleman M, Vanderpuye V, Eniu A, Kotha S et al. The global burden of women’s cancers: a grand challenge in global health. Lancet. 2017;389(10071):847-860.
-
3. DANE [Internet]. Dane.gov.co. 2020 [consultado 18 Octubre 2020].Disponible en: http://www.dane.gov.co/files/investigaciones/poblacion/defunciones/defun_2005/CUADRO5.xls
-
4. Murillo R, Piñeros M, Hernández G. Atlas de mortalidad por cáncer en Colombia. Bogotá. Instituto Nacional de Cancerología, Instituto Geográfico Agustín Codazzi; Bogotá: INC, 2004.
-
5. Piñeros M, Hernández G, Bray F. Increasing mortality rates of common malignancies in Colombia: an emerging problem. Cancer. 2004;101(10):2285-92.
-
6. Hernández G, Herrán S, Cantor LF. Análisis de las tendencias de mortalidad por cáncer de mama en Colombia y Bogotá, 1981 a 2000. Rev Colomb Cancerol. 2007;11(1):32-9.
-
7. Observatorio Nacional de Cáncer [Internet]. Minsalud. gov.co. 2020 [consultado 18 Octubre 2020]. Disponible en: https://www.minsalud.gov.co/sites/rid/Lists/Biblioteca-Digital/RIDE/VS/ED/GCFI/guia-ross-cancer.pdf
-
8. Perou C, Sørlie T, Eisen M, van de Rijn M, Jeffrey S, Rees C et al. Molecular portraits of human breast tumours. Nature. 2000;406(6797):747-752.
-
9. Curtis C, Shah S, Chin S, Turashvili G, Rueda O, Dunning M et al. The genomic and transcriptomic architecture of 2,000 breast tumours reveals novel subgroups. Nature. 2012;486(7403):346-352.
-
10. Lehmann B, Jovanović B, Chen X, Estrada M, Johnson K, Shyr Y et al. Refinement of Triple-Negative Breast Cancer Molecular Subtypes: Implications for Neoadjuvant Chemotherapy Selection. PLOS ONE. 2016;11(6):e0157368.
-
11. Crónica de la Medicina. Tomo I. 2º Edición. Edit. Plaza y Janés. Barcelona, 1995.
-
12. Halsted WS. The results of operation for the cure of cancer of the breast performed at John Hopkins Hospital from June 1889 to January 1894. Ann Surg. 1894;20(5):497- 555.
-
13. McGuire K, Santillan A, Kaur P, Meade T, Parbhoo J, Mathias M et al. Are Mastectomies on the Rise? A 13- Year Trend Analysis of the Selection of Mastectomy Vs. Breast Conservation Therapy in 5865 Patients. Ann Surg Oncol. 2009;16(10):2682-2690.
-
14. Fisher B, Jeong J, Anderson S, Bryant J, Fisher E, Wolmark N. Twenty-Five-Year Follow-up of a Randomized Trial Comparing Radical Mastectomy, Total Mastectomy, and Total Mastectomy Followed by Irradiation. N Engl J Med. 2002;347(8):567-575.
-
15. Fisher B, Anderson S, Bryant J, Margolese R, Deutsch M, Fisher E et al. Twenty-Year Follow-up of a Randomized Trial Comparing Total Mastectomy, Lumpectomy, and Lumpectomy plus Irradiation for the Treatment of Invasive Breast Cancer. N Engl J Med. 2002;347(16):1233-1241.
-
16. Diao K, Chen Y, Catalano P, Lee S, Milani N, Killoran J et al. Radiation toxicity in patients with collagen vascular disease and intrathoracic malignancy treated with modern radiation techniques. Radiother Oncol. 2017;125(2):301-309.
-
17. Gill G. Sentinel-Lymph-Node-Based Management or Routine Axillary Clearance? One-Year Outcomes of Sentinel Node Biopsy Vs. Axillary Clearance (SNAC): A Randomized Controlled Surgical Trial. Ann Surg Oncol. 2008;16(2):266-275.
-
18. Langer I, Guller U, Hsu-Schmitz S, Ladewig A, Viehl C, Moch H et al. Sentinel lymph node biopsy is associated with improved survival compared to level I & II axillary lymph node dissection in node negative breast cancer patients. Eur J Surg Oncol. 2009;35(8):805-813.
-
19. Cancer Staging Manual. 8va ed. 2020.
-
20. Dai, X., Li, T., Bai, Z., Yang, Y., Liu, X., Zhan, J., & Shi, B.Breast cancer intrinsic subtype classification, clinical use and future trends. Am J CancerRes. 2015;5(10):2929– 2943.
-
21. Slamon D, Clark G, Wong S, Levin W, Ullrich A, McGuire W. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987;235(4785):177-182.
-
22. Baselga J, Albanell J. Mechanism of action of anti-HER2 monoclonal antibodies. Ann Oncol. 2001;12:S35-S41.
-
23. Slamon D, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A et al. Use of Chemotherapy plus a Monoclonal Antibody against HER2 for Metastatic Breast Cancer That Overexpresses HER2. N Engl J Med. 2001;344(11):783-792.
-
24. Robert N, Leyland-Jones B, Asmar L, Belt R, Ilegbodu D, Loesch D et al. Randomized Phase III Study of Trastuzumab, Paclitaxel, and Carboplatin Compared With Trastuzumab and Paclitaxel in Women With HER-2– Overexpressing Metastatic Breast Cancer. J Clin Oncol. 2006;24(18):2786-2792.
-
25. Valero V, Forbes J, Pegram M, Pienkowski T, Eiermann W, von Minckwitz G et al. Multicenter Phase III Randomized Trial Comparing Docetaxel and Trastuzumab With Docetaxel, Carboplatin, and Trastuzumab As First- Line Chemotherapy for Patients With HER2-Gene-Amplified Metastatic Breast Cancer (BCIRG 007 Study): Two Highly Active Therapeutic Regimens. J Clin Oncol. 2011;29(2):149-156.
-
26. Andersson M, Lidbrink E, Bjerre K, Wist E, Enevoldsen K, Jensen A et al. Phase III Randomized Study Comparing Docetaxel Plus Trastuzumab With Vinorelbine Plus Trastuzumab As First-Line Therapy of Metastatic or Locally Advanced Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: The HERNATA Study. J Clin Oncol. 2011;29(3):264-271.
-
27. Burstein H, Keshaviah A, Baron A, Hart R, Lambert-Falls R, Marcom P et al. Trastuzumab plus vinorelbine or taxane chemotherapy for HER2-overexpressing metastatic breast cancer: The trastuzumab and vinorelbine or taxane study. Cancer. 2007;110(5):965-972.
-
28. Cortés J, Fumoleau P, Bianchi G, Petrella T, Gelmon K, Pivot X et al. Pertuzumab Monotherapy After Trastuzumab- Based Treatment and Subsequent Reintroduction of Trastuzumab: Activity and Tolerability in Patients With Advanced Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer. J Clin Oncol. 2012;30(14):1594-1600.
-
29. Baselga J, Cortes J, Kim SB, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med 2012;366:109-19
-
30. Swain S, Baselga J, Kim S, Ro J, Semiglazov V, Campone M et al. Pertuzumab, Trastuzumab, and Docetaxel in HER2-Positive Metastatic Breast Cancer. N Engl J Med. 2015;372(8):724-734.
-
31. Perez E, Barrios C, Eiermann W, Toi M, Im Y, Conte P et al. Trastuzumab Emtansine With or Without Pertuzumab Vs. Trastuzumab Plus Taxane for Human Epidermal Growth Factor Receptor 2–Positive, Advanced Breast Cancer: Primary Results From the Phase III MARIANNE Study. J Clin Oncol. 2017;35(2):141-148.
-
32. von Minckwitz G, du Bois A, Schmidt M, Maass N, Cufer T, de Jongh F et al. Trastuzumab Beyond Progression in Human Epidermal Growth Factor Receptor 2–Positive Advanced Breast Cancer: A German Breast Group 26/ Breast International Group 03-05 Study. J Clin Oncol. 2009;27(12):1999-2006.
-
33. Gelmon K, Boyle F, Kaufman B, Huntsman D, Manikhas A, Di Leo A et al. Open-label phase III randomized controlled trial comparing taxane-based chemotherapy (Tax) with lapatinib (L) or trastuzumab (T) as first-line therapy for women with HER2+ metastatic breast cancer: Interim analysis (IA) of NCIC CTG MA.31/GSK EGF 108919. J Clin Oncol. 2012;30(15_suppl):LBA671-LBA671.
-
34. Geyer CE, Forster J, Lindquist D, et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med 2006;355:2733-43.
-
35. Verma S, Miles D, Gianni L, Krop I, Welslau M, Baselga J et al. Trastuzumab Emtansine for HER2-Positive Advanced Breast Cancer. N Engl J Med. 2012;367(19):1783- 1791.
-
36. Krop I, Kim S, Martin A, LoRusso P, Ferrero J, Badovinac- Crnjevic T et al. Trastuzumab emtansine vs. treatment of physician’s choice in patients with previously treated HER2-positive metastatic breast cancer (TH3RESA): final overall survival results from a randomised open-label phase 3 trial. Lancet Oncol. 2017;18(6):743-754.
-
37. Rabindran S, Discafani C, Rosfjord E, Baxter M, Floyd M, Golas J et al. Antitumor Activity of HKI-272, an Orally Active, Irreversible Inhibitor of the HER-2 Tyrosine Kinase. Cancer Res. 2004;64(11):3958-3965.
-
38. Burstein H, Sun Y, Dirix L, Jiang Z, Paridaens R, Tan A et al. Neratinib, an Irreversible ErbB Receptor Tyrosine Kinase Inhibitor, in Patients With Advanced ErbB2-Positive Breast Cancer. J Clin Oncol. 2010;28(8):1301-1307.
-
39. Awada A, Colomer R, Inoue K, Bondarenko I, Badwe R, Demetriou G et al. Neratinib Plus Paclitaxel vs Trastuzumab Plus Paclitaxel in Previously Untreated Metastatic ERBB2-Positive Breast Cancer. JAMA Oncology. 2016;2(12):1557.
-
40. Bang Y, Giaccone G, Im S, Oh D, Bauer T, Nordstrom J et al. First-in-human phase 1 study of margetuximab (MGAH22), an Fc-modified chimeric monoclonal antibody, in patients with HER2-positive advanced solid tumors. Ann Oncol. 2017;28(4):855-861.
-
41. Munster P, Krop I, LoRusso P, Ma C, Siegel B, Shields A et al. Safety and pharmacokinetics of MM-302, a HER2-targeted antibody–liposomal doxorubicin conjugate, in patients with advanced HER2-positive breast cancer: a phase 1 dose-escalation study. Br J Cancer. 2018;119(9):1086-1093.
-
42. Miller K, Cortes J, Hurvitz SA, et al. HERMIONE: a randomized Phase 2 trial of MM-302 plus trastuzumab vs. chemotherapy of physician’s choice plus trastuzumab in patients with previously treated, anthracycline-naive, HER2-positive, locally advanced/metastatic breast cancer. BMC Cancer 2016;16:352
-
43. André F, O’Regan R, Ozguroglu M, Toi M, Xu B, Jerusalem G et al. Everolimus for women with trastuzumabresistant, HER2-positive, advanced breast cancer (BOLERO- 3): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet Oncol. 2014;15(6):580-591.
-
44. Hurvitz S, Andre F, Jiang Z, Shao Z, Mano M, Neciosup S et al. Combination of everolimus with trastuzumab plus paclitaxel as first-line treatment for patients with HER2- positive advanced breast cancer (BOLERO-1): a phase 3, randomised, double-blind, multicentre trial. Lancet Oncol. 2015;16(7):816-829.
-
45. Tolaney S, Burris H, Gartner E, Mayer I, Saura C, Maurer M et al. Phase I/II study of pilaralisib (SAR245408) in combination with trastuzumab or trastuzumab plus paclitaxel in trastuzumab-refractory HER2-positive metastatic breast cancer. Breast Cancer Res Treat. 2014;149(1):151-161.
-
46. Adjuvant chemotherapy in oestrogen-receptor-poor breast cancer: patient-level meta-analysis of randomised trials. The Lancet. 2008;371(9606):29-40.
-
47. Bernhard J, Zahrieh D, Castiglione-Gertsch M, Hürny C, Gelber R, Forbes J et al. Adjuvant Chemotherapy Followed By Goserelin Compared With Either Modality Alone: The Impact on Amenorrhea, Hot Flashes, and Quality of Life in Premenopausal Patients—The International Breast Cancer Study Group Trial VIII. J Clin Oncol. 2007;25(3):263-270.
-
48. Rose C, Vtoraya O, Pluzanska A, Davidson N, Gershanovich M, Thomas R et al. An open randomised trial of second-line endocrine therapy in advanced breast cancer. Eur J Cancer. 2003;39(16):2318-2327.
-
49. Coombes R, Hall E, Gibson L, Paridaens R, Jassem J, Delozier T et al. A Randomized Trial of Exemestane after Two to Three Years of Tamoxifen Therapy in Postmenopausal Women with Primary Breast Cancer. N Engl J Med. 2004;350(11):1081-1092.
-
50. Baselga J, Campone M, Piccart M, Burris H, Rugo H, Sahmoud T et al. Everolimus in Postmenopausal Hormone- Receptor–Positive Advanced Breast Cancer. N Engl J Med. 2012;366(6):520-529.
-
51. Finn R, Martin M, Rugo H, Jones S, Im S, Gelmon K et al. Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med. 2016;375(20):1925-1936.
-
52. Im S, Lu Y, Bardia A, Harbeck N, Colleoni M, Franke F et al. Overall Survival with Ribociclib plus Endocrine Therapy in Breast Cancer. NEngl J Med. 2019;381(4):307-316.
Recibido: Noviembre 02,2020
Aceptado: Diciembre 03,2020
Correspondencia:
Hernán Carranza
carranza.hernan@gmail.com
Autor
1 Hernán Carranza. Grupo Oncología Clínica y Traslacional, Instituto de Oncología, Colsánitas, Bogotá, Colombia. Investigador Asociado ONCOLGroup. Fundación para la Investigacion Clínica y Molecular Asociada al Cáncer FICMAC.