Artículo de Reflexión
Juan-Manuel Anaya1, John M. González2, Vivian Villalba-Vizcaíno3, Pablo Patiño4, Camila Rengifo5, Carlos Trillos6, Luis Fernando Gamboa7
Resumen
Frente al panorama creciente de contagios y con restricciones tanto financieras como logísticas para el acceso oportuno a las vacunas disponibles para la COVID-19, ¿valdría la pena, desde el costo-beneficio como de la selección de candidatos, evaluar la inmunidad individual contra SARS-CoV-2 para la optimización y priorización de la vacunación en países con dichas restricciones? Basados en la respuesta inmune al SARSCoV-2, los antecedentes históricos y las condiciones del país, se presentan argumentos para la discusión de la evaluación individual de la inmunidad al SARS-CoV-2 en la estrategia de vacunación. Si tal fuese el escenario, la implementación de una prueba costo efectiva y reproducible debería ser discutida y un estudio piloto considerado, el cual podría ser también útil en la evaluación de la inmunogenicidad de las vacunas.
Palabras clave: COVID-19; SARS-CoV-2; Vacunas; inmunidad; anticuerpos; costo-efectividad; política pública.
Immunity and Vaccination Against COVID-19
Abstract
Given the spread of infection and the fi nancial and logistical constraints regarding timely access to the vaccines available for COVID-19, would it be worthwhile, from both a cost-benefi t and candidate selection standpoint, to evaluate individual SARS-CoV-2 immunity for optimizing and prioritizing vaccination in countries with such restrictions? Based on the immune response to SARS-CoV-2, historical background and country conditions, arguments are presented to discuss individual assessment of immunity to SARS-CoV-2 as part of the National COVID-19 Vaccine Program. If this were the scenario, the implementation of a cost-eff ective and reproducible test should be discussed and a pilot study considered, this could also be useful in the evaluation of the immunogenicity of the vaccines.
Keywords: COVID-19; SARS-CoV-2; Vaccines; immunity; antibodies; cost-eff ectiveness; public policy
Introducción
La historia natural de la COVID-19, enfermedad causada por el SARS-CoV-2, comienza a conocerse gracias a la investigación científica. No todos los pacientes que se infectan desarrollan la enfermedad. Un porcentaje variable de la población infectada, pero que corresponde a la mayoría, es asintomático o presenta síntomas leves. En los demás infectados, 15% al 30%, la enfermedad puede ser severa o crítica.
Frente al panorama creciente de contagios, con restricciones tanto financieras como logísticas para el acceso a las vacunas recientemente disponibles, ¿valdría la pena, desde el costo-beneficio como de la selección de candidatos, evaluar la inmunidad individual contra SARS-CoV-2 para la optimización y priorización de la vacunación en países con dichas restricciones?
El Plan Nacional de Vacunación COVID-19 en Colombia recomienda no incluir a personas con antecedente de COVID-19 en la fase 1 (1); sin embargo, no se considera la valoración de la inmunidad humoral, la cual podría permitir seleccionar mejor los candidatos y contribuir a optimizar las dosis, más aún cuando el número de contagios es impreciso, por testeo insuficiente, subregistro y rezago; y dado que los resultados de los estudios de seroprevalencia no son útiles en situaciones individuales. En el presente artículo presentamos argumentos para la discusión acerca de la importancia de la evaluación individual de la inmunidad humoral al SARS-CoV-2 en la campaña de vacunación.
Respuesta inmune al SARS-CoV-2
El virus SARS-CoV-2 induce una respuesta inmune celular, anticuerpos específicos y memoria inmunológica (2,3). La respuesta inmune humoral contra SARS-CoV-2 está dirigida principalmente contra las proteínas S y N (abreviado respectivamente de “spike” y nucleocápside) del virus (4). Esta respuesta de anticuerpos varía entre individuos y según la gravedad de la enfermedad (5). Grzelak y col. (6) observaron en pacientes hospitalizados con COVID-19 una seroconversión y anticuerpos neutralizantes, que se unen al virus e interfieren con su capacidad de infectar células, entre 5 y 14 días después del inicio de los síntomas. Los niveles de anticuerpos IgG contra la proteína S se correlacionan con niveles de los anticuerpos neutralizantes (5).
Dado el corto tiempo trascurrido desde la aparición de la COVID-19 y con la evidencia disponible, no hay certeza sobre la duración de la respuesta inmune contra el SARS-CoV-2. En el estudio de Wang y col. (7) los anticuerpos neutralizantes fueron bajos durante los primeros 7 a 10 días después del inicio de los síntomas y aumentaron posteriormente.
La respuesta humoral se acompaña de una respuesta celular. Dan y col. (3) observaron que los anticuerpos IgG contra a la proteína S fueron relativamente estables durante más de 6 meses, y que las células B de memoria específicas de la proteína S fueron más abundantes a los 6 meses que al mes después de la aparición de los síntomas. Los linfocitos T CD4+ específicos del SARS-CoV-2 y los T CD8+ disminuyeron con una vida media de 3-5 meses. Las cinéticas de anticuerpos, células B de memoria, linfocitos T CD4+ y T CD8+ para el SARS-CoV-2 fueron diferentes (3).
De la misma manera que no hay certeza con respecto a la duración de la inmunidad natural, no la hay sobre la duración de la inmunidad adquirida por vacunación. Sin este conocimiento, el cálculo de la inmunidad colectiva podría ser impreciso. De otra parte, dada la diversidad de los métodos utilizados en los estudios de seroprevalencia y la ausencia de uno universal para la detección de anticuerpos contra SARS-CoV-2, la comparación de los resultados es difícil e inexacta.
Métodos de detección de anticuerpos
Hay dos tipos generales de pruebas de anticuerpos: aquellas que detectan anticuerpos de unión y aquellas que detectan anticuerpos neutralizantes. Las primeras usan proteínas purificadas de SARS-CoV-2 para determinar la unión de anticuerpos, en alguna de las siguientes plataformas: ensayo inmunocromatográfico a base de oro coloidal (también conocido como inmunoensayo de flujo lateral), inmunoensayo quimioluminiscente (CLIA), y ensayo inmunoabsorbente ligado a enzimas (ELISA). Las dos últimas son muy específicas y permiten la semi-cuantificación de la respuesta inmune y, en ocasiones, la cuantificación. Ambas son altamente reproducibles (8). La diferencia más importante está en la sensibilidad, las técnicas luminométricas (CLIA) son más sensibles. Las pruebas para detección de anticuerpos neutralizantes exigen la utilización de cultivos celulares en presencia del virus o, en su defecto, de un pseudovirus (9).
Perspectiva histórica
En algunas enfermedades infecciosas la inmunidad natural es superior a la de la vacuna (p.ej., sarampión, varicela y paperas) y en otras ocurre lo contrario (p.ej., neumococo, meningococo, virus del papiloma humano) (10). A nivel individual, la determinación previa del estado inmunológico frente a un agente infeccioso es importante para la toma de decisión de vacunarse. Algunas vacunas generan una respuesta inmune que puede disminuir con el tiempo requiriendo un refuerzo, el cual es guiado por el examen de anticuerpos (p.ej., Hepatitis B) (10). Sin embargo, la medición del estado inmunológico contra el SARS-CoV-2 podría no ser una medida apropiada, dado que no se cuenta con un método universal para la medición de la inmunidad humoral ni celular. Tampoco existe un antecedente de vacunación masiva con estudio serológico previo, el cual podría retrasar el proceso de vacunación.
Análisis de costos
En Colombia, en el 2020, se registraron 1.642.775 personas contagiadas (https://www.ins.gov.co/Noticias/ Paginas/Coronavirus.aspx) equivalente, aproximadamente, a un 3,4% de los más de 48.3 millones de habitantes que estima el Departamento Administrativo Nacional de Estadística (https://www.dane.gov.co/) para la población total del país. La tasa de letalidad fue 2,63%. Así, las necesidades de vacunación total se acercarían a 46.6 millones de habitantes, descontando la población infectada (se debería excluir también, por ahora, la población infantil), y sin tener en cuenta a la población migrante, que tendría derecho a la vacuna por principio universal.
Independiente de la vacuna seleccionada, el costo de vacunar la totalidad de la población colombiana estaría entre 1.86 y 3.73 billones de pesos al incluir los costos de la vacuna, el costo económico asociado al ingreso que deja de percibir el trabajado informal y el costo operativo de la vacunación (11). Este valor asume un esquema veloz de vacunación y, por lo tanto, no considera el costo que puede generar una vacunación pausada en la que un porcentaje de la población continuará contagiándose. Adicionalmente, hay preocupación sobre la capacidad estatal para la vacunación en zonas alejadas de las principales ciudades, donde las capacidades instaladas y humanas son modestas.
La incapacidad de disponer de dosis oportunas para la población, de aplicarlas a una velocidad superior a la del contagio y la posibilidad de vacunar a personas con inmunidad natural, son razones para considerar las pruebas de anticuerpos como argumento para la priorización.
En la Tabla 1 se presentan los valores de referencia para el cálculo de la costo- efectividad de una prueba de inmunidad. Con un 20% de inmunidad, se estaría gastando ineficientemente el equivalente a 9.387.600 vacunas por las cuales se invertirían recursos por algo más de 2.8 billones de pesos. Esto quiere decir que, al dividir estos dos valores, el costo perdido por unidad es de $298.288 pesos y sería lo máximo que se podría gastar en una prueba de anticuerpos.
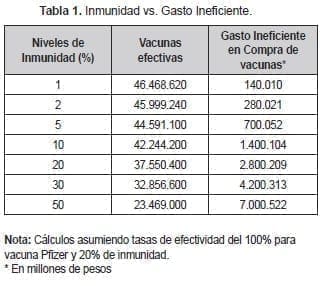
El segundo valor de referencia es mayor, porque considera el costo que se incurre en el tratamiento de la población mayor. No hay una cifra exacta ante la ausencia de evidencia sobre la capacidad de los adultos mayores de generar inmunidad. Asumiendo un nivel de inmunidad del 70%, el 30% de los adultos podrían generar sobrecostos por atención adicional. En dicho caso el valor máximo para una prueba de inmunidad sería de $509.000 aproximadamente.
Los recursos económicos involucrados son muy altos y los impactos que generan sobre la sociedad justifican preguntarse no solo por el esquema de priorización poblacional, sino también por alternativas para hacer más eficiente este esfuerzo fiscal que el Estado está asumiendo con cargo a futuros sacrificios en términos de política pública.
(Lea También: Historia del Cáncer y el Cáncer en la Historia)
¿Qué es y por qué es importante la inmunidad de rebaño?
La inmunidad de rebaño (del inglés “herd inmunity”) es también conocida como inmunidad de grupo, colectiva o comunitaria, y hace referencia a la protección que adquiere una población contra una enfermedad infecciosa específica. Se logra cuando se alcanza el umbral de inmunidad colectiva, es decir, el punto en el cual la proporción de personas susceptibles es inferior a la necesaria para la transmisión del agente infeccioso.
Para calcular el umbral hay varios modelos matemáticos, que incluyen el número reproductivo básico (R0), que corresponde al número de personas infectadas por un individuo en una población totalmente susceptible, lo cual ocurre al inicio; o el número reproductivo efectivo (Re), o número de infectados por un caso en una población parcialmente inmune (12), el cual cambia durante el tiempo en función de las medidas de control que se aplican. Por lo tanto, el umbral y la inmunidad colectiva son dinámicos.
La forma adecuada de lograr la inmunidad colectiva es mediante la vacunación de la población. La inmunidad colectiva es importante para proteger a las personas que no pueden vacunarse. Se ha estimado que para generar inmunidad colectiva es necesario vacunar al 70% de la población (1,13).
Sin embargo, la cifra podría ser inexacta por la variablidad en los factores que afectan el cálculo del umbral (Re, composición y características de la población, e inmunidad adquirida) así como por la posibilidad de reinfección; todo lo cual favorecería la necesidad de evaluar la inmunidad humoral individual antes de la vacunación. Recientemente se estimó, en un modelo matemático, el impacto de la evaluación de la inmunidad humoral individual en función de la edad de quienes se vacunarían; y se observó una mejoría en el beneficio marginal por dosis (14).
¿Qué es la reinfección y qué tan importante es en el contexto de las vacunas actuales?
La reinfección se refiere a la posibilidad de volver a sufrir un proceso infeccioso producido por un agente que ya produjo un evento previo. En SARS-CoV-2, así como sucede con otros coronavirus, la reinfección no es la excepción (https://bnonews.com/index.php/reinfectiontracker-suspected-cases/ ). Este es un argumento a favor de la vacunación generalizada sin necesidad de conocer el estado inmunológico, siempre y cuando las vacunas protejan contra las nuevas variantes virales.
La reinfección debe sospecharse cuando se contrae la enfermedad nuevamente (confirmada mediante prueba diagnóstica), un tiempo después, generalmente superior a 90 días, de haberse recuperado. En este caso, la reinfección debe confirmarse por secuenciamiento y demostración de nuevas mutaciones. La reinfección es un factor muy importante a monitorear en enfermedades infecciosas, ya que es un indicio de disminución de la respuesta inmune protectora, o de mutaciones.
De lo innato y el medio ambiente
Los factores genéticos, epigenéticos y medioambientales influyen en el desarrollo de enfermedades trasmisibles y no trasmisibles. Las características internas de una población pueden afectar el desarrollo y severidad de una infección. Esto explica porque un grupo variable de individuos sanos no desarrolla la enfermedad luego de la exposición a un microorganismo, o porque hay grupos vulnerables que la desarrollan de forma más severa que otros.
La influencia de la etnicidad en el riesgo y severidad de la COVID-19 ha sido observada (15), así como el efecto del índice de pobreza (16) y de la contaminación del aire (16,17) en la mortalidad. Las interacciones huésped-patógeno son vitales para comprender las enfermedades infecciosas, su tratamiento y prevención. Así como existe una susceptibilidad poblacional e individual (“The COVID-19 host genetics initiative” https://www.covid19hg.org/results/), considerar la variación del genoma del SARS-CoV-2 (18) (www.gisaid. org ) contribuirá al conocimiento de la patogénesis de la COVID-19 y a las estrategias de prevención, incluyendo la vacunación.
Otro aspecto medioambiental que influye en la respuesta inmune es el estado nutricional (19), incluyendo los niveles de ciertas vitaminas, en particular la vitamina D, cuya deficiencia ha sido asociada con la severidad de la COVID-19 (20). Estudios que evalúan su eficacia en la enfermedad se están llevando a cabo. La relación entre Vitamina D y vacunación contra COVID-19 no se conoce.
Conclusión
La evaluación individual de la inmunidad al SARSCoV- 2 podría contribuir en la estrategia de optimización y priorización de la vacunación. Si tal fuese el escenario, la implementación de un método reproducible y costo-efectivo debería ser considerada, y una prueba piloto realizada, la cual, podría ser útil, adicionalmente, para la evaluación de la inmunogenicidad de las vacunas y toma de decisiones futuras.
Agradecimientos
Los autores agradecen a todos quienes nos compartieron sus opiniones durante el desarrollo de este artículo (https://twitter.com/JuanMAnayaC/status/133668 1065524629507?s=20), a Gustavo Gámez, de la Universidad de Antioquia, Colombia; y a Jorge Osorio, de la Universidad de Wisconsin, E.U.
Conflicto de interés
Los autores declaramos no tener ningún conflicto de interés. Las opiniones expresadas no corresponden a posturas institucionales ni oficiales.
Referencias
-
1. Plan Nacional de Vacunación Contra el COVID-19 [Internet]. 2021 [consultado 06 enero 2021]. Disponible en: https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/ RIDE/VS/pnv-contra-covid-19.pdf
-
2. Tay MZ, Poh CM, Rénia L, MacAry PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 2020;20:363-74.
-
3. Dan JM, Mateus J, Kato Y, Hastie KM, Yu ED, Faliti CE et al. Immunological memory to SARS-CoV-2 assessed for up to 8 months after infection. Science. 2021;eabf4063.
-
4. Shrock E, Fujimura E, Kula T, Timms RT, Lee IH, Leng Y et al. Viral epitope profiling of COVID-19 patients reveals cross-reactivity and correlates of severity. Science. 2020;370:eabd4250.
-
5. Okba NMA, Müller MA, Li W, Wang C, GeurtsvanKessel CH, Corman VM et al. Severe acute respiratory syndrome coronavirus 2-specific antibody responses in coronavirus disease patients. Emerg Infect Dis. 2020;26:1478- 88.
-
6. Grzelak L, Temmam S, Planchais C, Demeret C, Tondeur L, Huon C et al. A comparison of four serological assays for detecting anti-SARS-CoV-2 antibodies in human serum samples from different populations. Sci Transl Med. 2020;12:eabc3103.
-
7. Wang K, Long QX, Deng HJ, Hu J, Gao QZ, Zhang GJ et al. Longitudinal dynamics of the neutralizing antibody response to SARS-CoV-2 infection. Clin Infect Dis. 2020;ciaa1143.
-
8. Guo CC, Mi JQ, Nie H. Seropositivity rate and diagnostic accuracy of serological tests in 2019-nCoV cases: a pooled analysis of individual studies. Eur Rev Med Pharmacol Sci. 2020;24:10208-10218.
-
9. Chau CH, Strope JD, Figg WD. COVID-19 clinical diagnostics and testing technology. Pharmacotherapy. 2020;40:857-868.
-
10. Bloom BR, Lambert P-H. The Vaccine Book, 2a ed. Elsevier, 2016.
-
11. Inmunidad y vacunación Suplementario.xlsx [Internet]. Google Docs. 2021 [consultado 06 enero 2021] Disponible en: https://drive.google.com/file/d/11bxByeahvgnjnU n0TaKCtOaXW8pP76f1/view?usp=drivesdk
-
12. Randolph HE, Barreiro LB. Herd Immunity: Uniderstanding COVID-19. Immunity. 2020;52:737-41.
-
13. Aschwanden C. The false promise of herd immunity for COVID-19. Nature. 2020;587(7832):26-8.
-
14. Bubar KM, Reinholt K, Kissler SM, Lipsitch M, Cobey S, Grad YH et al. Model-informed COVID-19 vaccine prioritization strategies by age and serostatus. medRxiv 2020.09.08.20190629
-
15. Sze S, Pan D, Nevill CR, Gray LJ, Martin CA, Nazareth J et al. Ethnicity and clinical outcomes in COVID-19: A systematic review and meta-analysis. EClinicalMedicine. 2020;29:100630.
-
16. Rodriguez-Villamizar LA, Belalcázar-Ceron LC, Fernández- Niño JA, Marín-Pineda DM, Rojas-Sánchez OA, Acuña-Merchán LA et al. Air pollution, sociodemographic and health conditions effects on COVID-19 mortality in Colombia: An ecological study. Sci Total Environ. 2020;144020.
-
17. Pozzer A, Dominici F, Haines A, Witt C, Münzel T, Lelieveld J. Regional and global contributions of air pollution to risk of death from COVID-19. Cardiovasc Res. 2020;116(14):2247-2253.
-
18. Lauring AS, Hodcroft EB. Genetic Variants of SARSCoV- 2-What Do They Mean? JAMA. 2021;.Zimmermann P, Curtis N. Factors that influence the immune response to vaccination. Clin Microbiol Rev. 2019;32:e00084-18.
-
19. Pereira M, Dantas Damascena A, Galvão Azevedo LM, de Almeida Oliveira T, da Mota Santana J. Vitamin D deficiency aggravates COVID-19: systematic review and meta-analysis. Crit Rev Food Sci Nutr. 2020;:1-9. Recibido: Enero 5, 2021 Aceptado: Enero 8, 2021 Correspondencia: Juan-Manuel Anaya juan.anaya@urosario.edu.co