La Medicina medieval se vio impotente ante la Peste. Los conocimientos acerca de ella, eran muy precarios y, desde tiempos de Galeno e Hipócrates, no eran muchos los avances en conocimientos médicos. Por eso, los tratamientos recetados contra la Peste Negra, al igual que contra otras dolencias, se basaban en la alimentación, la purificación del aire, las sangrías y en la administración de brebajes a base de hierbas aromáticas y piedras preciosas molidas.
Peste bubónica
A quienes contraían la peste bubónica, los facultativos les abrían los bubos, Aplicándoles sustancias para neutralizar el veneno (5). Marcelino Amasuno Sárraga destacó el esfuerzo que hicieron algunos médicos durante la peste en la Corona de Castilla, a lo largo de la mitad del siglo XIV, por estudiar la enfermedad, sus causas, sus posibles vías de contagio, tratamientos y métodos de prevención.
En los tratados se describieron los síntomas, sin conocer las causas y, lo que es más importante, sin encontrar un tratamiento efectivo (19). Siglos después se sabría la verdad; en 1894, el gobierno francés y el Instituto Pasteur, le encargaron a Alexandre Yersin que estudiara la naturaleza de la peste bubónica, lo que favoreció, el 20 de junio, el logro de aislar el bacilo responsable.
Yersin demostró la relación entre la enfermedad humana y la de la rata, exploró los bubones y generó sueros a partir de ellos. Un mes después del hallazgo de la Yersinia pestis, Ducloux leyó ante los miembros de la Academia de Ciencias de Francia, el texto final sobre el patógeno (“La peste bubonique de Hong-Kong”) (20).
(Lea También: Viruela: El Monstruo Moteado)
De regreso a París, Yersin continuó por muy poco tiempo sus trabajos en el Instituto Pasteur con Roux, Borrel y Calmette.
Pronto tuvo que trasladarse a Nha Trang, donde fundó un laboratorio, que más tarde sería el Instituto Pasteur de Nha Trang (1905), destinado fundamentalmente, al estudio de las enfermedades humanas transmisibles y del ganado de la zona. En 1896, partió hacia China (Canton y Amoy), donde probó la solución contra la enfermedad elaborada previamente en París, sin mayor éxito.
No obstante, se unió a la Comisión India para la Investigación de la peste y logró determinar, en 1902, sobre más de 1.000 pacientes tratados en el Hospital de Martha (Bombay), que el 43% tenían bacteremias, evento que aumentaba notablemente la fatalidad.
De igual forma, estableció el índice de recuperación (≈18%) y determinó que, para hacer efectiva la infección de una pulga, se necesitaban cerca de 2.000 bacterias por cc3. Este hecho, también permitió establecer que la bacteremia en las ratas negras era mucho mayor (500 a 1.000 veces superior que en los seres humanos), hecho necesario para la expansión de los focos (21).
Luego de Yersin, la presunción de la erudición de los doctores Pico de Roma (Figura 3) se hizo conocimiento esencial contemporáneo, gracias a la paleogenómica de las grandes pandemias.

Recientemente, Schmid (22) describió una nueva dinámica para la Peste Negra entre los roedores silvestres y su propagación a los seres humanos, a partir del Asia Central.
Para ellos, la prevalencia de la peste entre los grandes jerbos*** (Rhombomys opimus) en Kazajstán se vio fuertemente afectada por los manantiales más cálidos y los veranos más húmedos de 1325 (23). Este hecho se correlacionó con la creciente densidad de la población de los jerbos y pulgas, una tormenta perfecta (24).
Cuando las condiciones climáticas afectan uniformemente grandes áreas geográficas, como ocurrió en la baja Edad Media, se pueden sincronizar las densidades de jerbos a escala regional en un proceso conocido como el efecto Moran (25-27).
Tal sincronización, impulsada por el clima en altas densidades de roedores, facilita aún más la filtración de la peste en toda una región (28).
A medida que las poblaciones de jerbos colapsan en respuesta a los cambios climáticos, la densidad de pulgas aumenta drásticamente, lo que facilita aún más, la propagación de la peste en la población de roedores y hace que las pulgas busquen hospedadores alternativos, incluidos los humanos y sus animales domésticos (29).
Wheelis, circunscribió la introducción de la Yersinia en Europa a un periodo de 60 años, que se trasladó inicialmente desde el Sur de Rusia, en 1345, a Caffa en Crimea, en 1346; de allí, pasó a Constantinopla, luego a Messina en 1347 y llegó a los puertos continentales a principios de 1348 (30).
Posteriormente, Dols generó un subconjunto de posibles introducciones marítimas que siguieron el camino de la peste, también seleccionó aquellos años subsecuentes a las apariciones registradas por filogenia en el sur de Rusia o en el Cáucaso, y encontró una lista restringida de 16 años para las posibles reintroducciones entre continentes, así: 1346, 1408, 1409, 1689, 1693, 1719, 1730, 1737, 1757, 1760, 1762, 1780, 1783, 1828, 1830, y 1837 (31).
Hace poco, Namouchi y colaboradores, buscaron trazas del vetusto camino de la Yersinia, su filogenia y orbe.
Persiguiendo la penumbra de la peste, encontraron dos cepas (SLC1006 y OSL1) con genomas idénticos a los hallados en restos de 1350, en Londres y Barcelona (Londres 1348 y Barcelona 3031) (32).
Estas cepas se extrajeron de excavaciones realizadas en Saint-Laurent-de-la-Cabrerisse, evento que podría sugerir un origen alternativo que se mantuvo vigente a lo largo de un siglo en el sur de Francia, siguiendo la ruta de Narbona, Carcasona, Marsella, París, Cornwell, Londres y Oslo (33,34).
Es importante tener en cuenta que, aunque las muestras identificadas en Saint-Laurent-de-la-Cabrerisse, Barcelona, Londres, París y Oslo parecen ser idénticas, esta similitud se basa únicamente en las regiones del cromosoma cubiertas y analizadas.
Las regiones no cubiertas, así como la variación estructural y de plásmidos, que podrían explicar diferencias adicionales entre las cepas, no se han evaluado ni considerado en ningún estudio dedicado a la filogenia de la plaga, considerando el genoma de la Yersinia.
La confirmación sobre la transmisibilidad y patogenicidad de la Yersinia pestis, se logró gracias a la exploración de más de 2.400 restos óseos de fosas comunes de Montpellier y Londres.
El estudio del ADN de la pulpa dental de cuerpos encontrados en el año 2000 por Didier Raoult, microbiólogo de la Universidad del Mediterráneo en Marsella, demostró el vínculo entre la Yersinia pestis y la muerte de al menos un niño y dos adultos, desenterrados en un lugar de muerte masiva del siglo XIV (35).
A pesar de las múltiples dudas sobre la posibilidad de contaminación del ADN que condujo a una interpretación errónea de la secuencia de la Yersinia pestis, la osteoarqueóloga Jelena Bekvalac examinó en profundidad (finales de la década de 1990) el esqueleto, casi completo, de uno de los antiguos dolientes del pozo de la peste, del cementerio del este de Smithfield.
En seguida, Krause y Poinar, recurrieron al uso de la secuenciación de fragmentos cortos para encontrar el plásmido pPCP1, parcialmente responsable del daño generado por la peste bubónica al infectar a los humanos (36).
Poco después, Krause completó el código del genoma antiguo y demostró que se encuentra en la raíz de una evolución arbórea, que comprende y termina en 17 cepas contemporáneas de Yersinia pestis.
Esto significa que una única cepa de patógeno, originó la Peste Negra, se diversificó y se diferenció de la semilla de la Peste de Justiniano.
Un análisis complementario por microsatélites, concluyó que el ADN de la Peste de Justiniano y de la segunda pandemia, correspondía a biovar Orientalis (ahora designado 1.ORI).
Un estudio ulterior demostró la presencia de una deleción glpD de 96 pb, característica de 1.ORI en muestras del siglo VII al IX (plaga de Justiniano) y alrededor de 1720 (el final de la segunda pandemia), mientras Krause no evidenció la deleción de glpD en el ADNc de la Yersinia pestis del período de la Muerte Negra.
No se probó la presencia de ADN de las mismas fuentes y fechas, y no es posible excluir la posibilidad de que las bacterias 1.ORI fueran importadas de Asia Oriental, tanto antes como después de la Peste Negra (37).
La Figura 4 muestra el detalle de la excavación de Smithfield en Londres, los restos evaluados y el análisis filogenético que confirma la ancestralidad de la Yersisina pestis como patógeno de la Peste Negra.
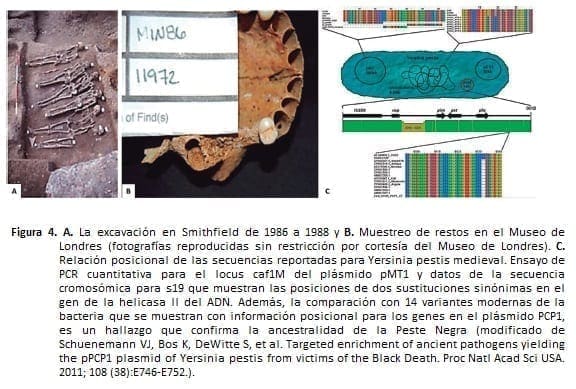
Después de 673 años, la ciencia, derivada de arcanos y doctores Pico de Roma, ha logrado descifrar el origen de la muerte en el medioevo, la mayor pandemia de la historia.
Conflicto de interés
Los autores declara no tener ningún conflicto de interés.
Referencias
- 1. Bloom JM. Papermaking: The Historical Diffusion of an Ancient Technique. In: Jöns H, Meusburger P, Heffernan M. (eds). Mobilities of Knowledge. Knowledge and Space, vol 10. UK: Springer International Publishing. 2017. p. 51-66.
- 2. Aurell J. Introducción. La transversalidad de la historia de la muerte en la Edad Media. En: Aurell J y Cardona J (coord.). Ante la Muerte. Actitudes, espacios y formas en la España medieval. España: Ediciones Universidad de Navarra; 2002. p. 9- 26.
- 3. Wilson RM. A history of medicine. London: Benn’s Sixpenny Library No. 148; 1930. p. 5-6.
- 4. De Piazza M. Historia secula anno 1337 ad annum 1361. En: Duby G. Europa en la Edad Media. España: Paidós; 1986. p. 160.
- 5. Ziegler P. The Black Death. Middlesex, England: Pelican Books – Penguin Books; 1971. p. 1-247.
- 6. Benedictow OJ. La Peste Negra (1346-1353), la historia completa. España: Ed. Akal Universitaria, Serie Historia Medieval; 2011. p. 7-526.
- 7. Amasuno Sárraga M. La Peste en la Corona de Castilla durante la Segunda Mitad del siglo XIV. España: Junta de Castilla y León; 1996.
- 8. D´Irsay S. An historical dictionary of medicine. Lpz: Kiklos; 1926. p. 328-332. 9. Crónica del muy alto et muy católico rey D. Alfonso Onceno; Biblioteca de Autores Españoles, tomo 66, Madrid, 1953. I, p. 391. En: Amasuno Sárraga M. La Peste en la Corona de Castilla. España: Junta de Castilla y León; 1996. p. 65.
- 10. Monteano P. La Peste Negra en Navarra. La catástrofe demográfica de 1347-1349. Príncipe de Viana. 2001; 62 (222): 23.
- 11. Carreras Pachón A. Aspectos Médicos en La Peste Negra (Dossier). Historia. 1980; 56 (16): 53.
Bibliografía
- 12. Valdeón J. “La Peste Negra”, en Edad Media. El esplendor de una época. National Geographic. Volumen especial 2011: 90-91.
- 13. Le Goff J. La Civilización del Occidente Medieval. Barcelona: Editorial Paidós; 1999.
- 14. Jacques P. El Cristianismo Occidental en la Edad Media. Valencia: Universitat de Valencia, Servei de Publicacions; 2014.
- 15. Toman R. El Románico. Colonia: Konemann; 1996.
- 16. Áres P. Historia de la muerte en Occidente. Desde la Edad Media hasta nuestros días. 2a ed. Barcelona: Editorial Acantilado; 2000.
- 17. Eco U. Historia de la Fealdad. Tercera edición. Barcelona: Editorial Random House; 2011.
- 18. Gottfired RS. La muerte Negra: Desastres en la Europa Medieval. México: Fondo de Cultura Económica; 1989.
- 19. Claramunt S. Historia de la Edad Media. Barcelona: Ariel; 2006. p. 262.
- 20. Closel E. Docteur Nam: la fabuleuse histoire de l’homme qui soigna la peste. París: Albin Michel; 1996. p. 251.
- 21. Salomon T. Alexandre Yersin and the plague bacillus. J Trop Medicine Hygiene. 1995; 98(3): 209-212.
- 22. Schmid BV, Büntgen U, Easterday WR, et al. Climate-driven introduction of the Black Death and successive plague reintroductions into Europe. Proc Natl Acad Sci U S A. 2015 Mar 10; 112(10): 3020–3025.
- 23. Stenseth NC, Samia NI, Viljugrein H, et al. Plague dynamics are driven by climate variation. Proc Natl Acad Sci U S A. 2006 Aug 29; 103(35): 13110-5.
- 24. Reijniers J, Davis S, Begon M, et al. A curve of thresholds governs plague epizootics in Central Asia. Ecol Lett. 2012 Jun; 15(6): 554-60.
- 25. Kausrud KL, Viljugrein H, Frigessi A, et al. Climatically driven synchrony of gerbil populations allows large-scale plague outbreaks. Proc Biol Sci. 2007 Aug 22; 274(1621): 1963-9.
Fuentes
- 26. Hudson PJ, Cattadori IM. The Moran effect: a cause of population synchrony. Trends Ecol Evol. 1999 Jan; 14(1): 1-2.
- 27. Koenig WD. Global patterns of environmental synchrony and the Moran effect. Ecography. 2002; 25(3): 283–288.
- 28. Davis S, Trapman P, Leirs H, et al. The abundance threshold for plague as a critical percolation phenomenon. Nature. 2008 Jul 31; 454(7204): 634-7.
- 29. Samia NI, Kausrud KL, Heesterbeek H, et al. Dynamics of the plague-wildlife-human system in Central Asia are controlled by two epidemiological thresholds. Proc Natl Acad Sci U S A. 2011 Aug 30; 108(35): 14527-32.
- 30. Wheelis M. Biological warfare at the 1346 siege of Caffa. Emerg Infect Dis. 2002 Sep; 8(9): 971-5.
- 31. Dols MW. The second plague pandemic and its recurrences in the Middle East: 1347-1894. J Econ Soc Hist Orient. 1979; 22(2): 162-89.
- 32. Namouchi A1, Guellil M2, Kersten O, et al. Integrative approach using Yersinia pestis genomes to revisit the historical landscape of plague during the Medieval Period. Proc Natl Acad Sci U S A. 2018. Dec 11; 115(50): E11790-E11797. Doi: 10.1073/pnas.1812865115. Epub 2018 Nov 26.
- 33. Haensch S, Bianucci R, Signoli M, et al. Distinct clones of Yersinia pestis caused the Black Death. PLoS Pathog; 2010. Oct 7; 6(10): e1001134.
- 34. Kacki S, Rahalison L, Rajerison M, et al. Black Death in the rural cemetery of Saint-Laurent-de-la-Cabrerisse Aude-Languedoc, southern France, 14th century: Immunological evidence. J Archaeol Sci. 2011; 38: 581–587.
- 35. Raoult D, Aboudharam G, Crubézy E, et al. Molecular Identification by “Suicide PCR” of Yersinia Pestis as the Agent of Medieval Black Death. Proc Natl Acad Sci USA; 2000. Nov 7; 97(23): 12800-3.
Lecturas Recomendadas
- 36. Schuenemann V, Bos K, DeWitte S, et al. Targeted Enrichment of Ancient Pathogens Yielding the pPCP1 Plasmid of Yersinia Pestis From Victims of the Black Death. Proc Natl Acad Sci USA. 2011 Sep 20; 108(38): E746- 52.
- 37. Haensch S, Bianucci R, Signoli M, et al. Distinct clones of Yersinia pestis caused the Black Death. PLoS Pathog. 2010; 6(10): e1001134. Published 2010 Oct 7.
Recibido: 5 de junio de 2020
Aceptado: 20 de junio de 2020
Correspondencia:
María Margarita López
mariamlopezf@outlook.com






