Luego del brote en la Polinesia Francesa, la infección fue detectada en Nueva Caledonia, en las islas Cook, las Islas Salomón, Samoa, Vanuatu y la Isla de Pascua (Chile) (2,25). A finales del 2014, y comienzos de 2015, en el noroeste de Brasil, se informaron casos de pacientes con erupción cutánea, fiebre, conjuntivitis y artralgias, en los que se descartó vDEN y vCHIK (5).
Mediante un análisis filogenético se concluyó que el virus pertenecía al linaje asiático (32). Actualmente, el vZIKA circula en 59 países de mundo y, en particular, de manera autóctona en 33 países de Centro y Sur América (33), donde existe una amplia distribución de su vector natural de transmisión, el mosquito Aedes.
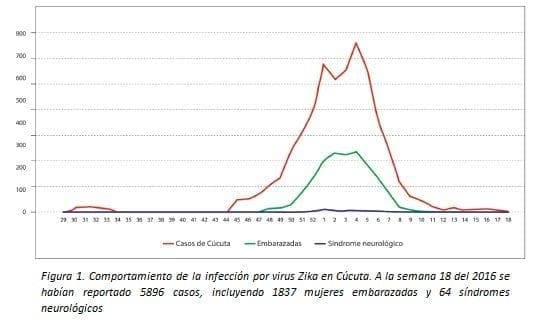
En Colombia, en septiembre de 2015, el Ministerio de Salud y la Protección Social reportó el primer caso autóctono de infección por VZIKA en el departamento de Bolívar, y la fase epidémica inició en la semana epidemiológica 40 del año 2015.
Entre esa fecha y la semana epidemiológica 27 de 2016, se notificaron 8.826 casos de infección por vZIKA confirmados y 89.962 sospechosos por clínica (7). Los departamentos del Valle del Cauca, Norte de Santander, Santander, Tolima y Huila, concentran el 57,3% del total de los casos de infección por vZIKA notificados (7). (Lea también: Artículo de Revisión: Autoinmunidad Neurológica en los Tiempos del Zika)
Se ha confirmado igualmente la circulación del virus en 507 municipios del territorio nacional. Antioquia es la entidad territorial con el mayor número de municipios con casos confirmados por laboratorio (48 municipios) (7). El mayor ingreso de casos al sistema de vigilancia se presentó en la semana epidemiológica 05 del año 2016 (6.259 casos). El promedio de notificación de las semanas epidemiológicas 23 a 27 fue de 1.207 casos/ semana (7).
El 66.09% de los casos confirmados y sospechosos de enfermedad por vZIKA se registra en mujeres. El 63,48% pertenecen al régimen contributivo; el 14,06% corresponden al grupo de edad entre los 25 a 29 años. El 2,58% se registró en menores de un año y el 3,27% en adultos de 65 y más años. Por pertenencia étnica se ha notificado el 0,69 % en indígenas y el 1,85 % en afrocolombianos (7).
Por otra parte, entre el 15 de Diciembre de 2015 y la semana epidemiológica 27 de 2016, se notificaron al sistema de vigilancia epidemiológica 603 casos de síndromes neurológicos (SGB, polineuropatías ascendentes, entre otras afecciones neurológicas similares) con antecedente de enfermedad febril compatible con infección por vZIKA, los cuales se encuentran en proceso de verificación (7). El 66% de dichos casos correspondería a SGB.
La mayor proporción de síndromes neurológicos se registró en pacientes masculinos (57,4%) y el grupo de edad más afectado fue el de 65 años o más (11,8%). El departamento de Norte de Santander registró la mayor proporción de casos de síndromes neurológicos asociados al vZIKA (13,60%).
En la Figura 1 se muestra el comportamiento del registro de casos de Zika según el Somos el Sistema Nacional de Vigilancia en Salud Pública (SIVIGILA). Es importante mencionar que durante la década de los años 60 del siglo pasado, la campaña de erradicación del Aedes fue exitosa en todo el territorio Colombiano, excepto en Cúcuta (34).
 Gangliósidos
Gangliósidos
Los gangliósidos hacen parte de una gran familia de glicoesfingolípidos compuestos por una porción ceramida unida a una porción oligosacárida que contiene ácido siálico. La presencia de estos ácidos siálicos en múltiples combinaciones hace explicable su gran heterogeneidad y sus propiedades físico-químicas complejas.
Mediante la porción ceramida los gangliósidos participan en funciones de soporte dentro de la membrana celular como en transducción de información a través de ella y con la porción oligosacárida puede unirse a una variedad de moléculas como toxinas e iones metálicos divalentes (35). Los gangliósidos, al ser un grupo tan heterogéneo de compuestos, presentan una nomenclatura compleja.
Existen dos formas de nombrarlos, una común, propuesta por Svennerholm en el año 1963 y otra más compleja propuesta por la Unión Internacional de Química Pura y Aplicada (IUPAC, por sus siglas en Inglés) en el año 1997. La nomenclatura de Svennerholm, mencionada en este artículo, se basa en un código alfanumérico.
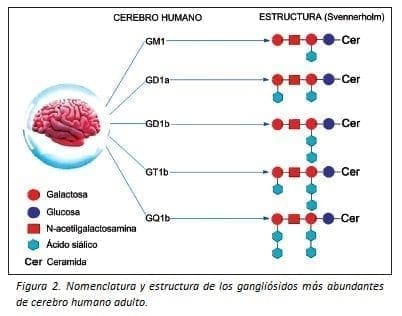
Una primera letra, G, designa a todos los gangliósidos. A continuación, se acompaña de la letra M, D, T o Q, según sean uno, dos, tres o cuatro, respectivamente, los residuos de ácido siálico que contiene la molécula. La longitud de la cadena glucídica se representa mediante un subíndice; el 1 indica que la cadena glucídica tiene cuatro monosacáridos (cadena completa); el 2, que la cadena carece de la galactosa terminal, el 3, que faltan la galactosa y la N-acetilgalactosamina y el 4, la cadena glucídica solo contiene glucosa. Finalmente, las letras a, b o c indican la posición de los ácidos siálicos (36).
Los gangliósidos forman parte de las membranas de las células nerviosas como ligando de la glicoproteína asociada a mielina donde mantiene la estabilidad y estructura de la vaina de mielina en el axón neuronal y ayuda a controlar la regeneración de los nervios (37). Los gangliósidos constituyen cerca del 0.6% de lípidos totales del cerebro, pero son más abundantes en neuronas.
Existen cinco gangliósidos (GM1, GD1a, GD1b, GT1a y GQ1b) que en conjunto representan la gran mayoría (97%) de los gangliósidos del cerebro humano adulto (Figura 2) (38,39). Estos cinco gangliósidos han sido descritos como autoantígenos reconocidos en pacientes con SGB (40).
 Relación entre Neuropatías autoinmunes y Anticuerpos Antigangliósidos
Relación entre Neuropatías autoinmunes y Anticuerpos Antigangliósidos
En las neuropatías autoinmunes se considera como factor inicial en su patogenia la presencia de una respuesta humoral específica dirigida contra glucolípidos de membrana. La presencia de autoanticuerpos contra gangliósidos, concretamente contra GM1, se describió por primera vez por Ilyas y colaboradores (41) en un paciente con polineuropatía y gammapatía monoclonal.
Desde entonces se han descrito anticuerpos frente a diferentes gangliósidos relacionados con diferentes síndromes clínicos, desde la esclerosis lateral amiotrófica a diferentes neuropatías, tanto agudas como crónicas de predominio motor, sensitivo o sensitivomotor (40).
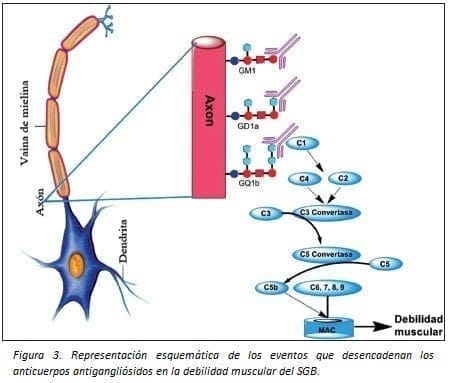
Actualmente, la investigación sobre el papel de los anticuerpos dirigidos contra los gangliósidos está relacionada con las neuropatías inflamatorias como el SGB. Los primeros autoanticuerpos asociados con este síndrome fueron reportados en 1988 (42). Se ha propuesto que estos autoanticuerpos activan el complemento en las células de Schwann, mielina o axones.
En efecto, una vez unidos los autoanticuerpos a los gangliósidos de las membranas presinápticas se produce debilidad muscular por fijación del complemento, formación del poro del complejo de ataque a la membrana y afluencia de calcio dentro del nervio terminal; lo cual conlleva al bloqueo en la conducción del nervio motor, degradación del citoesqueleto axonal y daño de la mitocondria (Figura 3) (43).
Mimetismo Molecular entre Gangliósidos y Glicanos Microbiales
Entre las características patogénicas del SGB se encuentran la presencia de infiltrados inflamatorios compuestos principalmente por macrófagos y células T CD4+. Sin embargo, la característica principal ya mencionada anteriormente es la producción de anticuerpos anti-gangliósidos (22). La presencia de un agente infeccioso que precede el desarrollo de esta neuropatía sugiere una relación causal entre dicho agente y la patología autoinmune.
Como se mencionó anteriormente, el agente infeccioso que más se ha relacionado y el mejor caracterizado en el desarrollo del SGB es el C. jejuni, aunque se conocen otros agentes infecciosos como el Mycoplasma pneumonie, el Haemophilus influenzae, el virus de Epstein Barr y el Citomegalovirus (CMV) (22).
Dada la relación directa que se ha encontrado entre la infección previa por alguno de estos agentes y el desarrollo de este síndrome, se ha propuesto como explicación plausible del desarrollo de esta EAI, la teoría del mimetismo molecular entre los antígenos del agente infeccioso y el nervio periférico (44).
Este mimetismo molecular se observa cuando un hospedero susceptible adquiere una infección con un agente que tiene antígenos que son inmunológicamente similares a los suyos, pero que difieren lo suficiente como para inducir una respuesta inmune cuando son presentados a las células T.
Como resultado, se rompe la tolerancia a los autoantígenos y la respuesta inmune específica que se genera contra el patógeno reacciona de manera cruzada contra estructuras del hospedero para causar daño al tejido y finalmente generar la enfermedad (44).
Específicamente, en casos de infección por C. Jejuni. aparecen anticuerpos contra lipooligosácaridos de la pared bacteriana, sugiriendo que el Campylobacter contiene polisacáridos que se asemejan a los ácidos siálicos que se encuentran en los gangliósidos de los tejidos nerviosos humanos (45). Específicamente, los lipooligosácaridos de Campylobacter son estructuralmente idénticos a algunos residuos del gangliósido GM1 y GD1a presentes en el nervio y la unión neuromuscular.
La infección por Mycoplasma pneumonie puede ser otro candidato para la patogénesis de la polineuropatía crónica en el SGB. Suero de pacientes con esta polineuropatía después de una infección con esta bacteria reacciona a los gangliósidos GM1 y GD1b, sugiriendo que el galactosil puede ser el antígeno diana en estos pacientes (46).
Por otro lado, el CMV es el agente viral más común que precede al SGB, al generar la estimulación de respuestas inmunes hacia glicoconjugados o péptidos virales semejantes a los que se encuentran en la mielina o en las células de Schwann. Se ha descrito anticuerpos contra el gangliósido GM2 en muchos pacientes con SGB después de una infección por CMV (47).
Aunque la reactividad antigangliósidos puede estar dirigida contra un único gangliósido, en algunos casos esta reactividad es poliespecífica debido a la presencia de epítopes idénticos en gangliósidos diferentes, como por ejemplo los gangliósidos GD1b, GQ1b, GT1b, GD2 y GM3 que comparten un epítopo disialosil encontrado en pacientes con SGB (48).
Virus Zika ¿Una Nueva Etiología del Síndrome de Guillain-Barré?
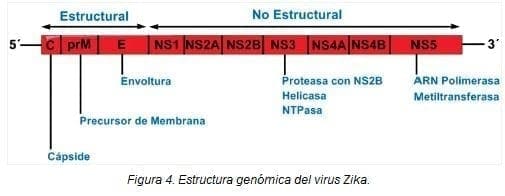
Como se ha mencionado anteriormente, el vZIKA es un flavivirus de aproximadamente 40 nm, compuesto por un ARN monocatenario de sentido positivo de 10794 kb. Tiene un solo marco de lectura abierta en su ARN que codifica para una poliproteína 5´-C-prM-E-NS1-NS2A-NS2B-NS3-NS4A-NS4B-NS5-3´ la cual constituye la arquitectura estructural del virus.
Esta poliproteína se escinde en la cápside (C), precursores de membrana (prM), envoltura (E) y siete proteínas no estructurales (NS) (Figura 4). La proteína E de 53 Kda es la más abundante en la superficie del virus y está relacionada directamente con los procesos de replicación como también la unión y fusión con la membrana de la célula huésped.
De los siete componentes no estructurales que son: NS1 (352 aa), NS2a (217 aa), NS2b (139 aa), NS3 (619 aa), NS4a (127 aa), NS4b (255 aa) y NS5 (904 aa), las proteínas NS1, NS3 y NS5 son las más grandes y altamente conservadas, mientras que NS2a, NS2b, NS4a y NS4b son proteínas pequeñas e hidrofóbicas. La función de estas proteínas no ha sido bien determinada, pero pueden ser importantes en las diferentes etapas de replicación del virus (2)
 Durante el proceso de replicación viral, es posible que el virus incorpore glicolípidos o glico-proteínas expresadas en las células neuronales del huésped convirtiéndose en blanco antigénico. Posteriormente, a través de alelos de susceptibilidad del sistema HLA y otras variantes genéticas, se iniciaría una respuesta inmune cruzada contra glicolípidos o contra glicoproteínas expresadas en dichas células neuronales (49).
Durante el proceso de replicación viral, es posible que el virus incorpore glicolípidos o glico-proteínas expresadas en las células neuronales del huésped convirtiéndose en blanco antigénico. Posteriormente, a través de alelos de susceptibilidad del sistema HLA y otras variantes genéticas, se iniciaría una respuesta inmune cruzada contra glicolípidos o contra glicoproteínas expresadas en dichas células neuronales (49).
En la Polinesia Francesa, una coincidencia temporal entre los picos de incidencia del vZIKA y los nuevos casos del SGB sugieren una relación causal entre estos dos eventos (29)2013, and April, 2014, French Polynesia experienced the largest Zika virus outbreak ever described at that time. During the same period, an increase in Guillain-Barr\u00e9 syndrome was reported, suggesting a possible association between Zika virus and Guillain-Barr\ u00e9 syndrome.
We aimed to assess the role of Zika virus and dengue virus infection in developing Guillain-Barr\u00e9 syndrome. METHODS: In this case-control study, cases were patients with Guillain- Barr\u00e9 syndrome diagnosed at the Centre Hospitalier de Polyn\u00e9sie Fran\u00e7aise (Papeete, Tahiti, French Polynesia. En aquellos pacientes se detectaron anticuerpos antigangliósidos en el 31% (29)2013, and April, 2014, French Polynesia experienced the largest Zika virus outbreak ever described at that time.
During the same period, an increase in Guillain-Barr\u00e9 syndrome was reported, suggesting a possible association between Zika virus and Guillain-Barr\u00e9 syndrome. We aimed to assess the role of Zika virus and dengue virus infection in developing Guillain-Barr\u00e9 syndrome. METHODS: In this case-control study, cases were patients with Guillain-Barr\u00e9 syn-drome diagnosed at the Centre Hospitalier de Polyn\ u00e9sie Fran\u00e7aise (Papeete, Tahiti, French Polynesia.
Este bajo porcentaje de anticuerpos antigangliósido puede ser atribuido a la falta de medición de anticuerpos anti-GT1a, uno de los más abundantes en el SGB asociado a C. jejuni (22). Si así fuese, esto podría sugerir la presencia de una coinfección en la génesis del SGB.
De acuerdo al principio racional de reactividad cruzada después de una infección, es plausible que la infección por vZIKA genere enfermedad autoinmune neurológica. Así lo sugiere el estudio in silico de Lucchese y Kanduc en el que se indica que penta, hexa y heptapéptidos relacionados con la mielina, desmielinización, y neuropatías axonales son compartidos entre las poliproteínas del vZIKA y ciertas proteínas humanas (50).
Cuando estos péptidos son alterados se asociarían con microcefalia, calcificaciones cerebrales y SGB. Estos datos no sólo justifican y estimulan la investigación multidisciplinaria y los esfuerzos por comprender y definir la respuesta autoinmune generada por la infección con vZIKA, sino también podrían ser útiles para la concepción de vacunas basadas en antígenos completos de vZIKA. La determinación de anticuerpos contra estos péptidos podría ser objeto de una futura investigación.
Conclusiones y Perspectivas
Las complicaciones de la epidemia del vZIKA en América Latina tomaron por sorpresa a las agencias de salud, y dejarán importantes lecciones tanto para la academia y centros de investigación como para las agencias estatales responsables de su prevención y eventual control (51,52).
Uno de los principales retos en el estudio de la infección por el vZIKA es su confirmación diagnóstica. La mayoría de los casos reportados han sido diagnosticados por sospecha clínico-epidemiológica y no por laboratorio. El diagnóstico confirmatorio de la infección se realiza mediante la determinación de su ARN por reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR, del inglés “reverse transcription polymerase chain reaction”).
Varios protocolos de RT-PCR han sido descritos (53), que pueden generar resultados diversos y hasta contradictorios, así como reflejar la diversidad genética del virus. Así mismo, existen varias pruebas serológicas comerciales para la detección de anticuerpos contra el virus que deben ser utilizadas con precaución dada la alta reactividad cruzada con otros arbovirus.
En este sentido y con respecto a la asociación entre vZIKA y SGB, no hay que olvidar que en Colombia, y en muchos países Latinoamericanos, existe la circulación simultánea de otros arbovirus que también pueden causar SGB (54) y que deben ser considerados en el diagnóstico diferencial.
A pesar de que en el SGB predomine una respuesta humoral sobre aquella mediada por células T, al menos en la fase progresiva de la lesión del nervio y en las formas axonales, los mecanismos de interacción entre los factores infecciosos y del hospedero que conducen a una respuesta autoinmune no son completamente conocidos (55).
Por lo tanto, en los casos de SGB será importante distinguir entre la neurotoxicidad del vZIKA, demostrada desde su descubrimiento (56), y la generación de respuesta autoinmune por mimetismo molecular (u otro). Por esta razón, es primordial la evaluación de los cofactores asociados al desarrollo del SGB y otros síndromes neurológicos descritos en pacientes infectados con el vZIKA, tales como la encefalitis y la mielitis transversa (54).
Para mejorar el conocimiento y entender los mecanismos fisiopatológicos acerca de la infección por vZIKA los modelos animales permitirán evaluar las hipótesis de fisiopatología, manifestaciones clínicas, así como la evaluación de vacunas y nuevos tratamientos.
En modelos animales se ha demostrado, por ejemplo, que el virus es capaz de pasar la barrera hematoplacentaria y afectar células madre en la corteza cerebral del feto, interviniendo en la regulación de la proliferación celular induciendo muerte celular por apoptosis o autofagia, afectando el neurodesarrollo (57).
Una preocupación importante es el inminente aumento en la patogenicidad viral en relación con el proceso de adaptación del vZIKA en los nuevos entornos geográficos. Tales cambios pueden ocurrir en el vector, en el huésped y en el hospedero.
El control del vector, el tratamiento de individuos afectados y la protección mediante inmunización son estrategias que se han revelado ineficaces de manera independiente, pero que combinadas serían importantes para el control de la epidemia (58). Por esta razón, los estudios y ensayos que se adelantan para evaluar vacunas son una de las principales perspectivas para el control de la infección y complicaciones del vZIKA (59).
Finalmente, el vZIKA vino para quedarse, al menos algunos años. Es posible que una vez la actual epidemia haya terminado, la inmunidad poblacional proteja contra una nueva epidemia por cerca de una década (60).
Sin embargo, dadas las secuelas a largo plazo de este y otros arbovirus, así como la posibilidad de nuevas epidemias trasmitidas por el mismo vector (61), la investigación traslacional y la colaboración nacional e internacional deben ser una prioridad permanente de las entidades académicas y gubernamentales, con el fin de mejorar la calidad de la misma y ofrecer respuestas a problemas nacionales con repercusión regional y mundial (51,52).
Nota agregada durante prueba de galera. El Ministerio de Salud y Protección Social de Colombia declaró el 25 de Julio de 2016 el cierre de la epidemia de Zika, “durante la cual se reportaron 99.721 casos, de los cuales 8.826 fueron confirmados por laboratorio y 90.895 por sospecha clínica” (62).
Agradecimientos
Los autores expresan su gratitud y reconocimiento a todos los miembros del Centro de Estudio de Enfermedades Autoinmunes (CREA), así como a los colegas que participan en el proyecto RAIZ (Respuesta Autoinmune en Individuos infectados por Zika), por sus contribuciones y aportes al desarrollo de este trabajo, el cual ha sido financiado por la Escuela de Medicina y Ciencias de la Salud, de la Universidad del Rosario, Bogotá, Colombia. Los autores declaran no tener ningún conflicto de interés.
Referencias
1. Hennessey M, Fischer M, Staples JE. Zika virus spreads to new areas — Region of the Americas, May 2015–January 2016. MMWR Morb Mortal Wkly Rep 2016;65:55–8.
2. Chang C, Ortiz K, Ansari A, Gershwin M. The Zika outbreak of the 21st century. J Autoimmun 2016;68:1–13.
3. WHO. Zika Americas. Wkly Epidemiol Rec 2015:609– 16.
4. Musso D, Nilles EJ, Cao-Lormeau VM. Rapid spread of emerging Zika virus in the Pacific area. Clin Mi-crobiol Infect 2014;20:O595–6.
5. Zanluca C, de Melo VCA, Mosimann ALP, dos Santos GIV, dos Santos CND, Luz K. First report of autochthonous transmission of Zika virus in Brazil. Mem Inst Oswaldo Cruz 2015;110:569–72.
6. Lednicky J, Beau De Rochars VM, El Badry M, Loeb J, Telisma T, Chavannes S, et al. Zika Virus outbreak in Haiti in 2014: Molecular and clinical data. PLoS Negl Trop Dis 2016;10:e0004687.
7. Instituto Nacional de Salud. Boletín Epidemiológico Semanal, número 27 de 2016 ( 03 julio – 09 julio) http://www.ins.gov.co/boletin epidemiologico/Boletn%20Epidemiolgico/2016%20Bolet%C3%ADn%20 epidemiol%C3%B3gico%20semana%2027.pdf
8. Rasmussen SA, Jamieson DJ, Honein MA, Petersen LR. Zika virus and birth defects – reviewing the evi-dence for causality. N Engl J Med 2016;374:1981-7.
9. Sharp TM, Muñoz-Jordán J, Perez-Padilla J, Bello- Pagán MI, Rivera A, Pastula DM et al. Zika Virus infection associated with severe thrombocytopenia. Clin Infect Dis. 2016 Jul 14. pii: ciw476. [Epub ahead of print].
10. Rodriguez-Morales AJ, Villamil-Gómez WE, Franco- Paredes C. The arboviral burden of disease caused by co-circulation and co-infection of dengue, chikungunya and Zika in the Americas. Travel Med Infect Dis 2016;14:177-9.
11. Faye O, Freire CC, Iamarino A, Faye O, de Oliveira JV, Diallo M, et al. Molecular evolution of Zika virus during its emergence in the 20(th) century. PLoS Negl Trop Dis 2014;8:e2636.
12. Lanciotti RS, Lambert AJ, Holodniy M, Saavedra S, Signor Ldel C. Phylogeny of Zika virus in western hemisphere, 2015. Emerg Infect Dis. 2016;22:933-5.
13. Wang L, Valderramos SG, Wu A, Ouyang S, Li C, Brasil P, et al. From mosquitos to humans: genetic evolution of Zika virus. Cell Host Microbe 2016;19:561-5.
14. Zhu Z, Chan JF, Tee KM, Choi GK, Lau SK, Woo PC, et al. Comparative genomic analysis of pre-epidemic and epidemic Zika virus strains for virological factors potentially associated with the rapidly expanding epidemic. Emerg Microbes Infect 2016;5:e22.
15. Dejnirattisai W, Supasa P, Wongwiwat W, Rouvinski A, Barba-Spaeth G, Duangchinda T, et al. Dengue virus sero-cross-reactivity drives antibody-dependent enhancement of infection with zika virus. Nat Immunol. 2016 Jun 23.
16. Anaya J-M. Common mechanisms of autoimmune diseases (the autoimmune tautology). Autoimmun Rev 2012;11:781-4.
17. Anaya J-M, Ramirez-Santana C, Alzate MA, Molano- Gonzalez N, Rojas-Villarraga A. The autoimmune ecology. Front Immunol 2016;7:139.
18. Wild CP. The exposome: from concept to utility. Int J Epidemiol 2012;41:24-32.
19. Okada H, Kuhn C, Feillet H, Bach JF. The “hygiene hypothesis” for autoimmune and allergic diseases: an update. Clin Exp Immunol 2010;160:1-9.
20. Saeki Y, Ishihara K. Infection–immunity liaison: Pathogen-driven autoimmune-mimicry (PDAIM). Autoimmun Rev 2014;13:1064-9.
21. Christen U, Hintermann E, Holdener M, von Herrath MG. Viral triggers for autoimmunity: is the ‘glass of molecular mimicry’ half full or half empty? J Autoimmun. 2010;34:38-44.
22. Jasti AK, Selmi C, Sarmiento-Monroy JC, Vega DA, Anaya JM, Gershwin ME. Guillain-Barré syn-drome: causes, immunopathogenic mechanisms and treatment. Expert Rev Clin Immunol. 2016 Jun 21:1-15. [Epub ahead of print]
23. Yang B, Lian Y, Liu Y, Wu BY, Duan RS. A retrospective analysis of possible triggers of Guillain-Barre syndrome. J Neuroimmunol 2016;293:17-21
24. Mahecha MP, Ojeda E, Vega DA, Sarmiento-Monroy JC, Anaya JM. Guillain–Barré syndrome in Colombia: where do we stand now? Immunol Res 2016 Jul 15. [Epub ahead of print].
25. Paixão ES, Barreto F, Teixeira Mda G, Costa Mda C, Rodrigues LC. History, Epidemiology, and clinical manifestations of zika: a systematic review. Am J Public Health 2016;106:606-12.
26. Thomas SM, Tjaden NB, van den Bos S, Beierkuhnlein C. Implementing cargo movement into climate based risk assessment of vector-borne diseases. Int J Environ Res Public Health 2014;11:3360-74.
27. Ai JW, Zhang Y, Zhang W. Zika virus outbreak: ‘a perfect storm’. Emerg Microbes Infect 2016;5:e21.
28. Imperato PJ. The convergence of a virus, mosquitoes, and human travel in globalizing the Zika epidemic. J Community Health. 2016 Jun;41(3):674-9.
29. Oehler E, Watrin L, Larre P, Leparc-Goffart I, Lastere S, Valour F, et al. Zika virus infection complicated by Guillain-Barre syndrome–case report, French Polynesia, December 2013. Euro Surveill 2014;19:7–9.
30. Cao-Lormeau V, Blake A, Mons S, Lastère S, Roche C, Vanhomwegen J, et al. Guillain-Barré Syndrome outbreak associated with Zika virus infection in French Polynesia: a case-control study. Lancet 2016;387:1531-9.
31. Cauchemez S, Besnard M, Bompard P, Dub T, Guillemette-artur P, Eyrolle-guignot D, et al. Associa-tion between Zika virus and microcephaly in French Polynesia, 2013-15: a retrospective study. Lancet 2016;387:2125-32.
32. Ye Q, Liu ZY, Han JF, Jiang T, Li XF, Qin CF. Genomic characterization and phylogenetic analysis of Zika virus circulating in the Americas. Infect Genet Evol 2016;43:43-9.
33. WHO. Zika Strategic response framework & joint operations plan January-June 2016. http://www. who.int/emergencies/zika-virus/strategic-response-framework.pdf
34. Padilla J, Rojas D, Sáenz-Gómez R. Dengue en Colombia: epidemiología de la reemergencia a la hiperendemia 2012. https://www.minsalud.gov. co/sites/rid/Lists/BibliotecaDigital/RIDE/INEC/INV/ Dengue%20en%20Colombia.pdf
35. Kolter T. Ganglioside Biochemistry. ISRN Biochem 2012;2012:1-36.
36. Svennerholm E, Svennerholm L. The separation of neutral blood-serum glycolipids by thin-layer chromatography. Biochim Biophys Acta 1963;70:432-41.
37. Vyas AA, Schnaar RL. Brain gangliosides: Functional ligands for myelin stability and the control of nerve regeneration. Biochimie 2001;83:677-82.
38. Schnaar RL, Gerardy-Schahn R, Hildebrandt H. Sialic acids in the brain: gangliosides and polysialic acid in nervous system development, stability, disease, and regeneration. Physiol Rev 2014;94:461-518.
39. Tettamanti G, Bonali F, Marchesini S, Zambotti V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochim Biophys Acta (BBA)/Lipids Lipid Metab 1973;296:160-70.
40. Willison HJ, Yuki N. Peripheral neuropathies and anti-glycolipid antibodies. Brain 2002;125:2591–625.
41. Ilyas AA, Quarles RH, Dalakas MC, Fishman PH, Brady RO. Monoclonal IgM in a patient with paraproteinemic polyneuropathy binds to gangliosides containing disialosyl groups. Ann Neurol 1985;18:655-9.
42. Ilyas a a, Willison HJ, Quarles RH, Jungalwala FB, Cornblath DR, Trapp BD, et al. Serum antibodies to gangliosides in Guillain-Barré syndrome. Ann Neurol 1988;23:440-7.
43. O’Hanlon GM, Plomp JJ, Chakrabarti M, Morrison I, Wagner ER, Goodyear CS, et al. Anti-GQ1b gan-glioside antibodies mediate complement-dependent destruction of the motor nerve terminal. Brain 2001;124:893-906.
Yu RK, Usuki S, Ariga T. Ganglioside molecular mimicry and its pathological roles in Guillain-Ba
rré syndrome and related diseases. Infect Immun 2006;74:6517-27.
45. Brezovska K, Panovska AP, Grozdanova A, Suturkova L, Basta I, Apostolski S. Immunoreactivity of glycoproteins isolated from human peripheral nerve and Campylobacter jejuni (O:19). J Neurosci Rural Pract 2011;2:125-9.
46. Yoshino H, Inuzuka T, Miyatake T. IgG antibody against GM1, GD1b and asialo-GM1 in chronic polyneuropathy following Mycoplasma pneumoniae infection. Eur Neurol 1992;32:28-31.
47. Khalili-Shirazi A, Gregson N, Gray I, Rees J, Winer J, Hughes R. Antiganglioside antibodies in Guillain-Barré syndrome after a recent cytomegalovirus infection. J Neurol Neurosurg Psychiatry 1999;66:376-9.
48. Rojas-García R, Querol L, Gallardo E, Salva NDL, Juarez C, Garces M, et al. Clinical and serological features of acute sensory ataxic neuropathy with antiganglioside antibodies. J Peripher Nerv Syst 2012;17:158-68.
49. Anaya J, Ramirez-Santana C, Salgado-Castaneda I, Chang C, Ansari A, Gershwin M. Zika virus and neurologic autoimmunity: the putative role of gangliosides. BMC Med 2016;14.
50. Lucchese G, Kanduc D. Zika virus and autoimmunity: From microcephaly to Guillain-Barré syndrome, and beyond. Autoimmun Rev 2016;15:801-8.
51. Anaya JM. Lecciones del Zika. El Espectador, Feb 9, 2016. http://www.elespectador.com/noticias/ciencia/ lecciones-del-zika-articulo-615592
52. Heymann DL, Liu J, Lillywhite L. Partnerships, Not Parachutists, for Zika Research. N Engl J Med 2016;374:1504-5.
53. Focosi D, Maggi F, Pistello M. Zika Virus: Implications for Public Health. Clin Infect Dis 2016;63:227-33.
54. Silva LR, Souza AM. Zika virus: what do we know about the viral structure, mechanisms of transmission, and neurological outcomes? Rev Soc Bras Med Trop 2016;49:267-73.
55. Willison HJ, Jacobs BC, van Doorn PA. Guillain- Barré syndrome. Lancet 2016. Feb 29 doi: 10.1016/ S0140-6736(16)00339-1.
56. Dick GW. Zika virus. II. Pathogenicity and physical properties. Trans R Soc Trop Med Hyg 1952;46:521-34.
57. da Silva SR, Gao SJ. Zika virus update II: Recent development of animal models – proofs of association with human pathogenesis. J Med Virol 2016 May 21.
58. Palacios R, Poland GA, Kalil J. Another emerging arbovirus, another emerging vaccine: Targeting Zika virus. Vaccine 2016;34:2291-3.
59. Tripp RA, Ross T. Development of a Zika vaccine. Expert Rev Vaccines. 2016; 0584:14760584.2016.1192474.
60. Ferguson NM, Cucunubá ZM, Dorigatti I, Nedjati-Gilani GL, Donnelly CA, Basáñez MG, et al. Countering Zika in Latin America. Science. 2016 Jul 14.
61. Lwande OW, Obanda V, Bucht G, Mosomtai G, Otieno V, Ahlm C, et al. Global emergence of Alphaviruses that cause arthritis in humans. Infect Ecol Epidemiol 2015;5:29853.
62. Ministerio de Salud y Protección Social. Boletin de Prensa No 155 de 2016. https://www.minsalud.gov. co/Paginas/Colombia-primer-pais-del-continente-que-cierra-epidemia-de-zika.aspx
Recibido: Junio 20, 2016
Aceptado: Junio 23, 2016
Correspondencia:
anayajm@gmail.com

 Relación entre Neuropatías autoinmunes y Anticuerpos Antigangliósidos
Relación entre Neuropatías autoinmunes y Anticuerpos Antigangliósidos