La población escolar objeto de este estudio tuvo una edad promedio de 10,5 años, la cual se encuentra dentro del rango de edad de los diferentes estudios que evalúan el estado nutricional del yodo en escolares.
Como era de esperarse, casi la tercera parte de las personas evaluadas eran de raza mestiza, y más del 90% eran originarios de zona urbana, y más del 40% pertenecían a un estrato socioeconómico bajo (estrato I).
Por lo que, si bien la elección de las instituciones educativas y de los escolares a evaluar tenían la misma probabilidad de ser seleccionados, los resultados presentados deberán ser extrapolados especialmente a escolares de zona urbana y de estrato socioeconómico bajo.
Con relación al IMC, el 21,43% tenía sobrepeso, y el 7,14% tenía obesidad (por lo que, más de la cuarta parte de la población tenía exceso de peso) lo cual está por encima de los valores nacionales e internacionales respecto a la frecuencia de sobrepeso y obesidad en este rango poblacional.
Sin embargo, en la población infantil las correlaciones entre el IMC y el porcentaje de grasa dependen de la edad, género y el estadio puberal, lo cual plantea que la sensibilidad del IMC es insuficiente para diagnosticar con precisión el sobrepeso y la obesidad en los niños y niñas pre púberes.
No obstante, a pesar de estas observaciones, el IMC es actualmente utilizado en la evaluación nutricional de la población infantil, con estudios que demuestran una buena correlación con la masa grasa.
Un poco más del 10% presentaron riesgo de delgadez o delgadez, lo cual es un dato no menor, ya que las medidas antropométricas son indicadores indirectos de la composición corporal y por tanto se extrapolan como medida del desarrollo poblacional. (Lea también: Estado nutricional del yodo, Resultados)
Pero en el caso de la evaluación nutricional en individuos con riesgo de delgadez o delgadez (en el contexto de una probable desnutrición) no informa si dicho desenlace se debe a una ingesta deficiente, a problemas de absorción, a pérdidas anormales o a cualquier otro factor involucrado.
Se ha establecido la asociación entre las condiciones socioeconómicas y el crecimiento y desarrollo infantil y por lo tanto se utiliza con frecuencia como un indicador de desarrollo y equidad.
La frecuencia de desnutrición proteico-calórica en la población infantil y escolar ha sido establecida en Colombia, y se incrementa en casos de población desplazada (33,34); aunque en este estudio, los escolares estudiados llevaban más de 8,5 años en promedio viviendo en su área de residencia; además, más del 90% ingerían al menos dos comidas al día y más del 70% se alimentaban en el comedor escolar.
Es difícil establecer con precisión las causas que originan estas discrepancias en la evaluación nutricional de los niños evaluados, pero podría explicarse (al menos en parte) por la falta de programas nutricionales orientados a identificar subgrupos poblacionales a riesgo, tanto en instituciones educativas oficiales como no oficiales.
Por otra parte, las condiciones económicas y el acceso a diferentes fuentes nutricionales son variables, incluso dentro del mismo estrato socioeconómico, y pueden explicar la variación del IMC en esta población.
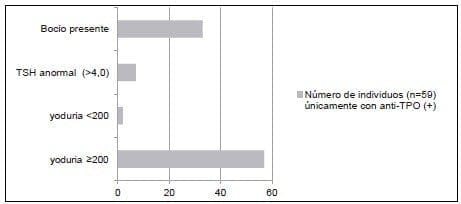 Figura 1. Presencia de bocio.TSH anormal y distribución de la yoduría, en individuos con ati-TPO(+)
Figura 1. Presencia de bocio.TSH anormal y distribución de la yoduría, en individuos con ati-TPO(+)
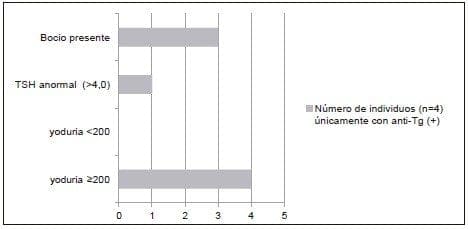 Figura 2. Presencia de bocio.TSH anormal y distribución de la yoduría, en individuos con anti-Tg(+)
Figura 2. Presencia de bocio.TSH anormal y distribución de la yoduría, en individuos con anti-Tg(+)
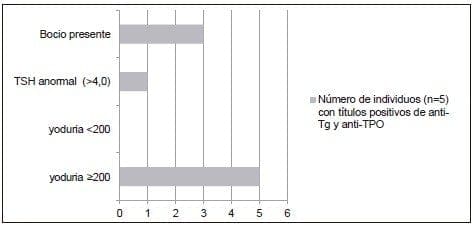 Figura 3. Presencia de bocio.TSH anormal y distribución de la yoduría, en individuos con anti-Tg(+) y anti-TPO (+)
Figura 3. Presencia de bocio.TSH anormal y distribución de la yoduría, en individuos con anti-Tg(+) y anti-TPO (+)
La totalidad de la población estudiada utilizaba sal para consumo humano en los alimentos que ingería, y en el 99% se reconoció como sal yodada; el consumo de sal promedio persona/día en las submuestras descritas, fue de 18,13 g.
Al analizar el EPDDY, se encontró que el consumo de sal promedio persona/día fue de 11,42 g, aunque en algunas regiones como San Andrés y Providencia el consumo fue tan alto como de 17,44 g; en el Cauca, en el mismo estudio se documentó un consumo promedio de 11,7 g.
El resultado actual en esta población supera el valor más alto encontrado su momento en San Andrés y Providencia.
Lo anterior indica un retroceso, y un fracaso absoluto en los programas de vigilancia y prevención del consumo de sal en nuestro medio, es probable que la asequibilidad y accesibilidad a la sal para consumo humano, y de igual forma a alimentos con alto contenido de sal, explique el alto consumo de la misma, además del establecimiento de una cultura arraigada de “sobresalar” los alimentos a ingerir.
Si se tiene en cuenta lo anterior, la mediana de yoduria encontrada (510,3 μg/L) que por lo demás es excesivamente alta, se explica en gran parte por el alto consumo de sal (en donde en el 99% de los encuestados se reconoció como sal yodada).
La tendencia es clara, al demostrarse que más del 80% de los pacientes tenían valores superiores a 300 μg/L (indicando una ingesta excesiva de yodo) y el 87,1% tenían valores por encima de 200 μg/L (indicando una ingesta de yodo más que adecuada).
Si se tiene en cuenta que la ingesta diaria de yodo en la población puede extrapolarse a partir de la yoduria, utilizando el promedio estimado del volumen urinario en 24 h, y asumiendo una biodisponibilidad promedio del yodo del 92%, utilizando la fórmula: Ingesta de Yodo diaria= Yodo urinario (μg/L) X 0,0235 X peso corporal (Kg); se pudiera extrapolar los resultados de este estudio, por lo que: yodo urinario (mediana de 510,3) X 0,0235 X peso corporal (promedio 36,1).
Arrojando que la ingesta diaria de yodo en esta población podría establecerse en 432,91 μg (indicando una ingesta excesiva de yodo). En Colombia, en el año 1947 y gracias a la ley 44, se estableció la yodación de la sal para consumo humano.
Posteriormente, en 1950 se inició un proyecto experimental de yodación de la sal para consumo humano, destinado a los municipios que habían presentado las prevalencias más altas de bocio endémico en un estudio realizado en 1948 (la cual fue >80% en los departamentos de Caldas y Cauca).
En su momento, el Instituto Nacional de Nutrición evaluó dicha intervención en 1952, por medio de un estudio realizado en escolares, encontrando una prevalencia del 33%, representando una reducción superior al 55% (indicando que dicha intervención fue efectiva).
La ley 44 posteriormente fue reglamentada en 1955 y se estableció que el contenido de yodo podía fluctuar entre 50-100 partes por millón (ppm). Dicha ley sigue reglamentando el contenido de yodo en la sal para consumo humano.
De esta forma; por ejemplo, si la sal se yodara a una concentración de 40 ppm (40 mg de yodo por kg de sal) ante una ingesta de sal de 3 g al día, se estarían ingiriendo 120 μg de yodo (lo cual se corresponde con una ingesta adecuada de yodo, con un aporte nutricional óptimo (al menos en población escolar –en el rango de 6-12 años–).
Desde 1955, no se ha modificado la concentración de yodo en la sal para consumo humano en Colombia (a la luz de los conocimientos actuales respecto al estado de yodo en la población; es claro que, además de los esfuerzos dirigidos para reducir el consumo de sal, debe también revisarse a fondo la concentración de yodo en la sal que se consume en Colombia).
El 37,9% de los escolares evaluados presentó algún grado de bocio (por inspección/palpación) lo cual denota un incremento importante en la frecuencia con relación al EPDDY, en donde la prevalencia nacional de bocio en zona urbana, en escolares de 8-12 años fue de 6,5% (en su gran mayoría grado I); para el departamento del Cauca, la respectiva prevalencia fue de 3,4%.
El incremento en la frecuencia reportada en nuestro estudio puede deberse a varios factores (teniendo en cuenta que los resultados que se presentan demuestran que es una población sin evidencia de DDY, por el contrario, es una población con exceso de yodo), y pudieran plantearse por lo tanto las hipótesis que se describen a continuación:
• La alta prevalencia de autoinmunidad tiroidea explica la prevalencia descrita de bocio (evaluada y determinada por medio de la positividad de anti-TPO y/o anti-Tg);
• El exceso de yodo proveniente de la dieta se asocia con la presencia de bocio (en ausencia de hipotiroidismo o hipertiroidismo, como se demuestra en algunas poblaciones Japón, donde se consumen altas cantidades de yodo provenientes de la alta ingesta de pescado);
Debe considerarse siempre la presencia de bociógenos y factores hereditarios que pueden influir en la frecuencia de bocio en la población.
Al ser una población en etapa de crecimiento, y tomando en cuenta que el crecimiento de los folículos tiroideos está coordinado con el del tejido conectivo y con los capilares que le rodean, las células tiroideas liberan localmente factores tróficos sobre el endotelio capilar.
Y dentro de este proceso, el Factor de Crecimiento I Similar a la Insulina (IGF-I) que es un potente factor de crecimiento y que procede de los fibroblastos, estimula la proliferación de las células foliculares; a su vez, la célula tiroidea elabora proteínas de unión del IGF-I, requiriéndose su presencia para que éste último actúe.
Entonces, la intervención coordinada de ambos péptidos potencia así el crecimiento tiroideo, que a la larga en una población como la estudiada, en plena fase de crecimiento, es esperada (al menos en teoría) un incremento en la frecuencia de bocio (35-38).
Es difícil poder establecer la causa definitiva que explique la alta prevalencia de bocio en nuestro estudio, es probable que una interacción entre las hipótesis planteadas explique dicha frecuencia.
Por otro lado, debe tenerse en cuenta que la estimación de bocio se realizó por medio de inspección/ palpación, en donde de antemano se conocía que se estaba evaluando una probable alteración en el estado del yodo en los individuos en estudio.
Además, sólo se realizó por uno de los investigadores (no se realizó la inspección/palpación por otra persona entrenada, por lo que no se pudo realizar un análisis de concordancia en este sentido); adicionalmente, los resultados al evaluar este parámetro no se confirmaron por ultrasonografía; todos estos factores pueden haber sobreestimado la verdadera frecuencia de bocio.
En 63 de los 138 escolares en los que se pudo evaluar por completo la presencia de anti-TPO y anti-Tg hubo positividad para uno o para otro anticuerpo (45,65%); indicando que en la población estudiada, de cada 10 pacientes, entre 4 y 5 presentan autoinmunidad tiroidea.
Dicha frecuencia puede ser esperada a priori en una población con “exceso” de yodo, ya que el exceso de yodo induce la producción de citoquinas y quimiocinas que pueden reclutar células inmunocompetentes a la tiroides.
Además, el procesamiento del exceso de yodo en las células epiteliales tiroideas puede conducir a niveles elevados de estrés oxidativo, llevando al incremento de la oxidación lipídica y daño tisular tiroideo; finalmente, la incorporación de yodo a la cadena proteica de la Tg puede aumentar la antigenicidad de esta molécula (39,40).
Por otro lado, no se encontraron títulos elevados en los anti-TSHR, y el 10% de los escolares presentaron un nivel de TSH >4,0. Por lo que, para esta población, el exceso de yodo y la autoinmunidad tiroidea establecida, se presenta una prevalencia de hipotiroidismo (al definirlo al menos con un nivel de TSH >4,0) del 10% y sin ningún caso demostrado de hipertiroidismo.
En aquellos escolares con yodurias ≥200 la positividad en el nivel de los anti-TPO fue mayor respecto a los que tenían anti-TPO y anti-Tg negativos, indicando una posible asociación entre exceso de yodo y autoinmunidad tiroidea.
Otros estudios han demostrado que la positividad de los anticuerpos tiroideos se asocia con autoinmunidad en la madre y su desarrollo puede surgir en la pubertad, en nuestro estudio no fue posible medir anticuerpos tiroideos en los padres.
Por otra parte, estudios recientes sugieren que la autoinmunidad tiroidea disminuye de forma paralela a la reducción de la ingesta de yodo, lo que nos lleva a asumir que un aumento en el consumo de yodo debe asociarse con el incremento consecuente en la frecuencia de autoinmunidad tiroidea (41-43).
El cociente intelectual medido por medio del test de factor G de Cattell, demostró que más de la tercera parte (36,1%) de los escolares evaluados tenían un valor límite o débil mental; dato relevante, pero no esperado en una población con “exceso” de yodo (ya que es bien conocido que las regiones con DDY e hipotiroidismo son propensas a tener cocientes intelectuales por debajo del promedio, al compararse con regiones “suficientes” de yodo); en nuestro conocimiento, este hallazgo no tiene una relación conocida con el exceso de yodo encontrado en la población estudiada.
Una vez se finalizó el presente estudio, se informó a los rectores y profesores de las entidades educativas tal aspecto, al igual que se sugirió una valoración completa por el servicio de sicología de cada centro estudiantil con el fin de intervenir lo más temprano posible al escolar comprometido y determinar las causas que conllevaron al cociente intelectual descrito.
Las yodurias ≥200 se presentaron de manera estadísticamente significativa en escolares ≤10 años y en la institución educativa “NS” Es probable que la población escolar ≤10 años tenga mayor acceso a fuentes alimenticias con alto contenido de sal que explique el resultado de la yoduria, y es posible que las diferentes instituciones educativas difieran en las cantidades de sal utilizadas para la preparación de los alimentos de los escolares que reciben alimentación en su centro estudiantil.
En resumen, en la población escolar de zona urbana de Popayán, se demuestra un exceso en la excreción urinaria de yodo (determinada por la mediana de yoduria). Este aumento en el valor de la yoduria, se explica por el alto consumo de sal promedio persona/día; la alta frecuencia de autoinmunidad tiroidea (45,65%), la elevación en el valor de TSH (en el 10% de la población estudiada) y la alta frecuencia de bocio (37,9%), puede también ser explicada por el exceso en la ingesta de sal y por otros factores medioambientales y/o hereditarios.
Conclusión
Los programas encaminados a la erradicación de los DDY han originado un cambio positivo res-pecto a las consecuencias desencadenadas por la deficiencia de yodo; no obstante, en aquellos países donde se establecen los programas de yodización, corren con un riesgo establecido de “exceso” poblacional de yodo sino se llevan a cabo estudios de seguimiento y cumplimiento de las normas de regulación.
Colombia no es ajena a lo anterior, de pasar –hace unas décadas- de ser una población “insuficiente” de yodo, y posteriormente a una población declarada como “libre de DDY” en 1998, actualmente estamos en alto riesgo de estar en “exceso” de yodo.
En algunas regiones del Quindío, y ahora en el Cauca, se demuestra que los programas de vigilancia y monitoreo no se llevan a cabo, y que las iniciativas para reducir el consumo de sal al parecer tampoco tienen impacto, al menos en nuestra población. Es probable que dicho “exceso” poblacional de yodo se traduzca en mayor frecuencia de autoinmunidad tiroidea y bocio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en el diseño, realización, análisis, publicación y socialización de resultados del presente estudio.
Agradecimientos
A los rectores, coordinadores y profesores de las cuatro instituciones educativas en donde se realizó el estudio, de igual forma a los padres de familia; y especialmente, a todos los escolares que participaron… su inagotable energía y espontaneidad nos llenó de esperanza y alegría.
Referencias
1. Zimmerman MB, Boelaert K. Iodine deficiency and thyroid disorders. Lancet Diabetes Endocrinol 2015. Published Online January 13, 2015.https://dx.doi.org/10.1016/S2213-8587(14)70225-6.
2. Lazarus JH. The importance of iodine in public health. Environ Geochem Health. 2015.Feb 7. [Epub ahead of print] DOI 10.1007/s10653-015-9681-4.
3. Nyenwe EA, Dagogo-Jack S. Iodine Deficiency Disorders in the Iodine-Replete Environment. Am J Med Sci.2009;337(1):37-40.
4. Zimmermann MB, Andersson M. Assessment of iodine nutrition in populations: past, present, and future. Nutr Rev.2012;70:553-570.
5. Bath SC, Rayman MP. A review of the iodine status of UK pregnant women and its implications for the off-spring. Environ Geochem Health. 2015, Feb 7. [Epub ahead of print] DOI 10.1007/s10653-015-9682-3.
6. Masoodi SR, Ali A, Wani AI, Bashir MI, Bhat JA, Mudassar S, Zargar AH. Goitre and urinary iodine excretion survey in schoolchildren of Kashmir Valley. Clin Endocrinol.2014;80:141-147.
7. Chung HR. Iodine and thyroid function. Ann Pediatr Endocrinol Metab. 2014;19(1):8-12.
8. Zimmermann MB. Iodine deficiency and excess in children: worldwide status in 2013. Endocr Pract.2013;19(5):839-846.
9. Pearce EN, Andersson M, Zimmermann MB. Global iodine nutrition: Where do we stand in 2013? Thy-roid.2013;23(5):523-528.
10. WHO/UNICEF/ICCIDD. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers [updated 1st September 2008]. 3rd edn. Geneva, Switzerland: World Health Organization, 2007.
11. Rohner F, Zimmermann M, Jooste P, Pandav C, Caldwell K, Raghavan R, Raiten DJ. Biomarkers of Nutrition for Development-Iodine Review. J Nutr.2014. pii:jn.113.181974.
12. Doggui R, El Atia J. Iodine deficiency: Physiological, clinical and epidemiological features, and pre-analytical considerations. Ann Endocrinol (Paris). 2015, Jan 19. [Epub ahead of print] pii: S0003-4266(14)01011-7. doi: 10.1016/j.ando.2014.12.002.
13. Vargas-Uricoechea H, Sierra-Torres CH, Holguín- Betancourt CM, Cristancho-Torres L. Iodine-deficiency disorders. Permanent surveillance of vulnerable zones is poor. MEDICINA. (Bogotá).2012;34,No. 2(97):119-144.
14. Taylor PN, Okosieme OE, Dayan CM, Lazarus JH. Therapy of endocrine disease: impact of iodine supplementation in mild-to-moderate iodine deficiency: systematic review and meta-analysis. Eur J Endocrinol. 2014;170:R1-R15.
15. WHO. Guideline: fortification of food-grade salt with iodine for the prevention and control of iodine deficiency disorders. Geneva: World Health Organization; 2014.
16. Aburto N, Abudou M, Candeias V, Wu T. Effect and safety of salt iodization to prevent iodine deficiency disorders: a systematic review with meta-analyses. WHO eLibrary of Evidence for Nutrition Actions (eLENA). Geneva: World Health Organization; 2014.
17. Zhou SJ, Anderson AJ, Gibson RA, Makrides M. Effect of iodine. supplementation in pregnancy on child development and other clinical outcomes: a systematic review of randomized controlled trials. Am J Clin Nutr.2013;98(5):1241-1254.
18. Zimmerman MB. Assessing Iodine Status and Monitoring Progress of Iodized Salt Programs. J Nutr.2004;134:1673-1677.
19. Vigilancia Epidemiológica de los Desórdenes por Deficiencia de Yodo. Colombia, 1.997 Ministerio de Salud/INS/UNICEF/ICBF/INVIMA/OPS/OMS. 1998.
20. Control de los Desórdenes por deficiencia de Yodo en Colombia. Evaluación Externa. Ministerio de Salud/OPS/OMS. 1998:3-8.
21. Ministerio de Salud, Instituto Nacional de Salud, Instituto Colombiano de Bienestar Familiar, Sociedad Colombiana de Endocrinología, UNICEF-OPS/ OMS, Colciencias. Prevalencia de los Desórdenes por Deficiencia de Yodo e Ingestión Promedio de Sal. Colombia, 1994-1998. Santa Fe de Bogotá, D.C., primera edición; noviembre de 2001. ISBN 958-13-0129-1.
22. Gallego ML, Loango N, Londoño AL, Landázuri P. Niveles de excreción urinaria de yodo en escolares del Quindío, 2006–2007. Rev. Salud Pública. 2009;11(6):952-960.
23. Programa de las Naciones Unidas para el Desarrollo (PNUD). Colombia – Universidad del Cauca, Marzo de 2012. ISBN 978-958-8758-13-8.
24. Ministerio de la Protección Social, Instituto Colombiano de Bienestar Familiar, Instituto Nacional de Salud. Instructivo para la Implementación de los Patrones de Crecimiento de la OMS en Colombia para Niños, Niñas y Adolescentes de 0 a 18 Años. Primera edición. 2010, pags:1-151.
25. World Health Organization-WHO. International Council for Control of Iodine Deficiency Disorders. Assessment of iodine deficiency disorders and monitoring their elimination. A guide programmed managers, 2nd edition. Geneva, Switzerland, WHO, Department of Nutrition for Health and Development; 2001. (WHO/ NHD/01.1).
26. Matyjaszek-Matuszek B, Pyzik A, Nowakowski A, Jarosz MJ. Diagnostic methods of TSH in thyroid screening tests. Ann Agric Environ Med. 2013;20(4):731-735.
27. IMMULITE/IMMULITE 1000 anti-TPO Ab (PILKTO-12, 2006-12-29).
28. Schott M, Seibler J, Scherbaum WA. Diagnostic testing for autoimmune thyroid diseases. J Lab Med.2006;34(4):254-257.
29. Zöphel K, von Landenberg P, Roggenbuck D, Wunderlich G, Kotzerke J, Lackner KJ. Are porcine and human TSH receptor antibody measurements comparable? Clin Lab. 2008;54(1-2):1-8.
30. Zimmerman MB, Jooste PL, Pandav CS. Iodine deficiency disorders. Lancet. 2008;372:1251-1262.
31. Cattell RB, Cattell AKS. Test de Factor G-Escala 1. Madrid: TEA; 1989.
32. Cattell RB, Cattell AKS. Test de Factor G-Escalas 2 y 3. Madrid: TEA;1994.
33. ICBF. PROFAMILIA. Encuesta Nacional de Demografía y Salud. Encuesta Nacional de la Situación Nutricional 2005. Componente de Antropometría. Manual de Instrucciones y Equipos. Bogotá, 2004.
34. WHO Multicentre Growth Reference Study Group. WHO Child Growth Standard based on length/ height, weight, and age. Acta Paediatrica 2006; Suppl 450:76-85.
35. Zava T.T., Zava D.T. Assessment of Japanese iodine intake based on seaweed consumption in Japan: A literature-based analysis. Thyroid Res. 2011;4:14. doi: 10.1186/1756-6614-4-14.
36. Same D. Effects of the Environment, Chemicals and Drugs on Thyroid Function. In: De Groot LJ, Beck- Peccoz P, Chrousos G, Dungan K, Grossman A, Hershman JM, Koch C, McLachlan R, New M, Rebar R, Singer F, Vinik A, Weickert MO, editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-2010 Dec 21.
37. Wang L, Shao YY, Ballock RT. Thyroid hormone-mediated growth and differentiation of growth plate chondrocytes involves IGF-1 modulation of beta-catenin signaling. J Bone Miner Res. 2010;25(5):1138-1146.
38. Fiore E, Latrofa F, Vitti P. Iodine, thyroid autoimmunity and cancer. Eur Thyroid J. 2015;4(1):26-35.
39. Luo Y, Kawashima A, Ishido Y, Yoshihara A, Oda K, Hiroi N, Ito T, Ishii N, Suzuki K. Iodine excess as an environmental risk factor for autoimmune thyroid disease. Int J Mol Sci. 2014;15(7):12895-12912.
40. Vargas-Uricoechea H, Bonelo-Perdomo A, Sierra- Torres CH. Iodine Deficiency Disorders. Thyroid Disorders Ther.2015;4:172.
41. Kaloumenou I, Mastorakos G, Alevizaki M, Duntas LH, Mantzou E, Ladopoulos C, Antoniou A, Chiotis D, Papassotiriou I, Chrousos GP, Dacou-Voutetakis C. Thyroid autoimmunity in schoolchildren in an area with long-standing iodine sufficiency: correlation with gender, pubertal stage, and maternal thyroid autoimmunity. Thyroid. 2008;18(7):747-754.
42. Miranda DM, Massom JN, Catarino RM, Santos RT, Toyoda SS, Marone MM, Tomimori EK, Monte O. Impact of nutritional iodine optimization on rates of thyroid hypoechogenicity and autoimmune thyroiditis: a cross-sectional, comparative study. Thyroid. 2015;25(1):118-124.
43. Gopalakrishnan S, Singh SP, Prasad WR, Jain SK, Ambardar VK, Sankar R. Prevalence of goitre and autoimmune thyroiditis in schoolchildren in Delhi, India, after two decades of salt iodisation. J Pediatr Endocrinol Metab. 2006;19(7):889-893.
Recibido: Mayo 15, 2015
Aceptado: Junio 26,2015
Correspondencia:
Hernando Vargas
Hernandovargasu10@yahoo.com