Académico Roberto Franco Sáenz
* Profesor de Medicina, Jefe de la División de Endocrinología y Metabolismo Medical College of Ohio, 3120 Glendale Avenue, Toledo, Ohio,43614, U.S.A. Presentado como trabajo de ingreso en la categoría de Miembro Correspondiente Extranjero en la sesión del 5 de abril de 2001.
Resumen
Se revisan nuevos conceptos acerca de la secreción de aldosterona y de la interacción de la aldosterona con el receptor mineralocorticoide así como el papel de la enzima 11b-hidroxisteroid dehidrogenasa tipo 2 (11b-HSD-2) en la protección del receptor mineralocorticoides contra la acción de los glucocorticoides endógenos. Alteraciónes en la actividad de esta enzima causan hipertensión arterial en humanos y animales de experimentación.
En vista del papel crítico que esta enzima juega en la reabsorción de sodio y el volumen sanguíneo en este estudio se investiga la regulación del gen de la 11b-HSD-2 en el riñón de la rata Dahl, un modelo experimental de hipertensión genética sensible al sodio dietético y se muestra que el sodio dietético aumenta la expresión del gen en el riñón de estas ratas.
Introducción
La aldosterona es una hormona mineralocorticoide producida por las células glomerulosas de la corteza adrenal. La aldosterona actúa en el riñón, en el túbulo convoluto distal causando retención de sodio y eliminación de potasio y iones de hidrógeno.
La aldosterona juega un papel principal en el mantenimiento del volumen sanguíneo y de la presión arterial. En este manuscrito se revisan nuevos conceptos en la regulación de la secreción de aldosterona y el papel de la enzima 11b-hidroxisteroid dehydrogenasa (11b-HSD) en la acción de la aldosterona y en la protección del receptor mineralocorticoide contra los glucocorticoides.
También se reportan estudios de la regulación del gen de la 11b-HSD-2 en el riñón de la rata Dahl, un modelo experimental de hipertensión genética con sensibilidad al sodio dietético. (Lea también: Síntesis de la Valoración del Recién Nacido con Anomalías de los Genitales Externos)
Regulación de la producción de aldosterona
La producción de aldosterona es regulada por varios factores, algunos de los cuales estimulan la producción y otros la inhiben. Los factores más importantes que estimulan la producción de aldosterona incluyen la adrenocorticotrofina pituitaria (ACTH), la concentración de potasio plasmático y el sistema de la renina-angiotensina.
El ACTH es uno de los más potentes estímulos de la aldosterona pero su acción es transitoria y después de 24 horas de estimulación continua, los niveles de aldosterona regresan al nivel basal a pesar de que el estímulo con ACTH continúe.
El ACTH actúa a través de un receptor específico en la membrana de la célula glomerulosa estimulando la enzima adenilatociclasa la cual convierte el ATP en AMP cíclico (cAMP); el cAMP a través de una serie de fosforilación de proteínas facilita el influjo y reciclaje de calcio a través de la membrana de la célula glomerulosa de la corteza adrenal lo cual causa la secreción de aldoster na (1).
El potasio estimula la secreción de aldosterona mediante un efecto directo en la membrana celular, causando la despolarización de la membrana y un aumento en el influjo de calcio. El potasio también produce un ligero aumento en la concentración de cAMP, pero el efecto más importante es el aumento del influjo de calcio (2).
El sistema de la renina-angiotensina es el factor más importante en el control de la secreción de aldosterona. Este sistema juega un papel crítico en el mantenimiento del volumen sanguíneo y de la presión arterial.
La renina es secretada por las células del aparato yuxtaglomerular localizado en la arteriola aferente del glomérulo. Las células yuxtaglomerulares son células mioepiteliales sensibles a la presión. Estas células liberan renina cuando la presión en la arteria aferente disminuye.
La renina es una enzima proteolítica que actua en el angiotensinógeno, de origen hepático, generando angiotensina I. La angiotensina I es un decapéptido sin actividad biológica que sirve como substrato de la enzima convertidora de la angiotensina I (ECA), localizada en el endotelio vascular. La ECA convierte la angiotensina I a angiotensina II, un octapéptido que es uno de los más potentes vasoconstrictores y el más importante estímulo de la secreción de aldosterona.
La angiotensina II actúa a través de un receptor específico en la membrana celular, el receptor de angiotensina tipo I (AT1). La angiotensina II al unirse a su receptor causa influjo de calcio y activa la enzima fosfolipasa C la cual hidroliza el fosfatidilinositol 4,5 bis-fosfato convirtiéndolo en inositol-1,4,5-trifosfato (IP3) y diacilglicerol.
El IP3 estimula la liberación de calcio del retículo endoplasmático causando un aumento transitorio de la concentración de calcio en el citosol. Este aumento en la concentración de calcio estimula procesos dependientes de la calmodulina que activan la bomba de calcio de la membrana celular causando eflujo de calcio.
Estos procesos sonresponsables de la iniciación de la secreción de aldosterona (2). El diacilglicerol se moviliza a la membrana celular y junto con el influjo de calcio activa la enzima C kinasa la cual se mantiene en un estado sensible al calcio y este proceso es responsable de la secreción sostenida de aldosterona (3).
La angiotensina III es un heptapéptido derivado de la angiotensina II por remoción del primer aminoácido de la región aminoterminal (angiotensina -8). La angiotensina III también se une al receptor AT1 y estimula al aldosterona en forma similar a la angiotensina II. Sinembargo la angiotensina III no es vasoconstrictora.
Aparte del sistema circulante de la renina-angiotensina, la célula glomerulosa de la corteza adrenal produce localmente renina, angiotensinógeno y genera dentro de si misma angiotensina II (4,%). Este sistema adrenal de renina-angiotensina parece jugar un papel importante en la modulación de la secreción de aldosterona (6-7).
Además de los factores mencionados existen otras hormonas que juegan un papel menor en la secreción de aldosterona tales como la serotonina (8) y péptidos derivados de la proopiomelanocortina tales como el d-MSH (9) b-lipotropin (10), b-MSH (11) y3- MSH (12).
Los factores que inhiben la aldosterona incluyen la dopamina (13-14) y los péptidos natriuréticos: péptido natriurético auricular (ANP) (15-17) péptido natriurético cerebral (BNP) y el péptido natriurético tipo C (C-type ANP) (18).
Regulación de la acción de la aldosterona a nivel del receptor mineralocorticoide
La aldosterona se une al receptor mineralocorticoide situado en las células principales del túbulo colector cortical (CCD) del nefrón distal aumentando la reabsorción de sodio. Investigaciones recientes han demostrado que el receptor mineralocorticoide tiene la misma afinidad para el cortisol, la corticosterona y la aldosterona, y que la especificidad del receptor para aldosterona, en epitelio de transporte es conferida por la enzima 11b-hidroxysteroid dehidrogenasa (11b- HSD) (19,20). Esta enzima convierte el cortisol a cortisona y la corticosterona a 11-deoxicorticosterona.
La cortisona y la 11-deoxicorticosterona son inactivas y no se unen al receptor mineralocorticoide permitiendo que la aldosterona, que circula en concentraciones mil veces más baja que estos esteroides, se una al receptor y actúe como el esteroide que regula la acción mineralocorticoide.
La enzima 11b-HSD tiene por lo menos dos isoenzimas denominadas 11b-HSD-1 y 11b-HSD-2. La isoenzima de tipo 1(11b-HSD-1) tiene una distribución muy amplia con altos niveles en el hígado y en el túbulo proximal del riñón. Esta enzima funciona como una óxido-reductasa, usa NADP+ como un co-factor y tiene un Km relativamente alto para el cortisol y la corticosterona (2mmol/l).
El papel fisiológico de esta enzima no se conoce hasta el momento y a pesar de que la enzima se encuentra en grandes cantidades en el túbulo proximal del riñón, debido a su alto Km para cortisol y corticosterona hoy en día se considera que esta enzima no participa en la protección del receptor mineralocorticoide contra los glucocorticoides endógenos.
Una disminución de la actividad de la enzima 11b-HSD- 1 se ha reportado en el hígado de la rata hipertensa Bianchi-Milan (21) y en las arterias mesentéricas de la rata hipertensa Dahl- sal sensitiva (22). Recientemente nuestro laboratorio reportó una disminución de la actividad de la 11b-HSD-1 en el riñón de ratas hipertensas Dahl-S rats (23) aunque la expresión del gene de la 11b-HSD-1 fue igual en la Dahl-S y en la Dahl-R (rresistenta) (24), sinembargo, por las razones antes mencionadas, la relación de estos hallazgos con la patofisiología de la hipertensión es estos animales no es clara.
La isoenzima de tipo 2(11b-HSD-2) se encuentra co-localizada con el receptor mineralocorticoide en las células colectoras corticales del nefrón distal, funciona únicamente como reductasa, usa NAD como cofactor y tiene un Km mucho más bajo para la corticosterona (-5nmol/l).
Por esta razón, una deficiencia o inhibición de esta enzima permite la unión de cortisol y corticosterona al receptor mineralocorticoide; estos glucocorticoides que circulan en concentraciones mil veces más alta que la aldosterona, actúan como potentes mineralocorticoides produciendo un aumento en la reabsorción de sodio, expansión del volumen intravascular e hipertensión.
El liquorice y la carbenoxolona son potentes inhibidores de la enzima 11b-HSD y por lo tanto la ingestión de estos productos causa retención de sodio e hipertensión arterial (25, 26).
Material y Métodos
Ratas Dahl-sensibles a la sal (S) y ratas Dahlresistentes a la sal (R) fueron obtenidas de las colonias del Dr. Celso E. Gómez-Sánchez (University of Missouri) y del Dr. John P. Rapp (Medical College of Ohio).
Las ratas fueron mantenidas con una fórmula de Purina (0.28% NaCl) hasta la edad de ocho semanas y después con una dieta alta de sodio (0.9% Solución Salina) para beber o una dieta baja en sodio (0.01% NaCl) por dos semanas antes de ser sacrificadas.
El efecto de la raza, género y dieta fue estudiado en grupos de seis ratas por grupo. El efecto de la edad se estudió en 14 ratas masculinas, 7 ratas S y 7 ratas R y este grupo de ratas fue mantenido con una dieta con un contenido de sodio de 0.2% NaCl. Ocho ratas (4 S y 4 R) fueron sacrificadas a los 33 días de edad y 6 ratas (3 S y 3 R) fueron sacrificadas a la edad de 115 días.
Los protocolos usados para los experimentos fueron aprobados por el Comité Institucional de Cuidado a los Animales.
Separación del RNA
RNA total se aisló de los riñones de las ratas por el procedimiento del tiocianato de guanidina (29). La concentración de RNA purificada fue determinada por absorción ultravioleta a 260 nm.
Síntesis de la prueba
Pruebas para la hibridización de Northern fueron preparadas por la reacción en cadena de la polimerasa (PCR). El cDNA fue amplificado con pruebas específicas para la isoforma de la enzima (11b-HSD- 2). La prueba de cDNA para la enzima 11b-HSD-2 de la rata contiene 173 pares de bases e incluye porciones del exón 3 y 4, extendiéndose desde el nucleótido 765 hasta el 938 (30).
Los productos de la amplificación en cadena fueron purificados y secuenciados con el kit secuenciador (ThermoSequenas radio-labeled terminator cycle kit). Una prueba específica para la enzima gliceroaldehido-3-fosfato dehidrogenasa (CAPD) fue sintetizada y se usó para normalizar los resultados.
Quince microgramos del RNA renal total fueron fraccionados por tamaño y transferidos a membrana de nylon de 0.2m. Los filtros fueron después pre-hibridizados por 2 horas e hibridizados por 10 horas a 42ºC con la solución de hibridización, conteniendo la prueba de la enzima 11b-HSD-2 marcada con 32P. Los filtros fueron lavados y expuestos a película de rayos X y la intensidad de las bandas autoradiográficas cuantificada en un densitómetro (Scan Jet, Hewlett-Packard).
Resultados
La figura 1 muestra los niveles de mRNA de la enzima 11b-HSD-2 en los riñones de las ratas Dahlsensibles a la sal (Dahl-S) y Dahl-resistentes (Dahl- R). No se encontró una diferencia significativa en la expresión del gen en los dos tipos de ratas (Dahl-S 2.1+0.3 unidades relativas vs. Dahl-R 1.7 + 0.1unidades relativas).
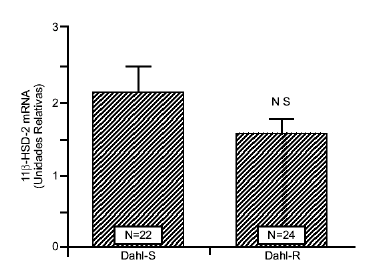
Figura 1 Efecto del tipo de rata en los niveles de RNA mensajero de la enzima 11b-HSD-2 en el riñón de las ratas Dahl. Las columnas representan las medidas densitométricas del RNA mensajero (promedio+/- error standard del promedio) expresadas en unidades relativas. No se encontró diferencia en los niveles de RNA mensajero entre las ratas sensibles a la sal (Dahl-S) y las ratas resistentes (Dahl-R). NS=sin diferencia significativa. N=número de ratas.
La dieta alta en sodio causó un aumento significativo en el mRNA de la 11b-HSD-2 (dieta baja en sodio 1.3 +0.2 unidades relativas vs. dieta alta en sodio 2.4+0.2 unidades relativas) (p<0.0001) (figura 2) y no se encontró una diferencia en los niveles debida al género, la edad o el tipo de rata.
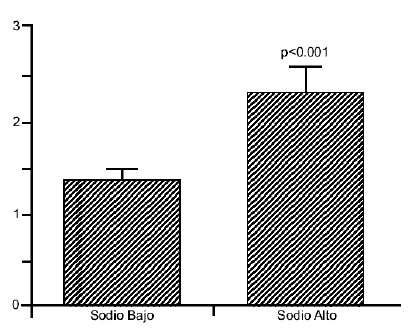
La figura2, muestra el efecto del sodio dietético en los niveles de RNA mensajero de la enzima 11b-HSD-2 en los riñones de ratas Dahl. Dietas altas en sodio causan un aumento de casi el doble en los niveles de RNA mensajero de la enzima 11b-HSD-2 en el riñón de las ratas Dahl (p<0.001). No se encontraron diferencias entre los dos tipos de rata en la expresión del gen. 11b-HSD-2 mRNA (Unidades Relativas) 11b-HSD-2 mRNA (Unidades Relativas) 2.0 1.0 0.0 Machos Hembras N=22 N=24 N S
La figura 3 (panel superior) muestra el efecto del género sexual en la expresión del gen de la enzima 11b-HSD-2 en el riñón. Los niveles de mRNA de la enzima 11b-HSD-2 fueron iguales en las ratas hembras y en los machos y no se encontró una diferencia entre los dos tipos de ratas.
La figura 3 (panel inferior) muestra el efecto de edad en la expresión del gen de la enzima 11b-HSD- 2. Los niveles de mRNA de la enzima 11b-HSD-2 fueron iguales en las ratas jóvenes (33 días de edad) y en las ratas viejas (115 días de edad) y no se encontró diferencia entre los dos tipos de ratas.
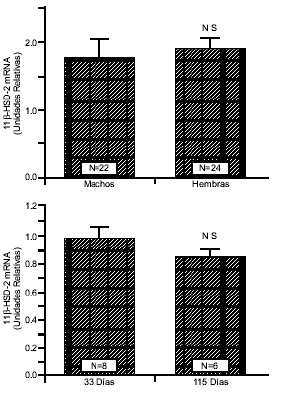 La figura 3, muestra el efecto del género sexual (panel superior) y la edad (panel inferior) en los nivels de RNA mensajero de la enzima 11b-HSD-2 en el riñón de las ratas Dahl. El género sexual y la edad no influencian la expresión del gen de la 11b-HSD-2 en el riñón de la rata Dahl.
La figura 3, muestra el efecto del género sexual (panel superior) y la edad (panel inferior) en los nivels de RNA mensajero de la enzima 11b-HSD-2 en el riñón de las ratas Dahl. El género sexual y la edad no influencian la expresión del gen de la 11b-HSD-2 en el riñón de la rata Dahl.
Discusión
La aldosterona juega un papel crítico en el balance de sodio, el volumen sanguíneo y la regulación de la expresión arterial. La aldosterona al unirse al receptor mineralocorticoide del riñón causa retención de sodio.
Sin embargo, el receptor mineralocorticoide tiene afinidad por cortisol, corticosterona y aldosterona y el cortisol y la corticosterona circulan en concentraciones 1.000 veces más altas que la aldosterona, por esta razón es necesario que el cortisol y la corticosterona se metabolicen para permitir que la aldosterona se una al receptor y ejerza su acción mineralocorticoide.
La enzima 11b-HSD-2 se encuentra localizada en la misma célula con el receptor mineralocorticoide e inactiva el cortisol y la corticosterona, permitiendo que la aldosterona se una al receptor mineralocorticoide. En el hombre el cortisol es el principal glucocorticoide mientras que la rata no produce cortisol y el principal glucocorticoide es la corticosterona.
Una alteración en la actividad de la enzima puede conducir a la unión del cortisol o la corticosterona al receptor mineralocorticoide causando n aumento de la reabsorción de sodio e hipertensión arterial. Mutaciones en la enzima causan el síndrome de hipertensión con exceso aparente de mineralocorticoides. AME (27, 28).
El hecho de que no se encontraron diferencias en los niveles de expresión del gen de la 11b-HSD-2 entre las ratas Dahl-S y las ratas Dahl-R sugiere que el aumento en la reabsorción de sodio y la hipertensión de la rata Dahl-S no es debida a disminución de la expresión del gen de la enzima. Sin embargo, es posible que la actividad de la enzima sea inhibida in-vivo.
Nuestros previos hallazgos de disminución de la actividad enzimática de la enzima 11b-HSD-1 en el riñón de las ratas hipertensas Dahl-S soportan esta idea (23). Factores con actividad similar al ácido glicerrhetínico que inhiben la actividad de la enzima 11b-HSD-1 se han aislado recientemente de la orina humana (31), pero no han sido caracterizados completamente y se desconoce si estos factores inhiben la enzima 11b- HSD-2.
Desafortunadamente debido a la abundancia de la enzima 11b-HSD-1 en el riñón la actividad enzimática de la enzima 11b-HSD-2 no puede ser medida con técnicas corrientes. La expresión del gen de la 11b-HSD-2 es igual en los dos sexos y la edad no influencia su expresión.
Sinembargo dietas altas en sodio causan un aumento significativo en la expresión del gen de la 11b- HSD-2. Una posible explicación del aumento de la 11b-HSD-2 con el sodio dietético es que dietas altas en sodio aumentan el volumen intravascular y suprimen la aldosterona, por lo tanto, en ausencia de aldosterona el receptor mineralocorticoide requiere mayor protección contra la unión de glucocorticoides los cuales causarían un incremento mayor en la absorción de sodio.
En conclusión, la hipertensión y el aumento de la sensibilidad a la sal de la rata Dahl-S no se debe a una disminución de la expresión del gen de la 11b- HSD-2 en el riñón. El género sexual y la edad no afectan la expresión del gen. Sin embargo, el sodio dietético regula el gen de la 11b-HSD-2 y dietas altas en sodio causan un aumento significativo en la expresión del mismo. Además en vista de que las ratas de 115 días de edad sufren de severa hipertensión, se deduce que la hipertensión per se no modifica la expresión del gen.
Bibliografìa
- Kojima I, Kojima K, Rasmussen H. Role of calcium and cAMP in the action of adrenocorticotropin on aldosterone secretion. J B iol Chem 1985;260:4248-4256.
- Kojima I, Kojima K, Rasmussen H. Effects of ANG II and K+ on calcium efflux and aldosterone production in adrenal glomerulosa cells. Am J Physiol 1985;248:E36-E43.
- Kojima I, Kojima K, Rasmussen H. Role of calcium fluxes in the sustained phase of angiotensin II-mediated aldosterone secretion from adrenal glomerulosa cells, J Biol Chem 1985;260:9177-9184.
- Doi Y, Atarashi K, Franco-Sáenz R, Mulrow PJ. Adrenal renin a possible regulator of aldosterone produccion. Clin Exp Hypertens (A) 1983;5:1119-1126.
- Shier DN, Kusano E, Stoner GD, Franco-Sáenz R, Mulrow PJ. Production of renin, angiotensin II and aldosterone by adrenal explant cultures. Response to potassium and converting enzyme inhibition. Endocrinology 1989;125:486-491.
- Yamaguchi T, Naito C, Stoner GD, Franco-Sáenz R, Mulrow PJ. Role of the adrenal renin-angiotensin system on adrenocorticotropic- hormone and potassium-stimulated aldosterone production by rat adrenal glomerulosa cells in monolayer culture. Hypertension 1990;16:635-641.
- Gupta P, Franco-Sáenz, R, Mulrow PJ. Locally generated angiotensin II in the adrenal gland regulates basal, corticotropin an potassium stimulated aldosterone secretion. Hypertension. 1995;25:443-448.
- Haning R, Tait SA, Tait JF. In vitro effects of ACTH, angiotensins, serotonin and potassium on steroid output and conversion of corticosterone to aldosterone by isolated adrenal cells. Endocrinology 1970;87(6): 1147-1167.
- Vinson GP, Whitehouse BJ, Dell A, Etienne T, Morris HR. 1980 Characterization of an adrenal zona glomerulosa-stimulating component of posterior pituitary extracs as alpha-MSH. Nature (London) 284:464-467.
- Matsuoka H, Mulrow PJ, Franco-Sáenz R, Li CH. 1981. Effect of b-Lipotropin and b-Lipotropin derived peptides on aldosterone produccion in the rat adrenal gland. J Clin Invest 68:752-759.
- Matsuoka H, Mulrow PJ, Franco-Sáenz R, Li CH. 1981 Stimulation of aldosterone production by b-melanotropin. Nature (London) 291:155-156.
- Pedersen RC, Brownie AC, Ling N 1980 Pro-adrenocorticotophin- derived peptides coordinate action on adrenal steroidogenesis.Science (Was. D.C.) 208:1044-1045.
- Carey RM, Thorner MO, Ortt EM. Effects of metoclopramide and bromocriptine on the renin-angiotensin-aldosterone system in man. Dopaminergic control of aldosterone. J Clin Invest. 63:727-735.
- Noth RH, McCallum RW, Contine G, Havelick J. 1980 Tonic dopaminergic suppression of plasma aldosterone. J Clin Endocrinol Metab 51:64-69.
- Atarashi K, Mulrow PJ, Franco-Sáenz R, Snadjar R, Rapp JP. Inhibition of aldosterone produccion by an atrial extract. Science 1984;224:992-994.
- Atarashi K, Mulrow PJ, Franco-Sáenz R. Effect of atrial peptides on aldosterone produccion. J Clin Invest 1985;76:1807- 1811.
- Franco-Sáenz, R, Takagi M, Mulrow PJ. Effect of atrial natriuretic on the renin-angiotensin-aldosterone axis. J Hypertens 986; 4(suppl 6):S523-S525.
- Cozza EN, Foecking MF, Vila MC, Gómez-Sánchez CE. Adrenal receptors for natriuretic peptides and inhibition of aldosterone secretion in calf zona glomerulosa cells in culture. Acta Endocrinol (Copenh) 1993; 129(1):59-64.
- Edwards CRW, Steward PM, Burr D, Bret L, McIntyre MA, Sutanto WS, et al. Localisation of 11b-hydroxysteroid dehydrogenase- tissue specific protector of the mineralocorticoid receptor. Lancet 1988;2:986-989.
- Funder JW, Pearce PT, Smith R, Smith AI. Mineralocorticoid action is enzyme, not receptor mediated. Science 1988;242: 583-585.
- Steward PM, Whorwood CB, Valentino R, Burt D, Sheppard MC, Edwards CRW. 11b-hydroxysteroid dehydrogenase activity and gene expression in the hypertensive Bianchi- Milan rat. J Hypertension 1993;11:349-354.
- Takeda Y, Miyamori I, Yoneda T, Iki K, Hatekayama H, Takeda R. Gene expression of 11b-hydroxysteroid dehydrogenase in the mesenteric arteries of genetically hypertensive rats. Hypertension 1994;23:577-580.
- Franco-Sáenz, R, Tokita Y, Latif S, Morris DJ. 11b-hydroxysteroid dehydrogenase in the Dahl rat. Am J Hypertens 1997;10:1004-1009.
- Franco-Sáenz, R, Shen P, Lee SJ, Cicila GT, Henrich WL. Regulations of the genes for 11b-hydroxysteroid dehydrogenase type 1 and type 2 in the kidney of the Dahl rat. J Hypertens 1999;17:1089-1093.
- Steward PM, Valentino R, Wallace AM, Burr D, Shackleton CHL, Edwards CRW. Mineralocorticoid activity of liquorice: 11b-hydroxysteroid dehydrogenase deficiency come to age. Lancet 1987;2:821-824.
- Steward PM, Wallace AM, ATherden SM, Shearing CH, Edwards CRW. Mineralocorticoid activity of carbenoxolone contrasting effects of carbenoxolone and liquorice on 11bhydroxysteroid dehydrogenase activity in man. Clin Sci 1990;78:49-54.
- Whorwood CD, Steward PM. Human hypertension caused by mutations in the 11b-hydroxysteroid dehydrogenase gene: a molecular analysis of aparent mineralocorticoid excess. J Hypertension 1996;15(5):S19-S24.
- White PC, Mune T, Rogerson FM, Kayes KM. 11b-hydroxysteroid dehydrogenase and its role in the syndrome of apparent mineralocorticoid excess. Pediatr Res 1997;41(1): 25-29.
- Chomczynski P, Sachhi N. Single step method of RNA isolation y acid guanidinium thiocyanate-phenol/chloroform extraction. Anal Biochem 1987;162:156-159.
- Zhou MY, Gómez-Sánchez EP, Cox DL, Cosby D, Gómez- ánchez CE. Cloning, expression and tissue distribution of the rat nicotinamide adenine dinucleotide-dependant
11bhydroxysteroid. Endocrinology 1995;136:3729-3734. - Morris DJ. The role of steroid metabolism in protective and pecificity conferring mechanisms of mineralocorticoid action. Vit Horm 1995;50:461-485.
