Académico Jaime Gómez González*
La captura de átomos de boro, gadolinio o la mezcla de estos dos elementos para tratamiento del cáncer es un método experimental que está demostrando gran utilidad en el tratamiento de los tumores cerebrales malignos y de melanomas. Se espera que en un futuro próximo se pueda utilizar en la terapia del cáncer del pulmón, próstata y seno.
La captura de átomos de boro con neutrones es un método bifásico: Requiere la inyección de una substancia con afinidad por el tejido neoplásico como el boro o el gadolinio y la exposición del enfermo a un haz de neutrones epitérmicos.
Al entrar en contacto los neutrones con el boro o gadolinio captado por las células tumorales, se forma una reacción de fisión limitada a un radio de 5 a 10 micras la cual libera una gran cantidad de energía, produce la destrucción de las trenzas de DNA y del tejido tumoral. Las células normales que no captan boro o gadolinio permanecen indemnes. (Lea: Estudio de Recursos Humanos del Sector Salud en Colombia)
Antecedentes
El método conocido por la sigla inglesa BNCT (Boron Neutron Capture Therapy) fue iniciado en Bastan en los años cincuenta por el DI. William Sweet, profesor de neurocirugía de la Universidad de Harvard. Entre 1950 y 1960 se trataron cerca de 50 enfermos con tumores cerebrales malignos.
Los resultados no fueron satisfactorios porque el compuesto borado y los neutrones que se utilizaron fueron de baja energía.
En 1964 Hiroshi Hatanaka, un neurocirujano japonés, trabajó con el DI. Sweet y aprendió el método. A su regreso a Japón en 1967 modificó el sistema con la introducción de un compuesto borado de segunda generación conocido como BSH (borocaptato de sodio). Hatanaka utilizaba la técnica de craneotomía abierta bajo anestesia general y exposición a los neutrones térmicos.
En 1993 Hatanaka presentó en el Congreso Mundial de Neurocirugía reunido en Acapu1co, México, los resultados de veinticinco años de trabajo y mostró por primera vez la posibilidad de curar tumores malignos cerebrales. Después de su muerte, su obra se continúa en la Universidad de Kyoto por el profesor Masao Takagaki.
En 1994 se reiniciaron los trabajos clínicos en el Laboratorio Nacional de Brookhaven utilizando un compuesto de tercera generación, la Boro Fenil Alanina BPA y el uso de neutrones epi térmicos con una energía entre 1 ev y diez kilo electrón voltios.
Con este haz de neutrones se puede hacer el tratamiento sin necesidad de exponer el cerebro con craneotomía abierta. Los ensayos clínicos han demostrado que el procedimiento es seguro. Investigadores de la Universidad de Harvard y MIT empezaron a tratar pacientes con melanoma, siguiendo los métodos propuestos por Mishima en Japón. Los resultados han sido muy satisfactorios.
Thmores Malignos
Inicialmente se ha elegido para BNCT el glioblastoma multiforme y los astrocitomas anaplásicos. Estos dos tumores constituyen aproximadamente la mitad de todos los tumores cerebrales primarios, por lo general no dan metástasis a órganos distantes y tienen una evolución fatal en un tiempo relativamente corto.
De acuerdo con la Asociación Norteamericana de Tumores Cerebrales, la supervivencia de GBM al cabo de un año es del 20%, a los 2 años 10% y a lo cinco años sobreviven menos del 5% de los enfermos.
Los astrocitomas anaplásicos sobreviven 50% en un año, 30% a los dos años y 20% a los cinco años. Estos tumores afortunadamente no son frecuentes.
En los Estados Unidos se estima que ocurren 100.000 tumores cerebrales cada año. Aproximadamente 80.000 son metástasis. De los restantes, cerca del 50% son gliomas malignos.
La frecuencia de melanomas es un poco mayor y el lapso entre el tumor primario y las metástasis sistémicas puede prolongarse varios años. Se hacen investigaciones para tratar de establecer la posibilidad de usar BNCT para tratamiento de otras formas de cáncer más frecuentes.
Los cánceres del pulmón, próstata y seno son mucho más prevalentes. En Estados Unidos se presentan más o menos 150.000 casos de cada uno de estos neoplasmas.
Difusión de BNCT
BNCT ha sido acogido con gran interés porque representa un avance muy importante en el tratamiento de los tumores cerebrales malignos y melanomas. El consorcio europeo ha modificado un reactor nuclear en Holanda; Finlandia, la República Checa, y Corea del Sur adelantan las modificaciones de sus reactores con el mismo propósito.
La Universidad de Virginia, el Instituto Tecnológico de Georgia, el Laboratorio Argon de Idaho, la Universidad de Columbia en Misuri, en los Estados Unidos, tienen planes para iniciar BNCT en corto tiempo. En Latinoamérica, existen proyectos en Argentina, Brasil, Chile y Perú. El desarrollo de reactores nucleares pequeños dedicados a BNCTpermitirá la difusión de BNCT a otras regiones.
Elementos
Además del BSH y de la Boro Fenil Alanina, existe una nueva generación de compuestos útiles para tratamiento con neutrones en los cuales el boro se combina con porfirinas y éstas con gadolinio. En esta forma se aumenta en forma extraordinaria la captación de las células neoplásicas por el compuesto.
Mediante estudios de autorréldiografía, Lasteretal. han mostrado la incorporación del compuesto dentro del DNA del núcleo de las células neoplásicas en una proporción tres veces mayor que la obtenida con BPA o BSH.
Reactor Nuclear
Un reactor nuclear es una unidad construida para la producción de fisión nuclear. El fenómeno se presenta cuando los neutrones de una masa de uranio bombardean las estructuras vecinas. Los reactores tienen un núcleo compuesto de barras de uranio 235.
La fisión se controla con la introducción de barras de substancias que captan los neutrones como el cadmio, el berilio o el grafito. El núcleo debe enfriarse para bajar la temperatura producida por la fisión nuclear.
Los reactores nucleares de investigación tienen baja potencia, sirven para enseñanza, producción de radioisótopos usados en medicina para diagnóstico. En la industria, la radiografía con neutrones sirve para examinar metales y detectar fisuras o fatiga del metal. Reactores de gran potencia se usan para producir energía eléctrica. También como fuente de energía para submarinos y barcos.
La única fuente de neutrones en la actualidad son los reactores nucleares. Se está investigando en forma preliminar la posibilidad de desarrollar otro tipo de generadores de neutrones. El haz de neutrones que sale del reactor es una mezcla de neutrones térmicos, epitérmicos y rápidos.
También hay emisión de rayos gamma. Los reactores usados para BNCT deben tener un flujo de 1 x 10E9 Ni cm2/seg con una contaminación de neutrones rápidos y de rayos gamma menores de 2 x 1üE-12.
Técnica de BNCT
La técnica de BNCT requiere que el diagnóstico histológico sea confirmado por dos patólogos. Una vez establecido el diagnóstico se hace una craneotomía para tratar de extirpar la mayor cantidad posible del neoplasma. Días después, se hace una iconografía por resonancia magnética con contraste de gadolinio para iluminar el tumor residual.
Las imágenes se introducen en un computador, se traza el tumor evitando las estructuras más sensibles a la radiación como los nervios ópticos, el hipotálamo y la hipófisis y se procede a hacer la planeación del tratamiento por medio de un programa de computador bastante complejo llamado Montecarlo.
Se procede a llevar al enfermo a un cuarto de simulación idéntico a la cámara de tratamiento y se coloca en posición de acuerdo con los planes trazados previamente. Se inicia la infusión intravenosa de borolgadolinio y se toman muestras de sangre para microanálisis de los elementos inyectados. Dos horas después comienza la irradiación con neutrones la cual toma aproximadamente 45 minutos.
El enfermo se observa continuamente por medio de circuito cerrado de televisión, electrocardiograma y saturación de oxígeno. En la mitad de la irradiación se suspende el flujo de neutrones para entrar en la cámara y tomar muestras de sangre. Se hace la microdosimetría con espectrometría inmediata de rayos gamma (PGRS) y de acuerdo con el nivel de los elementos se confirma el tiempo de irradiación.
Después del tratamiento, el enfermo se hospitaliza en la unidad de cuidado intensivo para ser observado por 24 a 48 horas. Después sale del hospital a su casa. BNCT no solamente tiene gran eficacia en el tratamiento de los tumores cerebrales malignos sino que también los enfermos disfrutan de una calidad de vida muy satisfactoria. ,
Microanálisis
Los métodos más usuales para microanálisis de boro o gadolinio son la espectrometría inmediata de rayos gamma la cual da resultados en pocos minutos. La espectrometría de absorción atómica (ICPAES) requiere la preparación de la muestra y demora un poco más tiempo.
Estos procedimientos se hacen en sangre y en muestras de tumor tomadas durante intervenciones quirúrgicas. Otras técnicas de autorradiografía permiten localizar el sitio de acumulación del elemento en el tumor.
Resultados
Hatanaka informó una supervivencia promedio para GBM de 20 meses. En un grupo de enfermos con tumores superficiales, es decir a menos de 5 cm de la superficie, la supervivencia fue de 58% a los cinco años y de 29% a los diez años. Varios casos sobrevivieron más de 20 años.
En niños con tumores cerebrales, Nakagawa y Hatanaka mostraron aumento de sobrevida y ausencia de retardo mental en contraposición con la radioterapia convencional que no es selectiva destruye las neuronas.
Los resultados informados por Takagaki y colaboradores (1996) en cuatro años de seguimiento muestran una supervivencia para glioblastoma multiforme de 31% utilizando BSH y neutrones térmicos. Los últimos 8 casos han tenido una supervivencia del 50%. Los astrocitomas anaplásicos tienen una supervivencia de 52% al cabo de ese lapso.
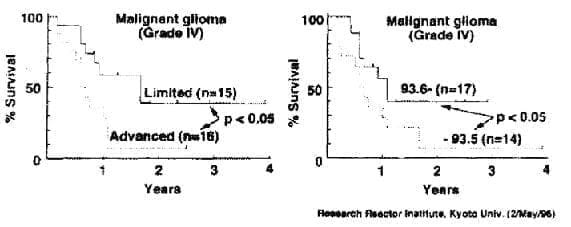
Resultados del tratamiento de gliohlastoma multiforme (grado 4) y astrocitoma anaplásico
(grado IJI) en el Instituto de Investigaciones del Reactor de la Universidad de Kyoto, Japón,
2 de mayo de 1996. Cortesía del profesor Masao Takagaki.
Los resultados preliminares obtenidos en el Laboratorio Nacional de Brookhaven con dosis bajas de BPA y dosis bajas de neutrones epitérmicos demostraron que el procedimiento es seguro y comparable en estas dosis con el tratamiento convencional. Los resultados del cuarto protocolo serán conocidos a fines de 1997.
En relación con melanoma, Mishima ha mostrado supervivencia prolongada y desaparición del tumor en enfermos con melanoma de la cara. Los trabajos de MIT muestran buenos resultados en un número reducido de enfermos con melanoma de las extremidades.
Resumen
Se hace un breve resumen del método de tratamiento de algunas formas de cáncer conocido como Captura de Atamos de Boro con Neutrones. Es un método bifásico que requiere la inyección de elementos con afinidad por la célula tumoral y la exposición a un haz de neutrones epitérmicos.
Los resultados en una serie de enfermos con gliomas cerebrales malignos y melanoma indican que el procedimiento es seguro y de mayor eficiencia que los métodos convencionales. La supervivencia de los enfermos y su calidad de vida son definitivamente mejores con BNCT. Se espera que en un futuro se puedan tratar otras formas de cáncer con esta modalidad terapéutica.
Bibliografía
1. Ashbury Ak, Ojeman RG, Nielsen SL, et al.: Neuropathological study of fourteen cases of malignant brain tumor treated by Boronl0 slow neutron capture radiation. J. Neuropath Exp Neurol, 31: 278-303, 1972.
2. Bailey P, Cushing H: A classification of the tumors of the glioma group on a Histogenetic Basic with a correlaled study of prognosis. Philadelphia: JB. Lippincott, 1926.
3. Barth RF, Soloway AH, Fairchild RG, el al.: Boron Neutron capture therapy for cancel. Cancer 70: 2995-3007,1992.
4. Boring CC, Squires TS, Tong T: Cancer statistics 1991. Cancer J. Clin 41: 19-36, 1991.
5. Boron Neutron Capture Therapy. Hearing before the committee on Energy and natural resources, United States Senate. US Gov Printing Off, Washington OC, 1994.
6. Coderre J, Rubin P, Freedman A, el al.: Selective ablation of rats brain tumors by BNCT. Int J Rad Oncol 28:1067-1077, 1994.
7. Darling JL: Tissue culture of stereotactic biopsy material. in Thomas DGT CEd.): Stereotactic and Image directed surgery of brain tumor.Edinburgh, Churchill Livingston 1993, p.36.
8. Devaux BC, O’Fallon JR, Kelly PJ: Resection, biopsy and survival in malignant glial neoplasms. J Neurosurg
78: 767-775, 1993.
9. Farr LE, Sweet WH, Robertson JS, elal.: Neutron capture with Boron in the treatment of glioblastoma multiforme. AJR 71: 279-293, 1954.
10. Fine HA, Dear KBG, Loeftler JS, el al.: Meta-analysis of Radiation 29 Therapy with and without adjuvant
chemotherapy for malignant gliomas in adults. Cancer 71: 2585-2597, 1993.
11. Gavin PR, Kraft SL, De Haan CE, et al.: Large animal normal tissue tolerance with BNCT. Int J Rad Oncal 28: 1099- 1106,1994.
12. Gómez-González J: Iconografía por Resonancia Magnética del sistema nervioso. McGraw Hill-Interamericana, Madrid, 1990.
13. Greenherg HS, Chandler WF, Ensminger WD, et al.: Radiosensitization with carotid intraarterial BU dR plus 5FU for malignant gliomas. Neurology 44: 1717-1720,1994.
14. Haritz D, Gahel D, Huiskamp R: Clinical Phase 1 study of Na2 B12 SH ( BSH) in patients with malignant glioma as precondition for BNCT. Int J Rad Oncol 28: 1175-1181, 1994.
15. Hatanaka H: Boron-neutron capture therapy for tumor in Glioma, principles and practice in Neurooncology (Karim ABMF, Laws Jr. ER Eds.) Springer Verlag, Berlin, 1991: 233-249.
16. Hatanaka H: Analysis of clinical results of long surviving hrain tumor patients who underwent Boron-neutron capture therapy with mercaptoundeca hydrodecarborate (Abstracl) X international Congress of Neurosurgery. Acapuleo, México, 1993, P 199.
17. Kernoham JW, Sayre GP: Tumors of the central nervous system. Atlas of tumor pathology Section 10, Fascicle 35. Washington, De. Armed Forces Institute of Pathology 1952.
18. Kreth FW, Warnke PC, Scheremet R, el al.: Surgical resection and Radiation Therapy vs. biopsy and Radiation Therapy in the treatment of Glioblastoma Multiforme. J Neurosurg 78: 762- 766,1993.
19. Mallesch JL, Moore DE, ABen BJ, et al.: the pharmacokinetics of P-Boron Phenyl Alanine-fructose in human patients with glioma and metastasic melanoma. Int J Rad Oncol 28:1183- 1188, 1994.
20. Nakagawa Y, Hatanaka H, Matsumoto K: Boron neutron capture therapy for children with malignant brain
tumors. Past experience and future prospect. (Abslracl) X international Congress of Neurosurgery. Acapuleo, México, 1993, p. 196.
21. Randall T: A lean, mean cyclotron rey up neutron therapy. JAMA 267: 614- 616, 1992 (News).
22. Salford LG, Brun A, Nirfalk S: Tenyear survival among patients with supratentorial astrocytomas grade III and IV. J Neurosurg 69: 506-509, 1988.
23. Slatkin DN: A history of Boron neutron capture therapy of hrain tumors. Brain 114: 1609-1629, 1991.
24. Suárez A: Glioblastoma multiforme. Neurol Col 6: 25-29, 1982.
25. Sweet W.H: Practical problems in the past in the use of boron-slow neutrón capture therapy in the treatment of glioblastoma multiforme. In: Fairchild, R.G; Brownell G, Eds. Proceedings of the First International Symposium on Neutron Capture Therapy. Upton: Brookhaven National Laboratory; 1983: 376-378.
26. Takagaki M, Oda Y, Kikuchi H, Masunaga S: ls BSH effective or not on BNCT for malignant brain tumors? In: Kitaoka Y, Ed. Workshop on Boran Chemistry and Boron Neutron Capture Therapy. Kyoto, Kyoto University; 1993: 14-28.
27. Taylor HJ, Goldhaber M: Detection of nuclear disintegration in a photographic emulsiono Nalure, London 135: 341; 1935.
• Miemhro de Número de la Academia Nacional de Medicina de Colomhia
