Felipe Guhr,1. Fernando Serpa2
Adriana González 1Jairo Rodríguez”
Nhora de Sánchez’3y Leslie Hudson4 .
Introducción
El protozoario parásito Trypanosoma cruzi, agente causal de la enfermedad de Chagas, infecta alrededor de 10 millones de individuos en Latinoamérica pudiendo ocasionarse en algunos de ellos, patologías cardíacas o digestivas.
En Colombia, el T.cruzi se detecta frecuentemente en el Valle del Río Magdalena en la región del Catatumbo, la Sierra Nevada de Santa Marta y los Llanos Orientales.
Se estima que alrededor de17% de la población colombiana está infectada y cerca del 23% se encuentra bajo riesgo de adquirir la infección dependiendo de la distribución de los vectores (l).
Se han reportado 17 especies de triatomineos en el país y en siete de ellas se ha demostrado la presencia del parásito. Rhodnius prolixus es el insecto vector de mayor distribución en las áreas endémicas debido a sus hábitos antropofílicos y domiciliarios (2).
El esquema tradicional de la cadena epidemiológica de 1′. cruzi muestra que la transmisión estuvo primitivamente restringida a ciclos específicos en el ambiente selvático donde triatomineos silvestres acometían mamíferos pequeños y medianos en vastas extensiones del Continente Americano, sin que el hombre interviniera en este ciclo natural.
Esta situación persiste hasta hoy en regiones vírgenes de América configurándose el carácter epidemiológico de una enzootia silvestre (figura 1).
La presencia de T. cruzi parece no afectar significativamente a los triatomineos ni a los mamíferos silvestres naturales infectados, lo que sugiere un equilibrio entre las especies, fruto de largos períodos de adaptación. Es común encontrar mamíferos portadores de T. cruzi en el país; por ejemplo, se ha descrito más de un centenar de reservorios pertenecientes a especies diferentes (1).
La existencia de la enfermedad de Chagas humana es un hecho puramente accidental. En la medida en que el hombre fue entrando en contacto con los focos naturales y provocó desequilibrios ecológicos, forzó a los triatomíneos infectados a ocupar las viviendas humanas, llevándose a cabo el proceso de domiciliación ya que no solamente encuentran refugio sino también suficiente alimento de sangre humana y de animales mamíferos (3).
De esta manera entra el hombre a formar parte activa en la cadena epidemiológica de la enfermedad de Chagas (figura 1).
Hoy en día diseminada por todos los países Latinoamericanos, esta enfermedad representa sin duda un importantísimo y grave problema de salud pública, no solamente por los elevados índices de prevalencia como por los daños que causa a la población en términos de morbilidad y mortalidad.
Teniendo en cuenta que la domiciliación de los vectores se lleva a cabo principalmente en los procesos de colonización en {¡reas selváticas, la enfermedad de Chagas se sitúa entre las entidades vinculadas al subdesarrollo sociocultural y sus causas se correlacionan estrechamente a las paupérrimas condiciones de vivienda, al subempleo, a la falta de tierra y de bienes de producción.
Así pues, en la enfermedad de Chagas se presentan ciclos silvestres sin la participación del hombre y ciclos domiciliarios con su participación los cuales son integrados e interdependientes.
Otro tipo de transmisión que ha sido involucrado a los ciclos anteriores se debe al proceso de urbanización por la inmigración de enfermos a las grandes ciudades y la transmisión del parásito por vía transfusional.
Incluso en ciudades donde no hay transmisión vectorial como es el caso de Santa Fe de Bogotá, se ha demostrado incidencias cercanas a13% en donantes de diferentes bancos de sangre de la ciudad (4). Un estudio recientemente finalizado en nuestro laboratorio (Guhl et al datos no publicados) demostraron una prevalencia del 2.6% sobre un total de 1564 donantes del banco de sangre del hospital de la Samaritana en la ciudad de Santa Fe de Bogotá. Otros estudios han reportado prevalencias hasta del 7.5% en bancos de sangre de áreas endémicas (5).
El presente estudio presenta algunos datos que demuestran cómo la participación del hombre en la cadena epidemiológica se inicia cuando éste invade o modifica el ambiente silvestre como en el caso de los colonos mientras que en los reductos indígenas motilones a pesar de haberse encontrado triatomineos y pequeños mamíferos infectados por T. cruzi en los alrededores de las viviendas, los pobladores no estaban infectados debido al equilibrio racional que guardan con su medio ambiente. (Lea también: Editorial, Breve Historia de la Academia Nacional de Medicina)
Materiales y Métodos
En colaboración con la División Médica de Ecopetrol, se realizaron varios viajes a la región del alto Catatumbo en donde gracias a la invaluable colaboración del señor Bruce O1sson pudimos visitar los últimos reductos de los indígenas motilones sobre el Río Suroeste: Sapahadana, Pathuina e Iquiacarora (véase mapa 1).

También se tomaron muestras de los pobladores de áreas de colonización en las partes bajas y medias de la Serranía de los Motilones.
Las muestras de sangre se tomaron por punción dactilar, recogiéndola en tubos capilares no heparinizados, para luego procesarlas mediante las pruebas de inmunofluorescencia indirecta (IFI) y la prueba de ensayo inmunoenzimático (ELISA).
Parásitos: se utilizaron formas trypomastigotas de Trypanosoma cruzi como antígeno para ambas pruebas obtenidas a partir de cultivos cíclicos en células. Ver (6).
1. Académico Asociado. Laboratorio de Microbiología y Parasitología. Universidad de los Andes, Apartado Aéreo 4976, Santa Fe de Bogotá, Colombia.
2. Académico de Número. * (q.e.p.d.).
3. Laboratorio de Microbiología y Parasitología, Universidad de los Andes, A.A. 4976, Santa Fe de Bogotá, Colombia.
4. Saint Georges Hospital Medical School. Dept. lmmunology, Univcrsity ol’ London, London.
Estas técnicas se desarrollaron de acuerdo a los procedimientos estándar de laboratorio ya descritos en otra oportunidad (7). Los parámetros obtenidos para los puntos de quiebre se obtuvieron con base en los valores de sueros de referencia positivos o negativos.
Resultados
Se recolectaron un total de 146 muestras, de las cuales 63 correspondieron a indígenas motilones y las restantes a pobladores colonos.
Las graficas 1 y 2 muestran la distribución de los títulos obtenidos mediante la prueba de IFI en la población de colonos e indígenas respectivamente, así como el índice de prevalencia expresado en porcentaje.
Discusión
Los procesos de colonización en el alto Catatumbo al igual que en muchas otras regiones del país viene acompañado de un elevado índice de destrucción del medio ambiente. El hombre empieza a atacar los ecotopos naturales, talando bosques y cazando los pequeños mamíferos silvestres para su subsistencia. Un hecho muy frecuente en nuestro medio es el uso de hojas de palma para la construcción de techo de las viviendas.
En el ciclo silvestre los triatomineos habitan en las hojas de las palmas. Al ser cortadas por el hombre y utilizadas en su vivienda, los insectos se ven obligados a invadir los predios humanos donde encuentran alimento en la sangre de los animales domésticos y del hombre, llevándose a cabo el proceso de domiciliación de vectores que se presentan en figura 1.
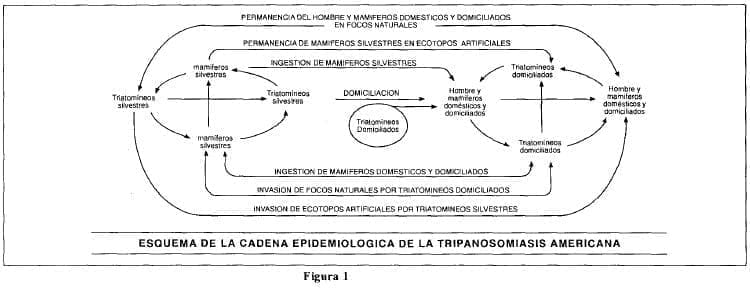
Aquellos triatomíneos infectados naturalmente con T. cruz¡ son entonces introducidos por el mismo hombre en su ambiente y a partir de ese instante entra a formar parte integral de la cadena epidemiológica.
Es interesante observar como de los 63 indígenas estudiados 15 de ellos (20.63%) correspondieron a individuos que trabajaron o en ese momento estaban trabajando como empleados para colonos en la misma área.
Su empleo consistía en el caso de los hombres, en tumbar la vegetación para la futura siembra de yuca y plátano en el terreno desvastado, en otros casos producción de carbón de palo y en la mayoría de los casos de las mujeres labores domésticas, principalmente de cocina. Sin excepción todos los indígenas infectados habían salido de su reserva para llevar a cabo este tipo de actividad.
Es muy interesante observar el hecho de que los 48 individuos restantes (79.37%) nunca habían salido de su reserva y no habían estado en contacto con colonos. A pesar del hallazgo de triatomineos infectados en las proximidades de los bohíos, estos indígenas no presentaron positividad serológica, seguramente por el hecho de que prácticamente no causan desequilibrio en el medio natural en que viven.
Este mismo hecho ha sido reportado en algunas tribus indígenas del Brasil central (3).
De manera igual se pueden sustentar los resultados encontrados al analizar la inexistencia de la enfermedad humana en los Estados Unidos de Norteamérica donde en algunas regiones del sur (Estados de Texas y baja California) a pesar de que se encuentran varias especies de triatomíneos y un número considerable de reservorios naturalmente infectados con T. cruzi las mejores condiciones de vida y el proceso de colonización diferente, impiden que se lleve a cabo este proceso de domiciliación.
En el grupo de los colonos se presenta una positividad cercana al 50% muy indicativa del proceso de colonización antes descrito.
Existen en el país muchos sitios donde se ha demostrado el ciclo selvático de T. cruzi donde todavía no ha ingresado el hombre (8). Se hace indispensable incrementar este tipo de estudios a nivel nacional, con el ánimo de prevenir que los futuros procesos de colonización en estas áreas aumenten aún más la dispersión de la enfermedad de Chagas.
Bibliografía
1 MARINKELLE., CJ. Epidemiology of Chagas’ disease in Colombia. Alllerican Trypanosollliasis Researc”. PAliO Scientific Publication No.318, pp.340-346. 1975.
2 D’ALESSANDRO, A.• Barrcto. P. y THOMAS, M. Nuevos registros de triatomineos domiciliarios y extradomieiliarios en Colombia. CololIIbia Médica. 12(2): 75·85. 1971.
3 PINTO Dias, J.e Doen<;a de Chagas. Epidemiología. Diálogo Médico. 4: 5-16. 1985.
4 GUIIL. F.• CANOSA, A., RUIZ, G. y DE SÁNCHEZ. N. Estudio serológico sobre la incidencia de donantes chagásicos en 4 bancos de sangre de la ciudad de Bogotá. Revista Latinoalllericana de Microbiología. 21: 255-257. 1979.
5 GUHL, F., JARAMILLO, e, MOGOLLON, II.H., RODRIGUEZ, J., de SANCHEZ. N. y MARINKELLE, CJ. Rastreo seroepidcmiológico de donantes de sangre chagásicos en una zona endémica (Norte de Santander), Colombia. Revista Latinoalllericana de Mierobiología. 29: 63-66. 1987.
6 HUDSON, L, SNARY, D. and MORGAN, S.J. Trypanosoma cruzi: continuous culture with murine cell lines. Parasitology 88,283- 294. 1989.]
7 GUHL, F., I-IUDSON, L., MARINKELLE, CJ., MORGAN, S.J. and JARAMILLO, e Antibody response to experimental Trypanosoma rangeli infection and its implications for immunodiagnosis 01′ South American Trypanosomiasis. Acta Tropica 42: 311-318. 1985.
8 SARA VIA, N.G., I-IOLGUIN, A.F., CIBULSKIS, R.E. and D’ALESSANDRO, A. Divergent isoenzyme promes 01′ sylvatic and domiciliary Trypanosoma cruzi in the Easterna Plains, Picdmont and Highlands 01′ Colombia. Alllerican JOllmal o/Tropical Medicine and Jiygiene 36(1): 59-69. 1987.
1. Académico Asociado. Laboratorio de Microbiología y Parasitología. Universidad de los Andes, Apartado Aéreo 4976, Santa Fe de Bogotá, Colombia.
2. Académico de Número. * (q.e.p.d.).
3. Laboratorio de Microbiología y Parasitología, Universidad de los Andes, A.A. 4976, Santa Fe de Bogotá, Colombia.
4. Saint Georges Hospital Medical School. Dept. lmmunology, Univcrsity ol’ London, London.