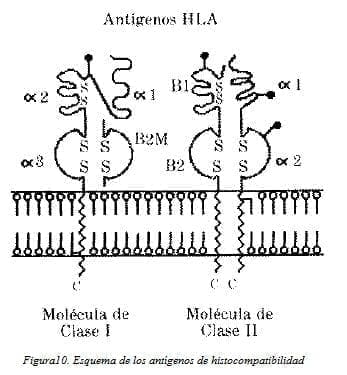
Los antígenos del complejo mayor de histocompatibilidad son de dos clases: I y 11.Se trata de glicoproteínas formadas por dos cadenas cada una.
Los antígenos de clase I están compuestos por una cadena pesada de 45,000 daltons que contiene carbohidratos y una pequeña (B2 microglobulina) de 12,000 daltons. La cadena pesada posee una porción intracelular, una transmembranosa y 3 regionesextracelulares llamadas al, a2y a3.
La región a3 es la más cercana a la membrana celular y es constante (no es variable) entre individuos. En la región a3 es donde existe gran variabilidad produciendo las diferencias entre individuos, fenómeno conocido como polimorfismo genético.
Existen tres clases de cadenas pesadas codificadas por genes localizados en el brazo corto del cromosoma 6 humano: HLA-A, HLA-C y HLA-B. Estos antígenos se hallan en todas las células del cuerpo incluyendo las plaquetas (excepto el trofoblasto y otras células indiferenciadas).
Por otro lado, los antígenos de clase 11están compuestos por dos cadenas pesadas que contienen carbohidratos, una llamada a de 34,000 daltons y una B de 29,000 daltons (Fig. 10). Ambas cadenas poseen una porción intracelular, una transmembranosa y dos regiones extracelulares al, a2 y B1, B2.
De estas regiones, la B2 es la más variable y en ella se encuentran las diferencias que constituyen el polimorfismo de los antígenos de clase 11 también llamados HLA-D.
Dentro de la región cromosómica del CMH existen 6 genes que codifican proteínas no reconocidas por las células T. Entre ellas existen 4 proteínas de la cascada del complemento C2, BF, C4B mientras que los otros 2 genes (2l0H o gen de la hidroxilasa2l) controlan la síntesis de una enzima de la glándula adrenal. Aunque estos genes no producen moléculas reconocidas por los receptores de las células T se llaman moléculas de clase III. (Vea también: El Desequilibrio de Enlace Genético en el Complejo Mayor de Histocompatibilidad (CMH))
Polimorfismo de los Genes y Antígenos del Cmh, (Clase I Y 11), y de los Genes de la Clase III
Algunas proteínas del individuo poseen porciones variables que pueden ser estudiadas genéticamente puesto que se expresan codominantemente en algunas células o en el plasma. Estos son ejemplos de polimorfismo genético.
Si los cambios se analizan en proteínas (substituciones de aminoácidos) pueden ser estudiados por medio de diversos métodos que incluyen:
a) métodos serológicos o inmunológicos
b) por variabilidad en la carga eléctrica por electroenfo que o por migración en electroforesis o
c) por células T específicas o clonos. Si los cambios se estudian al nivel del ADN (substituciones de bases) se usa la técnica de diferencias de longitud de fragmentos de ADN usando endonucleasas de restricción conocida como la técnica de Southern.
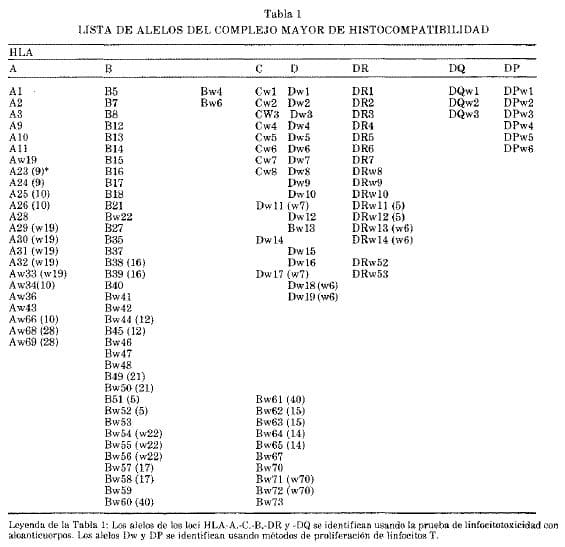
Cualquiera que sea el método usado, las variantes se llaman alelos (Tabla 1). En la mayoría de los individuos cada locus de los dos cromosomas posee 2 diferentes alelos debido al alto grado de polimorfismo del grupo de genes HLA o del complemento.
Por lo tanto los individuos estudiados son más frecuentemente heterozigóticos, aunque si un alelo se encuentra con mayor incidencia en la población, ocurre con relativa frecuencia el estado homozigótico. El locus que posee mayor polimorfismo es el HLA-B con más de 60 alelos.
En la tabla 1 se observan los alelos conocidos en cada locus. La frecuencia de cada alelo HLA-A2 es el más frecuente en todas las razas, mientras que los alelos HLA-Al y HLA-B8 son característicamente caucásicos.
Es importante recordar que el estudio más extenso del polimorfismo de los genes HLA se hizo usando anticuerpos que reaccionan con las partes variables de los antígenos de clase I y clase II. Los de la clase I en linfocitos de sangre periférica y los de la clase 11usando solamente linfocitos B.
Los alelos de las 4 proteínas del complemento se estudian en el plasma. No se sabe por qué existe un polimorfismo tan grande en los loci del CMH. Se cree que se debe a que las proteínas del CMH son importantes en la selección natural debido al papel que juegan en la respuesta inmune. Mayor información puede ser obtenida en otras publicaciones (:3).
Asociación no Aleatoria de Alelos del CMH y del Complemento: Desequilibrio de Enlace Genético
De acuerdo con la genética mendeliana, los genes se recombinan durante la división miótica. Esto equivale a decir que, durante la miosis, los cromosomas homólogos de cada gameto se alinean de tal modo que al separarse resultan diferentes combinaciones de alelas, como producto del entrecruzamiento del material genético.
De ese modo, las variantes paterna y materna de un gen pueden entrecruzarse y la progenie hereda diferentes combinaciones de alelas. El hecho de que ciertos alelas de unos genes se encuentren siempre asociados con otros alelas específicos de genes vecinos a ellos se aparta de las leyes de la genética mendeliana, según la cual cada alelo debería encontrarse en la población asociado a otros alelas en razón inversamente proporcional a la distancia que los separa.
Este es el caso de los genes del CMH y del complemento localizados en el hombre en el brazo corto del cromosoma 6.
Por razones desconocidas, estos genes, que ocupan una región no mayor de 4 unidades de recombinación (aprox. 4,000 kb de ADN) se presentan en la población en grupos de alelas asociados de una manera no aleatoria.
Tal distribución de combinaciones específicas de alelas puede deberse a que la frecuencia de recombinaciones esté disminuida, o simplemente ser el resultado de mezclas recientes de poblaciones, en las que aún no se han presentado los suficientes eventos mióticos como para que se puedan observar recombinaciones.
En cualquier caso, toda distribución anormal de un conjunto de alelas que se encuentre, con frecuencia constituye un desequilibrio de enlace. Esta clase de desequilibrio genético se ha descrito antes en el sistema Rh de los eritrocitos y en los alelas de las inmunoglobulinas.
Pero en la región del CMH es en donde se ha podido documentar un desequilibrio de enlace que se extiende por una distancia cromosómica relativamente grande. El estudio del desequilibrio de enlace se facilitó porque los alelas del C2, BF, C4A y C4B se heredan en grupo tan constante que no ha sido posible observar ni siquiera una sola recombinación.
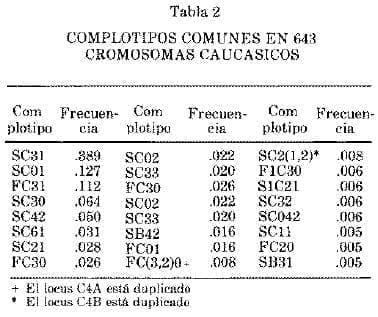
Las combinaciones de los cuatro alelas se encuentran muy fijas en la población de tal modo que el conjunto de los 4 alelas se puede estudiar como si fueran el producto de un solo locus. Nosotros hemos llamado a esta constelación de genes variables, complotipos.
Por ejemplo, el complotipo C2C, BFS, C4B1 (en breve SC31) se diferencia de otro complotipo, FC31 solamente en el factor B (BF) porque en uno la variante es lenta en la electroforesis (S) y en el otro, es rápida (F).
Si se estudia un individuo, uno describe el fenotipo: C2C, BFS, BFF, C4A3, C4B1, pero solamente después de estudiar a los padres se puede saber que el genotipo del individuo es SC31/FC31. En la tabla 2 se pueden ver varios complotipos con frecuencia variables. Obsérvese que existen alelas nulos que son denominados QO (cantidad O). Por ejemplo, SC01 es producido por C2C, BFS, C4QO y C4Bl. Los alelas nulos pueden ser debidos a deleciones genéticas o a falta de expresión de los genes (4, S, 6).

Los alelas de la cadena pesada de los antígenos de clase I también muestran desequilibrio de enlace. Por ejemplo si una persona caucásica es HLA-A1, muy probablemente es HLA-B8 y estos loci se hallan a una distancia de 1 unidad de recombinación.
Además el alelo HLA-B8 se halla en desequilibrio de enlace con el alelo HLA-DR3 y DQW2. Como era de esperarse también los complotipos se encuentran en desequilibrio de enlace con los alelas de la clase I y de la clase 11porque están localizados entre los dos loci (Fig. 11).
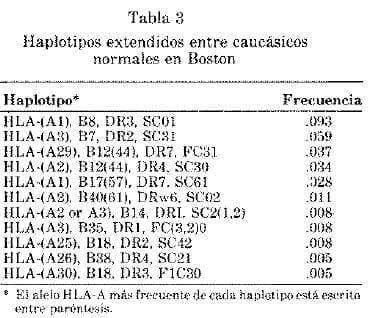
La tabla 3 es la lista de los grupos de alelas asociados en desequilibrio de enlace. Nosotros llamamos haplotipos extendidos a estos grupos de alelas del mismo cromosoma que se encuentran en desequilibrio de enlace en la población.
Cuando se conocen los dos haplotipos se conoce el genotipo. Por lo tanto el único modo de conocer el genotipo del individuo es estudiando la familia. El orden de los genes estudiados determina diferentes asociaciones en 2 haplotipos de cada individuo estudiado.
Pero cuando esa asociación se halla con cierta frecuencia el grupo de genes asociados a ciertas distancias cromosómicas es de tal magnitud que dos individuos no relacionados por familia pueden ser considerados como si en el pasado hubiesen tenido un ancestro común en el caso de los haplotipos extendidos.
Sin embargo, si se encuentran dos individuos cuyos haplotipos son idénticos pero la composición de ellos es aleatoria se puede asumir que existen porciones del ADN intercalado entre los marcadores estudiados que los diferencian.
Este concepto está representado en la figura 11, en la que los marcadores de las tres clases de genes son conocidos. De acuerdo con este concepto, los alelas en desequilibrio de enlace de loci vecinos pueden predecir que la parte intercalada del cromosoma es idéntica aún en individuos no relacionados por vínculo familiar.
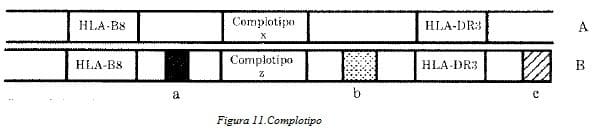
Ejemplo de desequilibrio de enlace y su representación esquemática. Las regiones identificadas con rectángulos pertenecen a regiones reconocidas por marcadores HLA-BS, complotipo x y HLA-DR3 del cromosoma A de un individuo.
Ellos existen en asociación no aleatoria. Si dos de los tres marcadores son iguales como en el cromosoma B la presencia de un complotipo diferente (z) puede predecir que otras regiones del cromosoma B (a,b,c) pertenecen a polimorfismos diferentes no identificados en el presente.
CMH y Enfermedad
Existen asociaciones de enfermedades con el CMH (HLA), por ejemplo: espondilitis anquilosante, diabetes insulina-dependiente, miastenia grave, hiperplasia adrenal congénita y muchas más. Muchas enfermedades son autoinmunes como la artritis reumatoide, mientras que otras como la hemocromatosis no tiene ningún componente inmunológico en su patogenia.
La asociación mejor documentada de un alelo del CMH con una enfermedad es la del HLA-B27 en la espondilitis anquilosan te. Al parecer, esta asociación implica la interacción entre el antígeno B27 y antígenos de bacterias como la Klebsiella (7, 8). Estos resultados favorecen la hipótesis según la cual la reactividad cruzada de un antígeno HLA con uno bacteriano induce una respuesta inmune.
El mecanismo principal postulado para explicar las asociaciones del CMH con diversas enfermedades autoinmunes es la existencia de defectos en la habilidad del animal o del hombre para responder frente a antígenos patógenos.
Por ejemplo, en la miastenia grave la asociación con el HLA-DR3 se debe a la capacidad de producir anticuerpos contra el receptor de la acetilcolina. En el ratón, la mutación de tres nucleótidos en un gen de la clase II revierte tal mecanismo de la enfermedad (4).
El Haplotipo Extendido y Su Relación con la Asociación del CMH con Enfermedades (4, 9-11)
Una de las grandes dificultades de este tipo de asociaciones es la falta de asociación absoluta entre una enfermedad con un alotipo determinado de genes de clase II. Por ejemplo, 30%de los enfermos con artritis reumatoide no expresan HLA-DR4. Por lo tanto, se dice que los Mecanismos para explicar las asociaciones pueden ser varios.
Es posible, por ejemplo, que los productos de los genes de clase II del CMH no sean los genes de susceptibilidad sino que se encuentren vecinos a ellos. Esta posibilidad estimuló el uso de la técnica de Southern con hibridación del ADN.
El empleo de este método ha permitido obtener mejores asociaciones, pese a no ser estas absolutas. Otra posibilidad es que la enfermedad estudiada tenga múltiples etiologías entre las cuales una se deba a los alelas del CMH.
Las técnicas moleculares permiten subclasificar los alelas conocidos hasta ahora. Específicamente, algunos haplotipos extendidos se usaron en el descubrimiento de asociaciones del CMH con enfermedades causadas por de lesiones de genes únicos o con enfermedades autoinmunes.
Por ejemplo, la deficiencia del factor C2 del complemento (en asociación con A25, B18, SCQ042) y la hiperplasia adrenal congénita por deficiencia de 21-hidroxilasa (asociación con B47, DR7, FC910 son producidas por genes recesivos que se encuentran raramente en la población.
En el caso de la diabetes mellitus insulinodependiente, dos haplotipos extendidos del DR4 y dos del DR3 se encuentran con frecuencia. Sin embargo, existen individuos con HLA-DR3 o DR4 que no son parte de haplotipos extendidos y que no tienen mayor riesgo de sufrir diabetes.
Por otro lado, el haplotipo HLA-B44 DR7 SC31 está disminuido en los diabéticos. Estos hallazgos son consistentes con la interpretación según la cual la susceptibilidad está asociada con un haplotipo extendido y que los alelas que producen un haplotipo dado están aumentados en los pacientes.
Si el haplotipo extendido no conlleva susceptibilidad genética, los alelas de este haplotipo estarán disminuidos en la población de pacientes y aparecerán como protectores; los individuos con dicho haplotipo tendrán, por lo tanto, un riesgo menor para sufrir esa enfermedad.
Un aspecto diferente en la relación CMH -enfermedad es aquel relacionado con el papel que juega el producto del CMH en la regulación de la magnitud y el tipo de respuesta inmune. Por ejemplo, la severidad de la coriomeningitis linfocitaria en el ratón -una infección de tipo viral- se relaciona con la producción de la respuesta inmune frente al virus (13).
Los ratones que responden son susceptibles a la infección, y la respuesta se encuentra restringida por los productos del CMH de la clase I. De manera similar, es posible que la ausencia de una respuesta primaria de tipo inflamatorio frente a un agente dado, pueda beneficiar al huésped.
En este aspecto la observación de que ciertos individuos no desarrollan una reacción aguda frente a la vacuna de la hepatitis B se relaciona con un incremento en la frecuencia de dos haplotipos extendidos (14).
El Desequilibrio de Enlace o los Haplotipos Extendidos en la Aloreactividad
Nuestra hipótesis supone que los alelas de otros genes desconocidos, incluidos en la misma región cromosómica también sean idénticos entre individuos que presentan el mismo haplotipo extendido.
La mejor evidencia en favor de este concepto es el haber encontrado que los linfocitos mezclados “in vitro” no producen proliferación en el 85% de los individuos con idénticos haplotipos extendidos (12).
Las moléculas del CMH de clase II son capaces de inducir la proliferación de las células T auxiliares. Esta proliferación se puede estudiar en el cultivo mixto de linfocitos (CML).
En general, todas las mezclas de linfocitos producen proliferación a excepción de aquellas que corresponden a hermanos que heredan los mismos alelos del CMH. Esta respuesta frente a los antígenos de la clase 11se denomina a lo reactiva, y se estudia en el laboratorio clínico para buscar donantes de compatibles injertos, especialmente de médula ósea.
Los receptores de los linfocitos auxiliares T (A) pueden ser activados por las moléculas de clase 11(alodeterminantes) sin requerir otros antígenos. Los alelos HLADR codificados por los genes DRB son los más importantes en la estimulación de los linfocitos, hecho importante en el caso del transplante de médula ósea porque en el donante existen menos clases de células incluyendo linfocitos T inmunocompetentes.
Tales linfocitos estimulados son capaces de reaccionar en contra del huésped produciendo una enfermedad llamada de injerto contra huésped. Esto se puede evitar con el uso de donantes que sean idénticos a nivel del CMH: hermanos idénticos genéticamente o personas no relacionadas en las que el CMH sea idéntico (lo que se puede obtener cuando los haplotipos extendidos son idénticos) (12).
Resumen: Esta revisión intenta introducir al médico en el campo de la biología molecular, la inmunología y la inmunogenética.
El lector puede obtener más información en libros didácticos o especializados. Sin embargo, debe tener en cuenta que los antígenos de histocompatibilidad, cuya aplicación clínica más importante es la clasificación de tejidos para aloinjertos, han servido para realizar estudios biológicos básicos principalmente, han servido para comprender mejor las interacciones celulares que ocurren cuando el animal es expuesto a una sustancia extraña (antígeno).
Existen varias clases de moléculas del complejo mayor de histocompatibilidad, de estructuras variables las cuales constituyen sistemas genéticos polimórficos que sirven para identificar susceptibilidad a enfermedades, principalmente autoinmunes.
Un aspecto importante de la investigación en nuestro laboratorio es el estudio del desequilibrio de enlace de genes. Esto es, el análisis de una asociación, que no ocurre al azar, de alelos del complejo mayor, de histocompatibilidad.
Este fenómeno sirve para estudiar genes desconocidos que se hallan entre los loci vecinos. En esas regiones podrían estar los genes de susceptibilidad a ciertas enfermedades, las cuales pueden también resultar de un cambio estructural en los productos de clase II del CMH.
Agradecimientos:
Expresamos nuestros agradecimientos a Ada Watson por su ayuda con el material gráfico, al Dr. Wo]fgang Munar de la Universidad del Norte por sus sugerencias al texto, y a nuestra secretaria Judy Boyer. El trabajo de los autores se realiza bajo el auspicio del Instituto Nacional de Salud de los Estados Unido.
Bibliografía
(1) Roitt, l., Brostoff, J. y Male. D.: lmnunology. The C.V. Mosby Company. Sto Louis. Toronto. Gower Medical Publishing-London, New York, 1985
(2) Emery, Alan, E.H.: Elements of medical genetics. Sexta edición. Churchill Livingstone. Edingburgh. London. Mdbourne and New York. 1983.
(3) Yunis, E.J. y Dupont, B.: The HLA System. In: Hematology of infancy and hildhood. Nathan and Oski (eds.) Saunders, 1987.
(4) Alper. C.A., Awdeh, Z.L. y Yunis, E.J.: Com.plotypes, extended haplotypes, mal e segregation distortion y disease markers. Human Immunology. 15:366-373, 1986.
(5) Alper, C.A., Awdeh, Z.L., Raum. D.D., Fleischnick, E. y Yunis, E.J.: Complement genes ofthe human major histowrnpatibilüy complex: implications for linkage desequ1:- libriU1n and disease associations. In: Immunogenetics, G.S. Panayi y C.S. David (eds.) Butterworths, London, pp. 50-91, 1984.
(6) Yunis, E.J., Awdeh, Z., Raum, D., Yang, S.Y. y Alper, C.A.: The MHC (Major Histocompatibility Complex) and disease. In: Henry, J.B. Clinical Diagnosis and Management by Laboratory Methods. 17th Edition. Philadelphia, London: W.B. Saunders, pp. 806-821, 1984.
(7) Geczy, A.F., et al.: Characterization ofafactor(s) present in klebsiella culture filtrates that specifically modijies an HLA-B27 associated cell-surface component. J. Exp. Med. 152: 331-340, 1980.
(8) Upfe1d, L.L, et al.: HLA-B27: Speculation on the nature of ú,sinuoluementIn ankylo.~¡:ng spondyWis. Prog. Allergy 36: 117-189, 1985.
(9) Alper, C.A.. Fleischnick, E., Awdeh, Z., Raum, D., Crigler, J.F. Jr., Park, C.S., y Yunis, E.,J.: Extended MHC haplotypes in salt-losing 21-hydroxylase def¡:dency. Annals of The New York Academy of Sciences. 28-35, 1985.
(10) Raum, D., Awdeh, Z., Yunis, E.J., Alper, C.A., y Gabbay, K.H.: Extended major histocompati/rilüy complex haplotypcs in type 1diabetes mellituK J Clin Invest. 74′ 449-454, 1984.
(11) Alper, C.A., Fleischnick, E. Awdeh, Z.L., Katz, A.J. y Yunis, E.J.: Extended major histocompatl:bility complex haplotypes in patientswith gluten-sensitive enteropathy. J. Clin. Invest. 79: 251-256, 1987.
(12) Awdeh, Z.L., Eynon, E.E., Stein, R., Alper, C.A., Alosco, S.M., y Yunis, E.J.: Unrelated individuals matched for MHC extended haplotypes and HLA -identical siblings show comparable responses in mixed lymphocyte culture. Lancet 853-855, 1985.
(13) Zinkernagel, R.M. y Doherty, P.C.: MHC-restricted cytotoxic T celis: Studies on the biological role of the polymorphic major transplantation antigen.~ determining T-cell restriction specificity, function and respon~iveness. Adv. Immunol. 27: 51, 1979.
(14) Craven, D.E., et al.: NonresponsiIJeness to hepatitis B vacc1:nein health eare workerK Ann. Int. Med. 105:356-360, 1986.
