Bogotá. Genetistas de la Universidad Javeriana realizaron la primera caracterización a nivel molecular de pacientes colombianos homocistinúricos. El estudio –publicado de manera independiente- también hizo parte de uno de mayor envergadura en la que participaron investigadores de Barcelona y de varios países suramericanos. La homocistinuria clásica –un trastorno autonómico recesivo (en el que el niño debe heredar el gen de ambos padres para resultar con un trastorno clínico serio) – se debe a una deficiencia de la beta-sintasa de la cistationina (CBS); se han descrito más de ciento treinta mutaciones en este gen de la CBS, que difieren en cuanto a severidad y prevalencia. La muy prevalente mutación conocida como p.I278T se ha encontrado en todos los países europeos donde se ha buscado –con la excepción de los de la península ibérica- y estos casos de la Europa Continental responden bien al tratamiento con la vitamina B6. Sin embargo hay otra mutación –la p.T191M- prevalente en España y Portugal, que no responde a la piridoxina. El grupo ibero-americano de investigadores en genética analizó treinta pedigrís de pacientes ibéricos, colombianos y argentinos, en búsqueda de homocistinuria, encontrándose la última mutación en todos los cuatro países, pero fue especialmente prevalente en Colombia. El número de alelos p.T191M que se describieron en dicho estudio –al igual que los publicados anteriormente- fue de setenta y uno. La prevalencia de los alelos p.T191M –entre los de CBS- fue como sigue: 0.75 en Colombia, 0.52 en España, 0.33 en Portugal, 0.25 en Venezuela, 0.20 en Argentina y 0.14 en Brazil. Los análisis de los haplotipos sugirieron un doble origen de la mutación. En ella no hubo una correlación entre el genotipo y el fenotipo, y la única diferencia fue la falta de respuesta a la vitamina B6. Se encontraron también tres mutaciones adicionales, la p.M173V, la p.I429del y la c.69_70+8del10. La p.M173V se asoció con un fenotipo que respondía levemente a la vitamina B6.
El grupo colombiano analizado incluyó a treinta y seis individuos de diez familias no relacionadas, de los cuales once tenían homocistinuria clínica. La valoración del genotipo y del fenotipo mostró un alto grado de variabilidad, incluyendo una severidad diferente en un par de hermanos afectados por el trastorno. Los niveles de homocisteína no cambiaron con la administración de piridoxina o de ácido fólico. El estudio ofreció también la oportunidad única de estudiar dieciocho parientes heterocigotos (p.T191M/wt) de pacientes homocistinúricos. Un hallazgo atípico fue que muchos de ellos presentaron niveles de homocisteína por encima del promedio, lo que los colocaba en alto riesgo de enfermedad vascular. En tres de los casos había criptorquidia y en uno un síndrome de Klinefelter. Adicionalmente se identificó en uno de los enfermos la presencia de una mutación nueva, la p.A288T.
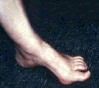
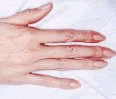
Las manifestaciones típicas son:
• Antecedentes familiares
• Miopía
• Cristalino dislocado
• Rubicundez
• Contextura alta, delgada
• Extremidades largas
• pie cavo
• genu valgum
• Pectus excavatum
• Tórax en quilla
• Retardo mental
• Enfermedad psiquiátrica
Exámenes:
• Se observa osteoporosis radiológica
• Estos niños también pueden tener cataratas, glaucoma y desprendimiento de la retina.
• Niveles elevados de metionina y homocisteína en sangre y orina
• ausencia de cistationina beta sintasa (por biopsia de hígado y análisis enzimático)
• Ausencia de cistationina beta sintasa, por biopsia de piel con cultivo de fibroblasto
• Puede haber una mutación en el gen de la cistationina beta sintasa.
Tratamiento un poco menos de la mitad responde al tratamiento con altas dosis de piridoxina. Aquellos que no responden requieren una dieta baja en metionina y -la mayoría- también trimetilglicina o betaína, aunque con esto no se mejora el retardo mental. Ayuda agregar ácido fólico y ocasionalmente de cisteína. Si el diagnóstico se hace muy tempranamente –por ejemplo, al nacer- la dieta estricta y las vitaminas mencionadas pueden evitar el retardo mental y muchas complicaciones. Infortunadamente, si existe el aumento persistente en los niveles de homocisteína, hay un riesgo alto de trombosis arterial o venosa, con disminución de la expectativa de vida. La dislocación del cristalino del ojo puede dañar severamente la visión por lo que se debe realizar una cirugía de reemplazo. El diagnóstico intrauterino está disponible y se hace mediante el cultivo de células amnióticas o vellosidades coriónicas para verificar la presencia o ausencia de la cistationina beta-sintasa.
Homocisteína elevada, factor de riesgo
Factores más comunes que producen hiper-homocisteinemia
* edad avanzada
* menopausia
* insuficiencia renal crónica
* hipotiroidismo
* lupus eritematoso sistémico
* bajos niveles en plasma de vitaminas-cofactores
* transplante cardíaco
* ciertos medicamentos.
* Homocistinuria
Las vitaminas-cofactores (B6, B12, y ácido fólico) participan como coenzimas o substratos en el metabolismo de la metionina y la homocisteína, por esto existe una fuerte relación entre sus niveles plasmáticos y los de homocisteína. La vitamina B6 actúa como cofactor para la cistationina sintetasa. La hiper-homocisteinemia produce disfunción endotelial, una de las primeras etapas en la patogénesis de la aterosclerosis. Recientes estudios confirman que un aumento de su concentración en plasma está relacionado en forma lineal con un aumento del riesgo de enfermedad cardíaca. Un estudio Holandés concluyó que la homocisteína, aunque no tan potente predictor de enfermedad cardiovascular como el colesterol, es por poco el segundo. Al incrementarse en un 10% los niveles de homocisteína en sangre, se incrementa casi en la misma forma el riesgo de padecer enfermedad cardiovascular severa. De allí que se ha vuelto popular consumir 400 mg de ácido fólico para prevención –una vitamina más- de la aterosclerosis.
Referencias
Urreizti R, Asteggiano C, Bermudez M, Cordoba A, Szlago M, Grosso C, de Kremer RD, Vilarinho L, D’Almeida V, Martinez-Pardo M, Pena-Quintana L, Dalmau J, Bernal J, Briceno I, Couce ML, Rodes M, Vilaseca MA, Balcells S, Grinberg D. The p.T191M mutation of the CBS gene is highly prevalent among homocystinuric patients from Spain, Portugal and South America. Journal of Human Genetics. 2006 Feb 15.
Bermudez M, Frank N, Bernal J, Urreizti R, Briceno I, Merinero B, Perez-Cerda C, Ugarte M, Grinberg D, Balcells S, Kraus JP. High prevalence of CBS p.T191M mutation in homocystinuric patients from Colombia. Human Mutatations 2006; 27(3):296.
Godnic MA, Poloni S. Homocisteína. https://www.nutrinfo.com.ar/pagina/info/homoc0.html
Malinow MR, Bostom AG, Kraus RM. Homocysteine, Diet, and Cardiovascular Diseases, A Statement for Healthcare Professionals From the Nutrition Committee, American Heart Association, 1999. www.americanheart.org