Fisiología de la Adenohipófisis
La parte anterior y más voluminosa de la pituitaria se llama adenohipófisis y está constituida por células epiteliales que segregan siete hormonas de naturaleza proteica. La mayoría de las cuales son hormonas trópicas, pues se encargan de estimular la función de una serie de órganos endocrinos periféricos.
Hay seis tipos de células secretoras. Todas –con excepción de una- especializadas en la producción de una sola hormona. Se trata del somatotropo (somatotropina), lactotropo (prolactina), tirotropo (TSH). Gonadotropo (que segrega tanto FSH como LH), corticotropo (ACTH) y melanotropo (alfa-MSH).
Hay tres clases de hormonas en la adenohipófisis:
- Las somato-mamotróficas. (Hormona del crecimiento, prolactina). Cadenas largas de un solo péptido, con puentes di-sulfídicos.
- Las glicoproteicas (tirotropina y gonadotropinas). Que tienen idéntica la sub-unidad alfa de 89 aminoácidos y diferente la beta. Que les da sus propiedades específicas (Fig.3. TSH, FSH y LH).
- Las derivadas de la pro-opio-melano-cortina o POMC. (ACTH, beta-MSH y lipotropina) -llamada la gran mamá-. Precursora de péptidos más pequeños que son producidos por un procedimiento post-translacional.
Embriología, anatomía e histología – Adenohipófisis
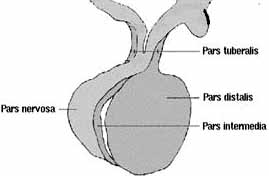 Embriológicamente la adenohipófisis se desarrolla a partir de una invaginación. – Durante la cuarta semana – del ectodermo superficial. (El techo de la región oral primitiva) denominada Bolsa de Rathke.
Embriológicamente la adenohipófisis se desarrolla a partir de una invaginación. – Durante la cuarta semana – del ectodermo superficial. (El techo de la región oral primitiva) denominada Bolsa de Rathke.
Crece esta hacia el infundíbulo y luego se separa de la cavidad oral. Convirtiéndose en un islote epitelial hueco que en su parte más alta se une a una prolongación del piso del encéfalo. Dando lugar más adelante a la parte tuberal de la pituitaria. En cuanto al islote, las células de su parte anterior se tornan gruesas y forman la parte anterior de la hipófisis (Fig. 1).
La hipófisis es una estructura ovoide que pesa unos 500 mg. Cuya porción principal descansa en una depresión del esfenoides conocido como la silla turca. El 75% de la glándula lo constituye la adenohipófisis. Que consta de la pars distalis (la más importante), la tuberalis (que hace parte del tallo hipofisiario junto con el infundíbulo). Y la pars intermedia, casi inexistente en el humano.
Una deflexión de la duramadre en forma de diafragma –a través de la cual pasa el tallo hipofisiario- divide la glándula en sus porciones infla y supraselares. El quiasma óptico se encuentra arriba y adelante. Abajo está el seno esfenoidal y lateralmente están los senos cavernosos. Mientras que hacia atrás están los cuerpos mamilares. El sistema portal hipotálamo-hipofisiario –del que hablamos en el capítulo sobre neurohormonas- es parte importante de la estructura anatómica.
Histológicamente se ha hablado de que la hipófisis tiene – en cantidades por mitad- unas células cromófilas. (Que se tiñen con hematoxilina-eosina). Y otras cromófobas o C (más pequeñas, que apenas se tiñen o no lo hacen). Hoy se considera que ambos tipos de células hacen parte de un ciclo de actividad e inactividad secretora.
Aunque no es muy notable la diferenciación de las células cromofilas entre basófilas o b y las acidófilas o a. Esta terminología aún se menciona. Las hormonas glicoproteicas (PAS positivas) y las derivadas de la pro-opio-melano-cortina (POMC) pertenecen a las primeras. Y las somato-mamotróficas a las segundas.
La adenohipófisis contiene dos tipos de células acidófilas y tres de células basófilas. Cada una tiene una distribución característica. Siendo las somatotropas la mitad (se localizan en las alas laterales). Corticotropas (en la región anteromedial entre las alas mencionadas) y tirotropas (que abundan en el borde anteromedial). Las mamotropas y gonadotropas tienen una distribución más irregular (Fig.2).
HORMONAS DE LA ADENOHIPÓFISIS
 Decíamos que hay allí seis tipos de células secretoras. Todas –con excepción de una- especializadas en la producción de una sola hormona.
Decíamos que hay allí seis tipos de células secretoras. Todas –con excepción de una- especializadas en la producción de una sola hormona.
Se trata del somatotropo (somatotropina), lactotropo (prolactina), tirotropo (TSH), gonadotropo (que segrega tanto FSH como LH), corticotropo (ACTH) y melanotropo (alfa-MSH).
Hay tres clases de hormonas en la adenohipófisis:
Las somato-mamotróficas (hormona del crecimiento, prolactina). Cadenas largas de un solo péptido, con puentes di-sulfídicos.
 Las glicoproteicas (tirotropina y gonadotropinas). Que tienen idéntica la sub-unidad alfa de 89 aminoácidos y diferente la beta, que les da sus propiedades específicas (Fig.3. TSH, FSH y LH)
Las glicoproteicas (tirotropina y gonadotropinas). Que tienen idéntica la sub-unidad alfa de 89 aminoácidos y diferente la beta, que les da sus propiedades específicas (Fig.3. TSH, FSH y LH)
Las derivadas de la pro-opio-melano-cortina o POMC (ACTH, beta-MSH y lipotropina) -llamada la gran mamá-. Precursora de péptidos más pequeños que son producidos por un procedimiento post-translacional.
Hormonas somato-mamotróficas
La hormona del crecimiento, también llamada somatotropina. Es codificada por un gen de un grupo de cinco. -Localizado en el brazo largo del cromosoma 17-. Es una mezcla heterogénea de péptidos que se diferencian por su tamaño o su carga.
Como decíamos, la mitad de las células hipofisiarias son somatotropos y la producción de la hormona del crecimiento. – Grande en niños- alcanza las cifras más altas en la adolescencia, bajando a niveles mínimos en la edad adulta. Su secreción de hormona ocurre en pulsos separados e irregulares –con picos y valles-. De manera que hay momentos en que sus niveles séricos pueden llegar a ser indetectables.
En la noche –después de comenzar el sueño profundo- los pulsos son más amplios y constantes. Debido a estas variaciones, en el diagnóstico clínico es necesario – o bien tomar varias muestras y hacer un pool. O hacer pruebas dinámicas, particularmente para detectar una deficiencia.
Fisiológicamente hay dos hormonas – la gonado-relina y la somatostatina-. Que regulan su liberación. Pero también hay varios estímulos (neuro-transmisores, fármacos o metabolitos) que influyen en la secreción de la hormona.
La glucosa plasmática también es un potente regulador. Y la hipoglicemia por insulina y otras causas produce un rápido aumento en su secreción, al igual que el ejercicio, el estrés, la excitación emocional y el consumo de alimentos ricos en proteínas.
 Como veíamos en el capítulo sobre generalidades. Las similitudes entre la hormona del crecimiento y la prolactina son los receptores. Homólogos en cuanto a secuencia de aminoácidos y organización estructural general.
Como veíamos en el capítulo sobre generalidades. Las similitudes entre la hormona del crecimiento y la prolactina son los receptores. Homólogos en cuanto a secuencia de aminoácidos y organización estructural general.
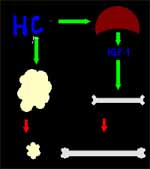
Numerosos tejidos reciben el efecto de la somato-tropina. Entre ellos el hígado, los diferentes tejidos musculares (estriado, liso, cardiaco), fibroblastos, tejido linfoide, gonadas y el hipotálamo.
Sus efectos son anabólicos en unos tejidos o catabólicos en otros. Los primeros son inhibidos por los gluco-corticoides y los segundos potenciados por ellos, pero contrarrestados por la insulina (Figura 4).
- Son acciones directas de la hormona del crecimiento
- Producir el factor insulina-símil 1 (IGF-1 o somatomedina)
- Lipólisis
- Estímulo de la gluconeogénesis.
- Son efectos mediados por el IGF-1:
- Producir hiperplasia –más que hipertrofia- en casi todos los tejidos
- Estimular la condrogénesis, el crecimiento del esqueleto y de tejidos blandos
La prolactina es otra hormona somato-mamotrófica. Que contiene 199 aminoácidos y aunque pertenece a la superfamilia del gen prolactina-GH. Puede ser codificada en mamíferos en estos además por más de un gen y además existe una amplia gama de variantes estructurales. Generalmente se origina en el lactotropo. Pero también en el somatotropo, en el cerebro, tejido mamario, folículos ovárico y glándulas accesorias sexuales masculinas.
Su síntesis y secreción en el feto comienza en las primeras semanas de embarazo y sus concentraciones disminuyen después de nacer. En los hombres permanecen bajas durante la vida y son un poco mayores en mujeres con ciclos normales. En el embarazo los niveles aumentan y llegan al máximo al final de la gestación. Disminuyendo en caso de que no haya lactancia materna.
En las que dan pecho a su bebé, la succión o la manipulación de las mamas estimula la secreción de prolactina. Y las concentraciones circulantes de esta última pueden aumentar de diez a cien veces en la media hora siguiente a la estimulación.
Su secreción es básicamente inhibida por la dopamina o PIF y también por los estrógenos. La administración de TRH produce liberación de prolactina. Aparte de la succión y manipulación, los factores que afectan su secreción son similares a los que intervienen en la secreción de hormona del crecimiento.
La prolactina actúa sobre la glándula mamaria, que también –durante el embarazo- es influida por otras hormonas. (Estrógenos, progesterona, lactógeno placentario, hormona del crecimiento, insulina, cortisol y hormona tiroidea). Que preparan a las mamas para la lactancia.
Durante la gestación la secreción láctea se inhibe merced a los altos niveles de estrógenos y progesterona. En el puerperio, la prolactina diferencia las células pre-secretorias en secretorias. Y aumenta la síntesis de la caseína, lactalbúmina y beta-lactoglobulina (proteínas de la leche), la de los ácidos grasos y fosfolípidos.
Las enzimas que intervienen en la generación de lactosa también son estimuladas por esta hormona. Durante la lactancia, la succión estimula la producción de prolactina y la hormona eyecto-láctea –la oxitocina-. Favorece la salida del alimento materno.
Glicoproteínas
 Las hormonas hipofisarias luteinizante (LH), la folículo-estimulante (FSH) y la gonadotropina coriónica (HCG), son las hormonas gonadotrópicas. Estas – y la TSH- son glicoproteínas. En hombres y mujeres, la síntesis y secreción de FSH y LH es realizada por el gonadotropo.
Las hormonas hipofisarias luteinizante (LH), la folículo-estimulante (FSH) y la gonadotropina coriónica (HCG), son las hormonas gonadotrópicas. Estas – y la TSH- son glicoproteínas. En hombres y mujeres, la síntesis y secreción de FSH y LH es realizada por el gonadotropo.
Como informábamos anteriormente, la sub-unidad alfa es idéntica en estas hormonas y tiene 89 aminoácidos, y la que cambia es la sub-unidad beta. Ambas gonadotropinas tienen el mismo número de aminoácidos –ciento quince- y su secreción es regulada por la gonado-relina hipotalámica.
En las mujeres, la progesterona y los estrógenos inhiben la liberación de LH y FSH. Mientras que en los hombres son la testosterona y el estradiol las que inhiben la secreción de gonadotropina. Ambas glicoproteínas actúan en las fases finales de maduración del folículo ovárico, estimulando la descarga estrogénica.
El feedback es negativo sobre la LH cuando los niveles estrogénicos están bajos o constantes. Pero si son niveles altos –cuando el folículo está maduro- el feedback es positivo y se produce el pico de LH que genera la ovulación unas nueve horas después. La LH continúa luego promoviendo la formación del cuerpo lúteo, que produce progesterona.
Otra regulación de la secreción gonadrópica es realizada por la inhibina. Un péptido producido por ovarios y testículos en respuesta a la FSH. La inhibina suprime selectivamente la síntesis de FSH y su secreción, sin efectos en la síntesis y secreción de LH .
En los hombres la liberación de LH y FSH es parecida, aunque los impulsos de LH son mayores que la de los de FSH (Figura 5). Y este patrón paralelo de secreción persiste durante toda la vida masculina. Durante la vida fértil de la mujer ocurre un patrón más complejo de secreción de LH y FSH, como resultado del ciclo menstrual.
En la menopausia cesa la función de los ovarios. Al no haber hormonas femeninas ni inhibina para suprimir la secreción de LH y FSH. Se produce un gran aumento de FSH, con niveles más altos que los de LH.
Resumiendo -en mujeres sexualmente maduras- la FSH (con la ayuda de la LH) actúa sobre el folículo para producir la liberación de estradiol (E2). Y –en los hombres con maduración sexual- actúa sobre las espermatogonias para –con la ayuda de la testosterona- producir el semen.
La LH –en el sexo femenino- estimula al folículo que segrega estrógenos. Y merced a su pulso en la mitad del ciclo, completa la meiosis del óvulo y lo libera, estimulando luego al folículo ya vacío para que se convierta en cuerpo lúteo, que segrega la progesterona.
En los hombres la LH (llamada también estimulante de las células intersticiales o ICSH) estimula dichas células de Leydig para que se produzca la testosterona.
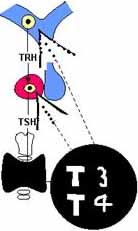
La tirotropina, TSH u hormona estimulante de la tiroides estimula esta glándula para la producción de hormonas tiroideas, tiroxina o T4 y triyodo-tironina o T3. Y es a su vez regulada por la TRH del hipotálamo y por medio de la retro-alimentación, por la fracción libre de la tiroxina. La TSH tiene cierta independencia de la TRH, pues en ausencia de la última se puede mantener un grado mínimo de función tiroidea.
La somtostatina hipotalámica también inhibe su secreción. Su cadena beta –que le da sus propiedades tiro-estimulantes- tiene ciento doce aminoácidos y la alfa-. Al igual que la de las gonadotropinas- ochenta y nueve. (Figura 6. Eje hipotálamo-hipófisis-tiroides)
Hormonas derivadas de la pro-opio-melano-cortina
De la POMC (péptido que llaman la mamá grande) se derivan el ACTH, un fragmento amino-terminal que da origen a la gama-MSH y la beta-lipotropina. Esta última se rompe en varios fragmentos, hormona estimulante de los melanocitos (beta-MSH). Encefalina y endorfinas alfa, beta y gama.
De estas, la que se encuentra en mayor cantidad en el hipotálamo es la beta-endorfina. Estos clivajes proteolíticos mencionados no ocurren en todas especies. Y algunos –particularmente en animales inferiores como el camaleón- ocurren en la pars intermedia.
La beta lipotropina tiene un efecto lipolítico débil, pero su principal función es generar endorfina. La beta-endorfina influye en varias funciones hipotalámicas como la reproducción, la temperatura, funciones cardiovascular y respiratoria, percepción del dolor y estado de ánimo.
La expresión del gen de la POMC a nivel pituitario es controlada por la CRH y controlada por feed-back negativo de glucocorticoides. En el hipotálamo es regulada por esteroides sexuales. Estos opioides endógenos se encuentran en nivel inverso a la de la Gn-RH y de las gonado-trofinas.
La acción de la encefalina está relacionada con la modulación de la vía de las catecolaminas, especialmente de norepinefrina. No intervienen receptores para dopamina, acetilcolina o a-adrenérgicos. Posiblemente la endorfina puede afectar directamente la liberación de GnRH.
La liberación de CRH y por tanto de ACTH, está regulada por el cortisol plasmático a través de un feed-back negativo. Este eje hace parte muy importante de las situaciones de estrés. donde con la epinefrina, el glucagón y la hormona del crecimiento conforman el grupo de las hormonas del estrés. La corticotropina o ACTH es un polipéptido de 39 aminoácidos con un N-terminal (efectos secretores) y C-terminal (efectos antigénicos y protectores parciales de la proteólisis).
El análogo que contiene los primeros 24 aminoácidos tiene –al igual que el natural de 39- un ciento por ciento de potencia cuando se administra por vía parenteral. Como sus primeros 19 aminoácidos tienen una estructura que es igual a la de la alfa-MSH, esto explica las propiedades pigmentarias del ACTH.
Esta hormona estimula la producción de glucocorticoides y andrógenos tipo DHEA-S en las suprarrenales. E influencia algo la generación de aldosterona, aunque este mineralocorticoide responde principalmente al eje renina-angiotensina. La suprarrenal responde al máximo durante veinticuatro horas –en forma de todo o nada- a una unidad diaria de ACTH.
Historia de la Fisiología de la Adenohipófisis
Aunque el nombre de hipófisis (que quiere decir protuberancia inferior del cerebro) fue dado por Sömmering en 1778, ya Galeno proponía que impurezas del cerebro drenan a la nasofaringe a través de ella.
En 1543, Vesalio la llamó pituitaria (secretora de moco) y en el siglo XVII Schneider y Lower hablaron de sustancias que la hipófisis destilaba a la circulación.
Ashner en 1912 fue el primero en demostrar la relación funcional entre el hipotálamo y las glándulas endocrinas al inducir atrofia ovárica en perros luego de inyectar parafina en la región hipotalámica y en 1913, Stieve es el primero en demostrar que las gallinas en presencia de un zorro dejan de poner huevos.
Westman y Jacobsohn logran demuestran que la sección del tallo bloquea la ovulación. En 1940 Rioch sugirió la nueva nomenclatura anatómica y en 1946, Markee observa que la estimulación eléctrica de la hipófisis no induce la ovulación, lo cual hace pensar en la existencia de sustancias producidas por el hipotálamo -transportadas a través del sistema porta- que actúan sobre las células hipofisiarias y regulan los eventos reproductivos.
Experimentos posteriores de Schally y Guillemin demuestran la relación directa entre hipotálamo e hipófisis y se empiezan a identificar factores estimuladores e inhibidores; en 1971 Matsuo -y luego Burgos- logra aislar y analizar la estructura de la hormona liberadora de gonadotropinas (GnRH).
PATOLOGÍA – Fisiología de la Adenohipófisis
La deficiencia de hormonas hipofisiotropas se llama hipopituitarismo hipotalámico. Existen numerosas causas, aunque poco frecuentes; entre ellas están: la compresión o destrucción del hipotálamo por tumores (Craniofaringioma, Pinealoma ectópico, Glioma, Quiste dermoide y teratoma en línea media, tumor del seno endodérmico, metástasis), la enfermedad de Hans-Schuller-Christian, Tuberculosis y sarcoidosis, Trauma cráneo-encefálico e Irradiación.
El hipopituitarismo primario puede ser el resultado de la ablación quirúrgica o radiológica, por la presencia de tumores y lesiones infiltrativas, o por el infarto de la hipófisis (Síndrome de Sheehan). Entre las primeras manifestaciones de esta necrosis hipofisiaria post-parto están la amenorrea, agalactia, caída del vello axilar y púbico, astenia, palidez, hipotensión, hipoglicemia, y más adelante, un cuadro clínico de hipotiroidismo.
Existen también las deficiencias selectivas de hormonas hipofisiarias, como la de la somatotropina, que conduce al enanismo hipofisiario. Otro síndrome que en ocasiones se observa es el de la silla turca vacía -que puede recordar un tumor a la imagenología- y que generalmente representa una alteración congénita con ausencia parcial del diafragma selar, que permite la extensión del espacio subaracnoideo hacia la fosa selar, aplanando la hipófisis contra el piso de la silla turca, que puede demineralizarse.
Los síndromes de excesos hormonales se ven más frecuentemente con la prolactina y la hormona del crecimiento. Los microprolactinomas son frecuentes, se asocian con el síndrome de galactorrea-amenorrea y con infertilidad.
Su manejo lleva a la corrección de las molestias, prevención de la osteoporosis y búsqueda de un embarazo, pero desde el punto de vista tumoral tienen un comportamiento benigno, pues en la enorme mayoría de los casos el tumor no aumenta de tamaño. Si es un macroprolactinoma es necesario el tratamiento quirúrgico, especialmente si hay síntomas como cefalea o trastornos visuales.
Los adenomas hipofisiarios más frecuentes son los productores de prolactina; corresponden al 50% de los tumores encontrados en autopsias. Hay muchas causas de hiperprolactinemia además de las tumorales, entre ellas una serie de medicamentos.
En cuanto a la hormona del crecimiento, su exceso produce gigantismo en los niños y acromegalia en los adultos. La incidencia de este último síndrome es de seiscientos casos anuales en los Estados Unidos y se caracteriza por crecimiento acral, prognatismo y separación de las piezas dentales, hiperdiaforesis, artrosis, cardiomegalia y en general organomegalia, diabetes, hipertensión, cefalea y muchas otras manifestaciones serias que requieren tratamiento.
TERAPÉUTICA – Hipopituitarismo hipotalámico
Para lo casos de hipopituitarismo, el tratamiento se base en la terapia hormonal de suplencia que se administra según los ejes comprometidos; generalmente se administran hormonas tiroideas, corticoides tipo hidrocortisona siguiendo el ritmo circadiano y hormonas estro-progestágenas.
En la deficiencia de hormona del crecimiento –enanismo hipofisiario- se administra la hormona fabricada por el método de DNA recombinante, aunque algunas indicaciones adicionales –como su administración en maduradores lentos o para combatir el envejecimiento- continúan siendo debatidas. Además, en fertilidad, en criptorquidia o en hipogonadismos centrales se utilizan las gonadotropinas, al igual que Gn-RH de larga duración para el cáncer de próstata y otras patologías.
En la acromegalia y macro-adenomas hipofisiarios, el tratamiento es usualmente quirúrgico, aunque pueden usarse drogas tipo ocreótido –en el primer caso- o tipo bromocriptina –en el segundo- que frecuentemente son de utilidad independientemente de su costo o efectos secundarios.
Referencias seleccionadas
- Barón-Castañeda G. Fundamentos de endocrinología ginecológica. Contacto Gráfico, Bogotá, 1998.
- Raff H. Secretos de la Fisiología. Editorial McGraw-Hill Interamericana. México, 2000.
- Augsten AL, Bowen RA, Rouge M. Pathophysiology of the endocrine system. Colorado State University, Fort Collins, CO, 1999. www.arbl.cvmbs.colostate.edu/hbooks/pathphys/endocrine/index.html
- Banks D. Endocrinology and nutrition. 1996. United Medical and Dental Schools, Guy’s and St. Thomas hospitals, London. www.umcls.ac.uk/physiology/banks/endonut.htm#start
- Koeslag J. Companion to endocrinology studies. Department of Medical Physiology, University of Tigersberg, South Africa. www.sun.ac.za/med_physbio/med_physiology/dept/ENDO.HTM
- Christine Bole-Feysot, Vincent Goffin, Marc Edery, Nadine Binart, Paul A. Kelly
- Prolactin (PRL) and Its Receptor: Actions, Signal Transduction Pathways and Phenotypes Observed in PRL Receptor Knockout Mice Endocr Rev Jun 01, 1998 19: 225-268.
- Anne-Simone Parent, Grete Teilmann, Anders Juul, Niels E. Skakkebaek, Jorma Toppari, Jean-Pierre Bourguignon The Timing of Normal Puberty and the Age Limits of Sexual Precocity: Variations around the World, Secular Trends, and Changes after Migration Endocr Rev Oct 01, 2003 24: 668-693.
- Andrea Giustina, Johannes D. Veldhuis Pathophysiology of the Neuroregulation of Growth Hormone Secretion in Experimental Animals and the Human Endocr Rev Dec 01, 1998 19: 717-797.
- Nira Ben-Jonathan, Robert Hnasko Dopamine as a Prolactin (PRL) Inhibitor Endocr Rev Dec 01, 2001 22: 724-763.