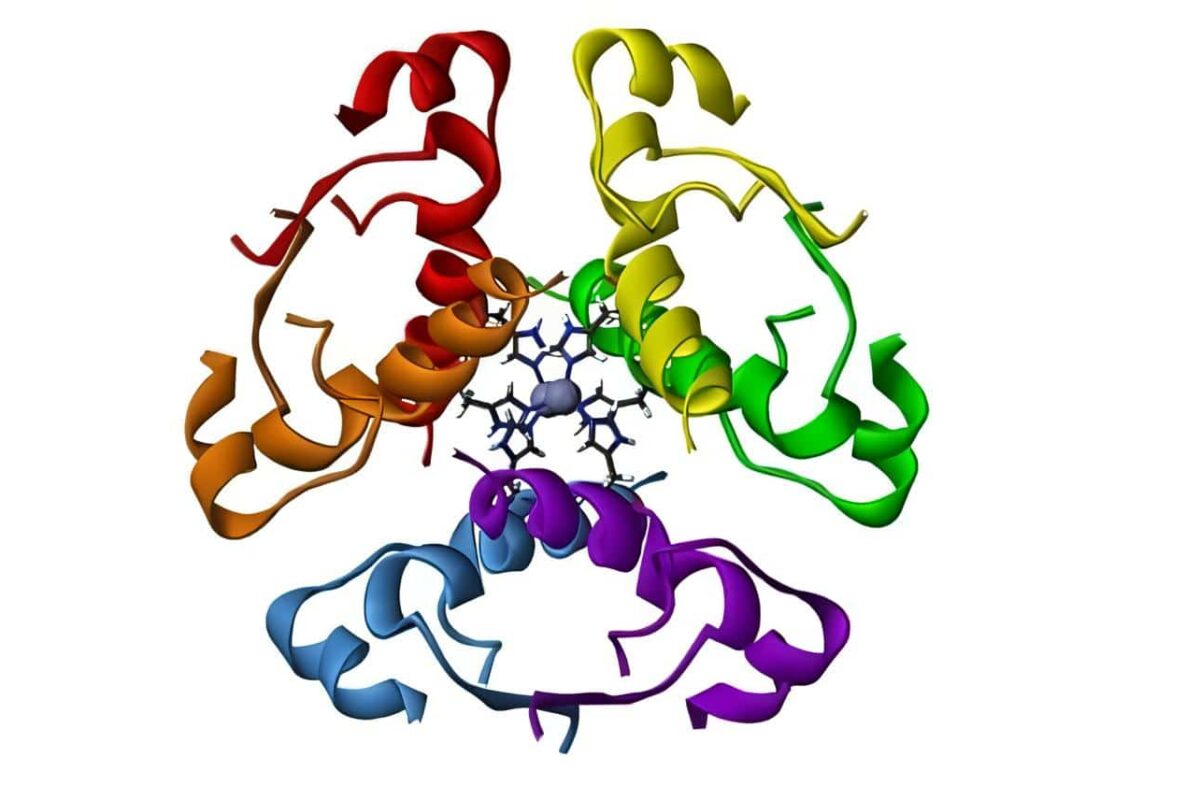
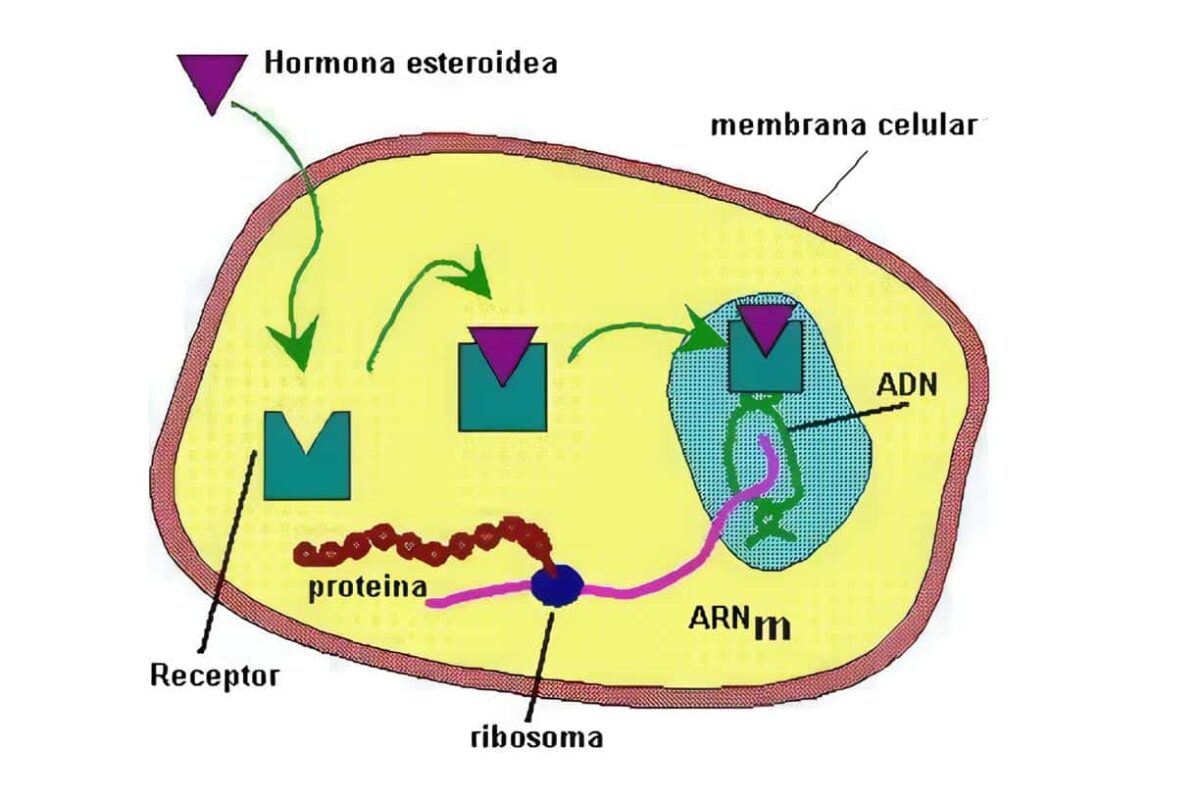
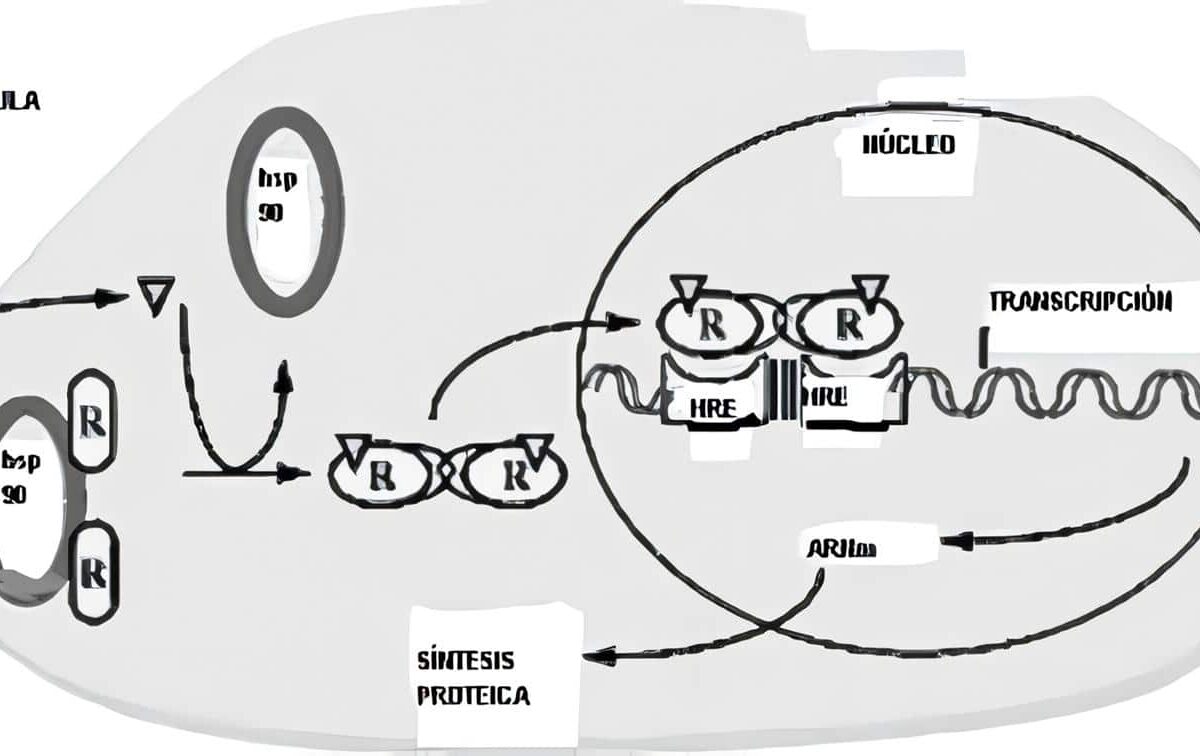
Atrofia post-insulitis
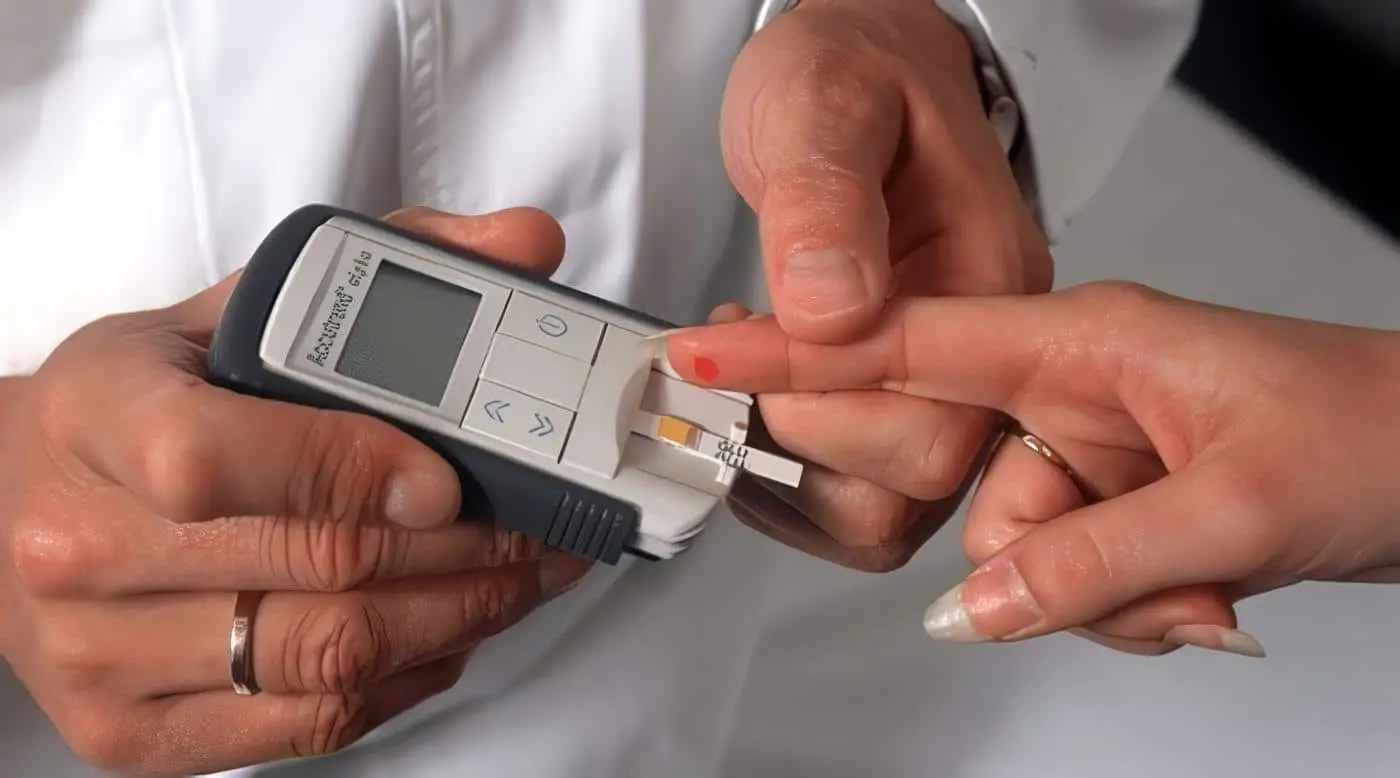
La atrofia post-insulitis o la resistencia a la insulina causan el déficit hormonal involucrado en el trastorno metabólico más común. Las dos formas de la diabetes mellitus. En la hiperglicemia aguda y severa (con poliuria, polidipsia y pérdida de peso) se revierten los procesos anabólicos que la insulina induce y –ante la pérdida masiva de glucosa, agua y electrolitos por la orina- se producen deshidratación y baja en el potasio intracelular.
Hay aumento de la glicógenolisis, de la neoglucogénesis y de la cetogénesis, lo que lleva a la cetoacidosis diabética, coma y muerte. Se puede revertir todo el proceso catabólico con insulina, hidratación, electrolitos y –en severa acidosis- administración de bicarbonato. La amplia disponibilidad de insulina ha aumentado la expectativa de vida del diabético. Haciendo que las complicaciones microvasculares crónicas se conviertan en los principales problemas a combatir.
La hiperglicemia crónica –medida por niveles elevados de hemoglobina glicosilada en sangre- más la elevación de otros metabolitos como los ácidos grasos libres. Llevan a la neuropatía, nefropatía y disfunción del endotelio vascular con retinopatía. Lo que asociado con una aterogénesis aumentada –particularmente si existen otros factores de riesgo- llevan al pie diabético y a complicaciones cardio y cerebro-vasculares.
Las hipótesis fisiopatológicas de las complicaciones microvasculares son:
- Aumento en la vía del flujo de los polioles
- Aumento de los productos de glicosilación avanzadas (AGE)
- Activación de las isoformas de la proteinquinasa C (PKC)
- Aumento en el flujo de la vía de la hexosamina
(Lea También:Fisio-patología de la Diabetes Parte II)
Mario Sánchez Medina explica las hipótesis de la siguiente manera:
La aldosa reductasa (Aditol: NAD(p)+1/oxidorreductasa) es la primera enzima en la vía de los polioles. Es citosólica y cataliza el NADPH dependiente de la reducción de una amplia variedad de compuestos carbonilos que incluyen la glucosa. La aldosa reductasa tiene muy baja afinidad con la glucosa y hay concentraciones normales de glucosa en personas no diabéticas. El metabolismo de la glucosa por esta vía es de muy bajo porcentaje. Al aumentar la glucosa intracelular se aumenta la conversión del poli alcohol sorbitol con la correspondiente disminución de NADPH.
Durante la hiperglicemia el flujo de esta vía es aproximadamente de 33% del total de la glucosa en uso y del 11% en los glóbulos rojos humanos. El efecto de la hiperglicemia es el aumento del flujo de la vía de los polioles que incluye el sorbitol y, que no se difunde fácilmente a través de las membranas por lo cual se ha sugerido que da lugar a un daño osmótico microvascular.
Sin embargo está lejos de dar lugar a una alteración osmótica definitiva. La hipótesis más reciente es que la oxidación del sorbitol por el NAD aumenta la relación NADH: NAD+ inhibiendo la actividad de la dehidrogenasa gliceraldehído/trifosfato (GADPH) y aumentando la concentración de triosafosfato28.
Al elevarse las concentraciones de triosafosfato se aumenta la formación de metilglioxal. Un precursor de los AGEs y del diacilglicerol (DAG) que activa el PKC. Los estudios de la inhibición de la vía de los polioles ha dado resultados inconsistentes. El único efecto positivo en un estudio multicéntrico controlado demostró que el zenarest es un potente inhibidor de la aldosa reductasa.
La segunda hipótesis plantea el aumento en la formación de productos finales de glicosilación avanzada (AGEs):
Estos productos AGEs se encuentran en mayores cantidades en los vasos retinianos y glomerulares de los diabéticos. Se forman a partir de grupos carbonilos derivados de la glucosa que se generan intracelularmente. Siendo la hiperglicemia el primer evento para su formación intra o extracelular.
Los AGEs provienen de una auto-oxidación intracelular de glucosa a glioxal por descomposición del producto Amadori (glucosa derivada 1amino/1 de oxifructuosa) o a 3/de oxiglucosona. posiblemente acelerada por una amadoriasa y por fragmentación del gliceraldehído 3/fosfato y fosfato de dehidro-oxiacetona a metilglioxal y deoxiglucosona, reaccionando con amino grupos intracelulares y extracelulares para formar los AGEs.
El metiglioxal y el glioxal son detoxificados por el sistema glioxalasa.
La producción intracelular de precursores AGE daña las células blanco por tres mecanismos:
- Proteínas intracelulares modificadas por los AGEs alteran su función
- Los componentes de la matriz extracelular modificada por los precursores de los AGEs interactúa con otros componentes de la matriz y sus receptores proteicos integrinas
- Las proteínas plasmáticas modificadas por los precursores de los AGEs se unen a sus receptores en las células endoteliales. En las células mesangiales y en los macrófagos induciendo la producción de especies reactivas de oxígeno (ROS).
Según Evans y colaboradores, el aumento en las ROS aumenta el estrés oxidativo en una variedad de tejidos –con un desequilibrio de los sistema redox- que lleva a la activación de vías de señalización intracelular sensibles al estrés como el factor nuclear B (NF-B), p38 MAPK, quinasas Jun con terminal amonio/proteino quinasas activadas por el estrés (JNK/SAPK), proteino quinasa C (PKC), productos finales de glicosilación avanzada y sus receptores (AGE/RAGE) y sorbitol. lo que lleva a la generación de productos genéticos tales como el VEGF que causan el daño celular responsable de las complicaciones diabéticas tardías y que también son mediadoras de la resistencia periférica a la insulina y el trastorno de la secreción insulínica.
Continúa Sánchez-Medina:
La formación de AGEs altera las propiedades funcionales de varias moléculas importantes de la matriz endotelial. Un tipo de colágeno intermolecular al ligarse con los AGEs induce la expansión del paquete molecular.
La formación de AGEs en la matriz extracelular no solamente interfiere en las interacciones de la misma matriz sino que interfiere entre las interacciones célula-matriz, como sucede en el caso de la modificación del colágeno tipo IV cuyos dominios de ligadura disminuyen la adhesión de las células endoteliales.
Diversas proteínas que se unen con los AGEs se han identificado que incluyen la galectina/3, el receptor barrendero tipo II del macrófago y el receptor RAGE34 Consistente con este concepto de bloqueo de un receptor RAGE el cual es un miembro de la superfamilia de las inmunoglobulinas que inhibe el desarrollo de la nefropatía, aumenta, promueve la reparación de heridas y media en la traducción y generación de especies de oxígeno reactivo, activando el factor NF/KB35.