En la tabla 2 podemos ver un listado de los corticoides aislados de la corteza suprarrenal y su producción promedio en 24 horas.
Tabla 2. Corticoides aislados de vena suprarrenal
| Glucocorticoides | Cortisol Corticosterona |
15-30 mg 2-5 mg |
| Mineralocorticoides | Aldosterona 11-deoxicorticosterona |
50-150 mcg Trazas |
| Andrógenos | DHEA Delta-4- androstenediona 11 beta-hidroxi-androstenediona |
15-30 mg 0-10 mg 0-10 mg |
| Progestágenos | Progesterona Pregnenolona 17-hidroxi-pregenenolona |
0.4-0.8 mg 0.5-0.8 mg 0.2-0.4 mg |
| Estrógenos | Estradiol | Trazas |
El cortisol representa el 80% de los 17-hidroxicorticosteroides (glucocorticoides) presentes en el plasma:
La mitad es glucuronato de tetrahidrocortisol, inactivo biológicamente; la otra mitad –que se halla en su forma original- es transportado en un 85-90% por una alfa-globulina fijadora de cortisol (CBG o Transcortina), proteína vectora de origen hepático, que a más de transportar al cortisol (facilitando su solubilidad) evita su reducción y conjugación en el hígado.
El restante cortisol se encuentra en forma libre, disponible para su utilización en los tejidos, es la forma metabólicamente activa y como tal puede excretarse por la orina.
Los pulsos de ACTH producen una variación diurna en el tejido suprarrenal (que se ve con otras hormonas como la testosterona); este ritmo circadiano se refleja en cambios en la concentración plasmática de cortisol. Hacia las 3 a.m. empiezan a subir estas dos hormonas, llegando a su máximo a las 6 a.m. En las horas de la tarde van cayendo, llegando a su mínimo hacia la medianoche.
Así que el cortisol matutino es alrededor del doble del vespertino.
Este ritmo no se pierde con la vigilia continua ni con la pérdida de la visión, ni con viajes de norte a sur, pero si con los de este a oeste y viceversa (uno de los cambios posiblemente responsables del “jet lag”) y típicamente también se pierde en la enfermedad de Cushing.
Cuando el nivel cortisólico sube a más de 20 mcg%, el cortisol se liga débilmente a la albúmina y empieza a aumentar en su forma libre en la orina. Como es el cortisol libre el responsable de la retroalimentación con CRH-ACTH, los aumentos en la CBG y la fracción fijada (estrógenos, embarazo, hipertiroidismo) o su disminución (estados asociados a hipoproteinemia, hipotiroidismo), no causan ni hiper ni hipo-adrenocorticismo.
Después de 90 minutos de vida media, el cortisol se excreta en la orina, bien en su forma libre (80 mcg), como tetrahidrocortisol o cortolona (3 mg), o como glucuronato de tetrahidrocortisol o tetrahidrocortisona (8 mg).
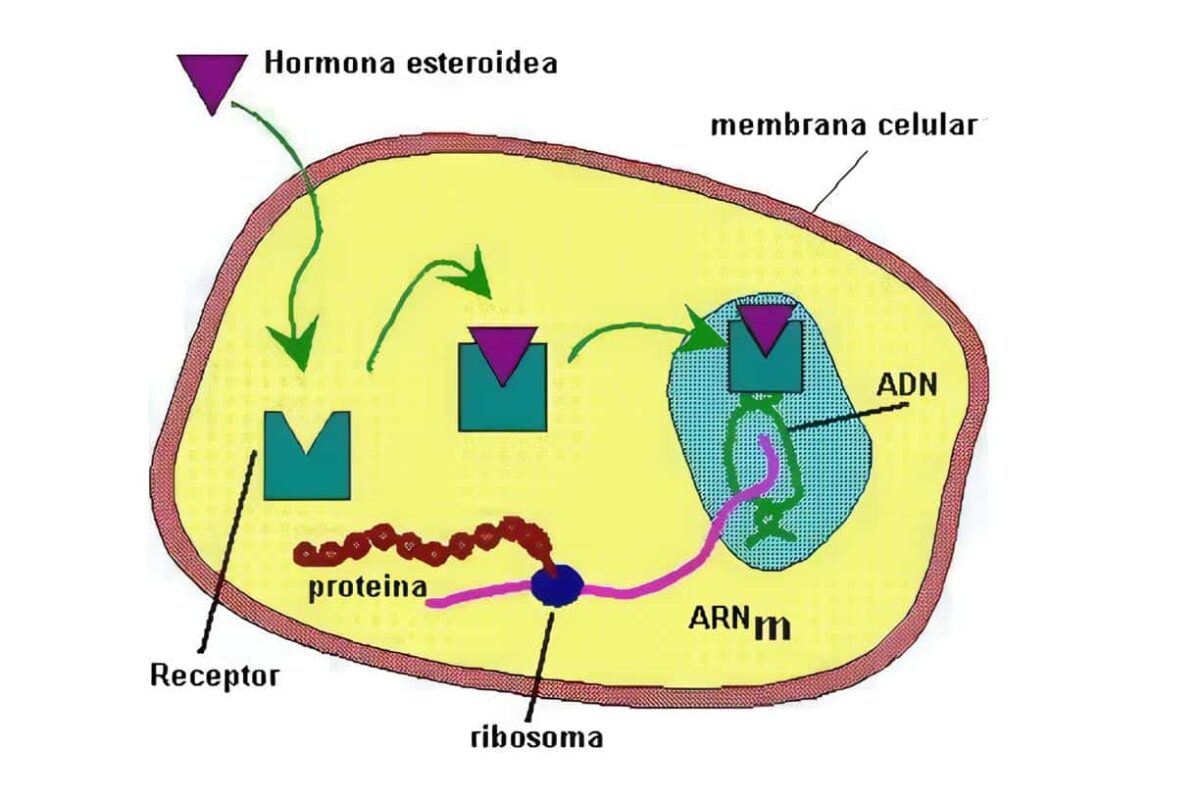
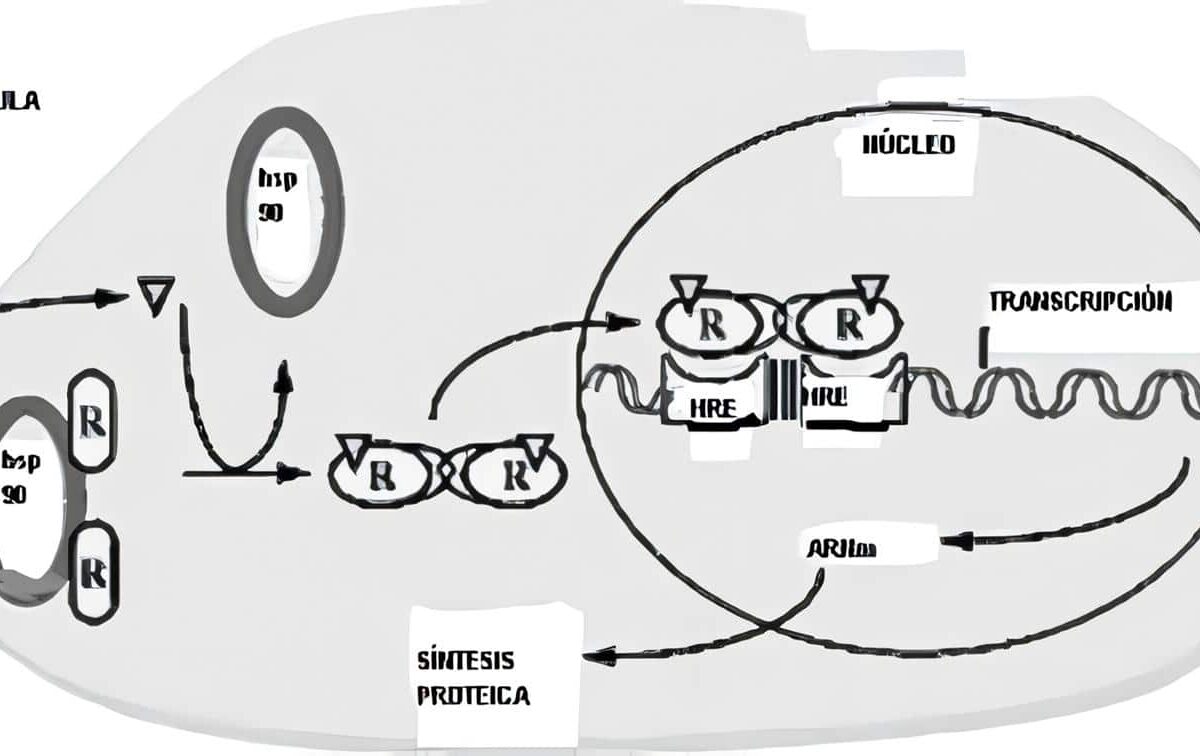
El cortisol se liga a su receptor citosólico; este es miembro de una superfamilia de receptores que incluye receptores para los esteroides, para las hormonas tiroideas y otros receptores llamados “huérfanos” pues a muchos no se les conoce aún una función; estos receptores están ligados a una proteína de choque por calor (Hsp/hsp90).
El cambio conformacional que induce la fijación del esteroide hace que el receptor se disocie de la proteína de choque y forme un complejo de homodìmeros que se transportan activamente al núcleo, donde se fija al elemento de respuesta del DNA en los genes blanco (que tiene la misma secuencia tanto para el receptor glucocorticoide como para el mineralocorticoide), modulando la trascripción de un cierto número de genes que cambian el fenotipo de la célula; por efectos genómicos, se sintetizan proteínas y hay mediación indirecta de algunos de estos efectos por influencias paracrinas de citoquinas hormono-reguladas que provienen de células cercanas e inducen cambios fisiológicos, algunos de los cuales ocurren rápidamente.
Todas las células tienen receptores de glucocorticoides, lo que les permite tener un gran número de efectos sobre los diferentes sistemas.
La angiotensina II se liga tanto a receptores AT1 y AT2. Estos son receptores transmembrana que se acoplan a la proteína G (que por una serie de pasos facilitan el ingreso de calcio ionizado en el músculo liso vascular, por ejemplo).
Los AT1, Además de estar presentes en la zona glomerulosa, se encuentran en vasos sanguíneos, células musculares lisas, riñón, corazón, hígado y cerebro. Los menos conocidos AT2 están en suprarrenales, cerebro, miometrio, folículos ováricos y en tejidos fetales.
Al receptor mineralocorticoide se fijan con igual afinidad tanto la aldosterona como el cortisol, pero la primera (cuyos niveles son unos 2000 veces menores que los del segundo) es la que se fija en los tejidos en que actúa por que el cortisol es transformado allí a cortisona (un esteroide con muy débil afinidad con el receptor), debido a la presencia de la enzima CYP 11 B1, que de esta manera actúa como protector del receptor.
El hipocampo por ejemplo es una estructura nerviosa que tiene un número elevado de receptores mineralocorticoides, pero la aldosterona no actúa, precisamente porque no hay esta enzima protectora.
La aldosterona entonces se encuentra en pequeñas concentraciones en el plasma, pero es un mineralocorticoide muy potente cuando actúa en el tùbulo contorneado distal, para retener sodio y excretar potasio e hidrógeno.
Se elimina por la orina como glucuronato de tetrahidroaldosterona (25 a 35 mcgs diarios), glucuronósido de aldosterona y aldosterona libre (1 a 10 mcg). La conjugación de los esteroides con el ácido glucurónico se realiza en el hígado y facilita la solubilidad de los esteroides.
(Lea También: Acciones de los Andrógenos y Patología Suprarrenal)
Acciones de los glucocorticoides
El cortisol y la corticosterona se forman en el hombre en una relación de 10:1. estos compuestos tienen numerosas acciones sobre el metabolismo; obviamente sus acciones en concentraciones fisiológicas difieren en algunos casos de las observadas en dosis terapéuticas o en casos patológicos, pero en otros, las acciones fisiológicas se ven reforzadas.
A) Acciones sobre los hidratos de carbono:
Protegen contra la hipoglicemia, elevando los niveles de glucosa, pues estimulan la gluconeogènesis hepática en el estado de ayuno (fortaleciendo la expresión de las enzimas que favorecen este proceso tan importante en carnívoros y algunos herbívoros); movilizan aminoácidos de tejidos extrahepàticos para que sirvan de sustrato de gluconeogènesis y en menor grado disminuyen la captación tisular de glucosa por por una acción anti-insulina; ejercen también una acción permisiva sobre el glucagón y la epinefrina, que necesitan de la presencia del cortisol para ejercer su acción glicogenolìtica.
B) Sobre las grasas:
Son lipolìticos, permitiendo que los ácidos grasos liberados se utilicen por el músculo para producción de energía y el glicerol como sustrato neoglucogènico; pero aumentan los niveles de lípidos circulantes, favoreciendo la aterosclerosis con su uso crónico.
En altas concentraciones aumentan el contenido total de grasas a expensas de las proteínas, favoreciendo una distribución centrípeta de ellas, como se observa en la enfermedad de Cushing.
C) Sobre las proteínas:
Los corticoides son esenciales para el crecimiento normal y aumentan la capacidad de trabajo del músculo.
Si hay deficiencia, se produce fatiga muscular y falla cardiaca. Si hay exceso, hay catabolismo proteico muscular, se impide el desarrollo del cartílago, se interrumpe el crecimiento –por posible bloqueo de la somatotropina-,se disminuye la formación de osteoide y la absorción intestinal de calcio por un efecto anti-vitamina D, que precisamente se usa en el tratamiento de la hipercalcemia; aumentan la calciuria y llevan a la producción de osteoporosis.
El moco gástrico tiende a disminuirse, al tiempo que la pepsina y el ácido clorhídrico aumentan, lo que favorece la producción de enfermedad ácido-péptica; también retardan la cicatrización.
D) Sobre el sistema nervioso central:
La deficiencia de corticoides produce letargo, apatía y falta de concentración, mientras que su exceso causa euforia, hiperactividad, insomnio y una disminución del umbral de excitación eléctrica, favoreciendo la aparición de convulsiones.
E) Metabolismo hidroelectrolìtico:
Mantienen una adecuada filtración glomerular, al impedir el paso de agua al interior de las células, favoreciendo la diuresis. La destrucción hepática de la vasopresina se ve favorecida por los corticoides, al tiempo que estos la bloquean directamente en el tùbulo contorneado distal.
Por su efecto mineralocorticoide, en dosis altas mantienen el volumen sanguíneo y natremia adecuadas (aunque debemos recordar que dicho efecto es muy inferior al de la aldosterona) y sensibiliza a las arteriolas al efecto presor de las catecolaminas, favoreciendo la hipertensión.
F) Efectos inmunológicos:
Son inmunosupresores a dosis altas, pues reducen el número de linfocitos y de eosinófilos circulantes, aumentando el recuento leucocitario a expensas de los neutrófilos, el de los hematíes y el de las plaquetas, pero su presencia también es importante en la respuesta inmune normal.
La linfolisis y la destrucción de células plasmáticas reduce la producción y cantidad circulante de anticuerpos, y se disminuyen las reacciones de hipersensibilidad a complejos antìgeno-anticuerpo y la resistencia a las infecciones.
G) Efecto anti-inflamatorio:
Este es uno de los efectos terapéuticos más buscados (al igual que el anterior), pues disminuyen todos los aspectos de la inflamación y retardan la cicatrización; estabilizan las membranas lisosómicas.
H) Promueven la maduración pulmonar fetal y la producción del surfactante necesario para la función pulmonar extrauterina.
I) Como efectos permisivos
(Ya que los glucocorticoides modulan algunas respuestas fisiológicas) tenemos la respuesta del músculo liso vascular y bronquial, que se disminuye en ausencia de cortisol pero se restaura con cantidades fisiológicas de este; y la respuesta lipolìtica de los adipositos, inducida por catecolaminas, que se reduce en la ausencia de cortisol.
La depresión mayor produce cambios como hipercortisolemia basal, ausencia de supresión de cortisol en la prueba con dexametasona (en un 50% de los casos) y una estimulación Paradójica de CRH / ACTH/ pre-tratamiento con dexametasona.
La no supresión de los niveles de cortisol está asociada con rasgos endógenos, melancólicos que indican la necesidad de intervención somática y tiene lugar cuando el paciente está en periodo sintomático, mientras que la normalización se acompaña generalmente de remisión de la patología; una falla en la remisión sería indicativa de un peor pronóstico.
Por otro lado, un estudio hecho por el grupo californiano de Rancho Bernardo demostró que los niveles endógenos de DHEA-S –pero no de otras hormonas sexuales- están asociados con depresión en mujeres menopáusicas, lo cual es una evidencia más de que este es un esteroide neuro activo.
Acciones de los mineralocorticoides
La aldosterona hace que el riñón retenga sal por reabsorción de sodio en el tùbulo distal, a expensas de los iones potasio e hidrógeno; posiblemente interviene en el intercambio sodio/ potasio a través de las membranas celulares, particularmente glándulas sudoríparas, saliva y tracto gastrointestinal.
Por su acción mineralocorticoide, mantiene el balance sodio/ cloro y regula el metabolismo hídrico y el volumen extracelular. Es el mineralocorticoide más potente, pues por aumento de la fosforilación oxidativa y mayor producción de moléculas de ATP, favorece la reabsorción activa de sodio en el tùbulo contorneado distal (donde se reabsorbe el 15% de este electrolítico, mientras que el 85% de la reabsorción se logra de manera activa también por el tùbulo contorneado proximal.
La DOCA es un mineralocorticoide que cuenta sólo con la trigésima parte de potencia mineralocorticoide y su administración terapéutica puede causar edemas, ya que no compensa el aumento del líquido extracelular con un aumento concomitante en la filtración glomerular.
La espironolactona y el amiloride antagonizan la acción renal de la aldosterona, efecto que en menor grado logra también la progesterona. El receptor mineralocorticoide regula la trascripción de genes específicos que codifican la ATP asa, lo que aumenta las bombas de sodio en las membranas baso laterales del riñón y estimula la expresión de canales de sodio.