Dr. Germán Barón Castañeda, M.D.
La anovulación funcional asociada con hipoestrogenismo
La anovulación funcional asociada con hipoestrogenismo, niveles normales o bajos de gonadotropinas y trastornos psicógenos fue inicialmente descrita por Klinefelter, Albright y Griswold en 1943. Ellos introdujeron el término “hipoestrinismo hipotalámico”; postulaban que este trastorno era causado por la falla en la vía nerviosa hipotálamo-hipofisiaria incapaz de liberar la hormona luteinizante.
En general, la mayoría de estudios ha demostrado que el problema subyacente es una alteración en la secreción pulsátil de GnRH.
La evaluación más detallada de estas pacientes ha demostrado que factores ambientales como la mala nutrición, la restricción calórica, la depresión psicógena, el estrés, el consumo excesivo de energía por ejercicio o combinación de estos factores preceden la iniciación de la amenorrea hipotalámica. La mayoría de estas pacientes en su historia muestran un comienzo normal de la menarquia con ciclos regulares hasta el momento de la enfermedad. Su perfil psicológico es típicamente el de mujeres altamente motivadas, inteligentes, con ocupaciones que producen alto grado de estrés, generalmente delgadas o con un peso normal.
La entrevista puede revelar una serie de crisis emocionales o factores desencadenantes antes de la aparición de la amenorrea, como por ejemplo el divorcio o la muerte de un amigo. Hay otros factores evidentes con frecuencia como la presión académica, falta de adaptación a su medio social y problemas psicosexuales.
El examen físico es importante ya que se debe descartar la presencia de galactorrea:
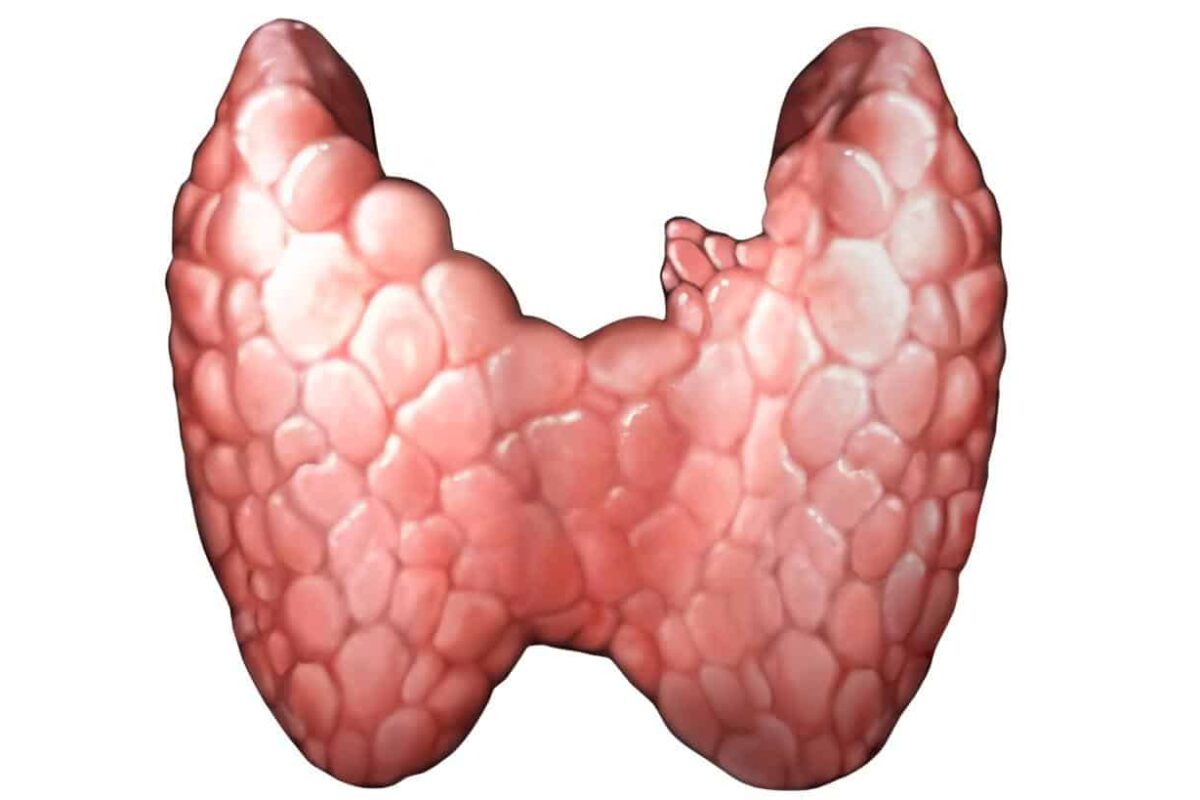
El aumento de la glándula tiroides y evidencia de secreción exagerada de andrógenos. El desarrollo de características sexuales secundarias debe ser normal. Y el examen pélvico puede demostrar adelgazamiento de la mucosa vaginal, moco cervical escaso o ausente y el útero de tamaño normal o pequeño. A pesar de los cambios hipoestrogénicos en el tracto genital estas mujeres generalmente no presentan oleadas de calor.
El principal defecto endocrinológico en las mujeres con amenorrea hipotalámica funcional es una falla del eje hipotálamo-hipófisis con imposibilidad para aumentar la liberación de gonadotropinas, ante la presencia de un hipoestrogenismo severo. Las pacientes con hipogonadismo hipogonadotrópico tienen una deficiencia en la secreción pulsátil de GnRH, dada por una disminución en su frecuencia.
La capacidad de la hipófisis de sintetizar y secretar LH y FSH no parece estar comprometida; las pruebas de estimulación con GnRH muestran una respuesta variable. El mecanismo normal de retroalimentación de la LH en respuesta a los niveles de estrógenos parece estar ausente o bloqueado. Estos problemas se diagnostican por exclusión de lesiones hipofisiarias. Pueden asociarse con situaciones de estrés, así como una gran proporción de mujeres con peso bajo y alteraciones menstruales previas.
Hay varios tractos de neurotransmisores que pueden modular la respuesta de la GnRH y posiblemente implicados en este trastorno: el de la norepinefrina, el de la dopamina y el de la serotonina. Estudios en humanos y animales han mostrado un aumento en la liberación de dopamina y opioides endógenos.
La respuesta que caracteriza el estrés es un aumento en la función del eje hipotálamo-hipófisis-suprarrenal:
Con mayor liberación de cortisol, asociado a incremento de la ACTH, CRH, prolactina, oxitocina, vasopresina, epinefrina y norepinefrina. El efecto sobre el eje reproductivo posiblemente es mediado en varios niveles: a través de la CRH que activa el sistema de los opioides endógenos; la oxitocina puede inhibir la secreción hipotalámica de GnRH; en la glándula hipófisis la ACTH puede suprimir la respuesta a la GnRH.
La evidencia experimental en animales ha demostrado que la hormona liberadora de corticotropina (CRH) inhibe la secreción de prolactina, posiblemente por aumento en la actividad de los opioides endógenos. Esta puede ser la vía a través de la cual el estrés interrumpe la función reproductiva.
Las mujeres con amenorrea hipotalámica tienen una secreción reducida de FSH, LH y prolactina pero un aumento en la de cortisol.
Hay evidencias de que en esta situación existe algún grado de inhibición dopaminérgica y en la pulsatilidad de la GnRH. La inhibición de los pulsos de GnRH puede ser el resultado de un aumento tanto de opioides endógenos como de dopamina.
Pérdida de peso, anorexia y bulimia nerviosas
En estos casos, caracterizados por un temor patológico al aumento de peso, hay una regresión al estado prepuberal. Además de la amenorrea un síntoma frecuente es el estreñimiento, acompañado de dolor abdominal.
La asociación con hipotensión, hipotermia, piel seca, vello delgado y suave estilo lanugo en la espalda, bradicardia y edemas es frecuente.
La bulimia está marcada por episodios de ingesta exagerada seguidos por vómito inducido y ayuno o el uso de laxantes y diuréticos. Es un trastorno raro y puede preceder a la anorexia nerviosa.
(Lea También: Amenorrea: Tratamiento Hormonal)
Los distintos problemas asociados con la anorexia nerviosa representan una disfunción de los mecanismos regulados por el hipotálamo:
Apetito, sed, retención de agua, temperatura, balance autonómico y secreción endocrina. Las alteraciones endocrinas están dadas por niveles bajos de FSH, aumento de cortisol, prolactina normal, TSH y T4 normales con T3 bajo y T3 reversa elevada.
A pesar del hipercortisolismo presente, no son evidentes sus efectos periféricos por disminución en el contenido de receptores celulares para glucocorticoides. Los niveles de gonadotropinas son permanentemente bajos similares al estado prepuberal. Cuando hay ganancia de peso aparece la secreción episódica de LH asociada con el sueño, similar a lo observado durante la pubertad.
El nueropéptido Y puede ser el puente de unión entre el control de la ingesta de alimentos y la secreción de GnRH; sus cuerpos celulares se encuentran en el núcleo arcuado del hipotálamo; estimula el comportamiento de alimentación e inhibe la secreción de gonadotropinas, posiblemente por supresión de los pulsos de GnRH. Cuando hay ayuno los niveles endógenos del neuropéptido Y aumentan.
Al realizar una ecografía se pueden encontrar múltiples quistes ováricos de alrededor de 30 mm, a diferencia de los del ovario poliquístico donde son más pequeños. La prolactina es normal y las gonadotropinas bajas con una relación LH:FSH menor a 1. La respuesta a la prueba de estimulación con GnRH varía de acuerdo con la gravedad del cuadro.
Amenorrea y ejercicio
Esta relación fue descrita desde el siglo I a.C. por Soranus de Efesus en su tratado “Sobre las enfermedades de la mujer”. La incidencia de este problema posiblemente no es bien estimada por falta de atención a los ciclos anovulatorios.
Las dos terceras partes de las atletas que tienen menstruaciones regulares pueden tener fase lútea corta o son anovulatorias. Cuando el entrenamiento empieza antes de la menarquia, esta puede retrasarse hasta 3 años y la incidencia de irregularidades menstruales posteriores es elevada. En los hombres el ejercicio no tiene tanto efecto sobre la pubertad y la función testicular.
Parece que existen dos influencias importantes: el nivel de grasa corporal y el estrés mismo. El concepto de un peso corporal crítico fue planteado por Frisch; postula que se requiere mínimo un 22% de grasa corporal para que haya menstruación. Las atletas que se encuentran en competencia pueden tener una reducción de por lo menos el 50% de su grasa corporal, sin que exista variación en el peso total, ya que la grasa es convertida en fibra muscular.
El estrés y el consumo de energía parecen jugar un papel independiente.
El ejercicio rápido disminuye las gonadotropinas, eleva la prolactina, la hormona de crecimiento, la testosterona, la ACTH, los esteroides suprarrenales y las endorfinas como resultado de un aumento en la secreción y una disminución en la depuración.
El aumento de la prolactina es variable, por lo cual necesariamente no es el responsable de la supresión de GnRH. En estas mujeres se ha demostrado un aumento en los niveles de melatonina durante el día y una secreción exagerada durante la noche; esto parece reflejar la supresión de la secreción pulsátil de GnRH.
Se ha sugerido que la reducción de la grasa corporal afecta el metabolismo de los estrógenos, conduciendo a un aumento en la conversión de estrógenos biológicamente activos hacia catecolestrógenos, relativamente inactivos.
Otras sustancias posiblemente implicadas en la amenorrea de estas pacientes son los opioides endógenos. Sin que esté totalmente dilucidado el mecanismo por el cual se produce, siempre el punto final es la supresión de la secreción pulsátil de GnRH.
Incluso en aquellas deportistas con menstruaciones regulares, la frecuencia y la amplitud de los pulsos de LH se encuentran reducidas en forma significativa. La presentación clínica es un espectro que va de la fase lútea insuficiente, a la anovulación y finalmente la amenorrea; esto depende del grado de supresión de la GnRH.
Síndrome de Kallman
Este síndrome es conocido desde hace varias décadas; la primera descripción en la literatura fue realizada por Aurelio Maestre de San Juan en 1849. En una autopsia demostró la asociación entre hipogonadismo y falta de desarrollo del pedículo olfatorio.
Solo hasta 1944 Kallman aportó la revisión de ocho casos y expuso la teoría de un posible defecto genético, motivo por el cual recibió su nombre. Posteriormente Morsier propuso el nombre de displasia olfato-genital. Es la asociación entre amenorrea y anosmia.
En la mujer este problema se caracteriza por la presencia de amenorrea primaria, desarrollo sexual infantil, gonadotropinas bajas, cariotipo femenino normal y la imposibilidad de percibir olores. Las gónadas responden en forma normal a las gonadotropinas, por lo cual se puede lograr la inducción de la ovulación; son resistentes al citrato de clomifeno.
El perfil hormonal muestra niveles muy bajos de gonadotropinas con la FSH superior a la LH.
Los niveles de estrógenos son también muy bajos. La respuesta a la estimulación con GnRH es variable y depende de la expresividad de la alteración genética.
La resonancia magnética demuestra la ausencia de surcos olfatorios en el rinencéfalo. Este trastorno es la consecuencia de la inhibición de la migración de los axones de los tractos olfatorios y de las neuronas productoras de GnRH desde la placa olfatoria. La mutación responsable de este síndrome incluye un solo gen en el brazo corto del cromosoma X, encargado de codificar la proteína necesaria de esta migración neuronal. Su localización en el cromosoma X explica por qué es de 5 a 7 veces más frecuente en hombres que en mujeres.
Puede asociarse a otras alteraciones neurológicas como pérdida auditiva y ataxia cerebelosa. Puede haber alteraciones renales, óseas y paladar hendido. Puede ocurrir en forma heredada o como un defecto esporádico. Se han descrito tres formas de transmisión: ligado al X, autosómica dominante y autosómica recesiva.
Amenorrea post-píldora
En el pasado se creía que la amenorrea secundaria era un reflejo de la supresión persistente que sobre las gonadotropinas ejercen los anticonceptivos orales o intramusculares de depósito. Actualmente se reconoce que las tasas de fertilidad son normales después de suspender cualquiera de estas formas de anticoncepción y no hay estudio que haya podido demostrar una relación causa-efecto.
Por lo tanto cualquier paciente que se presente con amenorrea después del uso de cualquier método anticonceptivo requiere el estudio completo para detectar otros problemas; este se debe iniciar cuando han transcurrido seis meses de haber suspendido los anovulatorios orales o un año de la aplicación del progestágeno de depósito.