Dr. Germán Barón Castañeda, M.D.
Defectos Síndrome de Anovulación Crónica.
Esto puede ser explicado por una menor inhibición hipotalámica de los opioides endógenos por la reducción de progesterona. Posiblemente existe también alteración en los sitios de interacción entre dopamina y endorfinas.
Señales de retroalimentación alteradas
Las posibles señales erróneas se pueden encontrar en dos niveles: 1. los niveles de estradiol pueden no descender lo suficiente para permitir la retroalimentación positiva sobre FSH para iniciar el crecimiento folicular o, 2. los niveles de estradiol son insuficientes para inducir la retroalimentación positiva sobre la LH necesaria para el pico preovulatorio.
Para que los estrógenos disminuyan en forma adecuada al final del ciclo, se requiere una reducción en su secreción, un metabolismo y depuración adecuados y la ausencia de una fuente extragonadal de la hormona.
El ejemplo típico de la anovulación secundaria a secreción persistente de estrógenos es el embarazo. Con poca frecuencia puede ser el resultado de tumores ováricos o suprarrenales.
El metabolismo y excreción de los estrógenos puede verse alterado en enfermedades hepáticas y del tiroides. Tanto el hipertiroidismo como el hipotiroidismo pueden no solo alterar la excreción hormonal sino modificar las tasas de conversión periférica, llevando a la anovulación.
La producción extragonadal de esteroides puede llegar a una proporción importante.
Aunque la glándula suprarrenal produce poca cantidad de estrógenos, indirectamente contribuye al nivel total en la circulación; esto se realiza por la conversión periférica de precursores androgénicos, especialmente la androstendiona. Por lo tanto, el estrés físico y el psicológico pueden aumentar los precursores androgénicos. La androstendiona es convertida a estrógenos por el tejido adiposo, por lo cual el problema aumenta cuando hay sobrepeso.
En estas pacientes se ha logrado demostrar la existencia de una respuesta ovárica exagerada, con aumento en la actividad de la enzima P450C17 (17-a hidroxilasa). Esto explicaría el incremento en la producción de 17-hidroxiprogesterona. Como esta enzima también se encuentra presente en la glándula suprarrenal, explicaría la mayor síntesis de DHEA y su sulfato.
La deficiencia en la producción estrogénica necesaria para desencadenar el pico de LH no tiene que ser absoluta, como se da por ejemplo en la disgenesia gonadal o en la falla ovárica. Con mayor frecuencia puede ser observada por una secreción folicular inadecuada o por una alteración en la interacción con las gonadotropinas. Ejemplo típico de este estado se presenta en lo ciclos perimenopáusicos, en los cuales no hay una adecuada respuesta del folículo, con disminución en los niveles de estradiol producidos.
Condiciones locales del ovario
En el folículo existe un balance entre hormonas y factores autocrinos y paracrinos. Estos últimos ayudan a mantener la sensibilidad del folículo a la FSH, aumentando el número de receptores y permitiendo la selección del folículo dominante.
El balance estrecho puede ser roto por procesos como secuelas de infección o endometriosis. Los receptores pueden tener alteraciones cualitativas o cuantitativas que impidan el adecuado reconocimiento de las hormonas trópicas. Por los rasgos heterogéneos que presentan las hormonas glicopeptídicas, los efectos pueden ser bloqueados por cambios en su constitución molecular.
Los andrógenos juegan un papel fundamental dentro de la fisiología ovárica. En bajas concentraciones estimulan la actividad de la aromatasa y la producción de estrógenos. Con concentraciones mayores las células de la granulosa los convierten a compuestos 5a-reducidos; estos derivados no pueden ser aromatizados e inhiben la inducción de receptores para LH por parte de la FSH y por lo tanto conducen el folículo a la atresia. Si hay un aumento en los andrógenos, sin importar cual sea su fuente, se puede llegar a la anovulación.
Sobrepeso
El sobrepeso se asocia con tres condiciones específicas que conducen a la anovulación y que pueden ser corregidas con la disminución de la masa corporal:
- Aumento de la aromatización periférica de andrógenos a estrógenos.
- Disminución de la globulina transportadora de esteroides sexuales (SHBG), aumentando los niveles de estrógenos y testosterona libre.
- Aumento de los niveles de insulina que estimula la producción de andrógenos en el estroma ovárico.
Fisiopatología
Los primeros investigadores que describieron un complejo sindromático asociado con trastornos ovulatorios fueron Stein y Leventhal en 1935. Las mujeres que quedaban enmarcadas dentro de este síndrome debían reunir una serie de características como oligomenorrea, hirsutismo y obesidad, en conjunto con la presencia de ovarios poliquísticos aumentados de tamaño.
Actualmente se acepta que el ovario poliquístico no es una entidad aparte, sino el resultado de cualquier alteración que se asocie con anovulación, por lo cual se ha preferido utilizar el término de Síndrome de anovulación crónica. No existe ningún marcador bioquímico específico para confirmar la entidad.
Sin embargo hay una serie de cambios hormonales típicos de este síndrome.
La producción total de estrógenos y andrógenos está aumentada y es dependiente de la secreción de LH. Esto se refleja en una aumento de los niveles circulantes de testosterona, androstendiona, dehidroepiandrosterona (DHEA), sulfato de dehidroepiandrosterona (DHEAS), 17-hidroxiprogesterona (17-OHP) y estrona. La testosterona, androstendiona y DHEA provienen del ovario, mientras que la DHEA-S es contribución exclusiva de la suprarrenal.
Al tratar de hacer el diagnóstico por medio de la ecografía se ha demostrado que hasta 25% de mujeres normales exhiben el patrón característico del ovario poliquístico, incluso aquellas que están utilizando anticonceptivos hormonales.
El ovario no produce una cantidad aumentada de estrógenos. El incremento en su concentración total es debido a la conversión periférica de androstendiona a estrona. El incremento en los niveles de testosterona reduce hasta en un 50% los niveles circulantes de SHBG, lo cual permite que haya una mayor cantidad de hormona libre.
Las pacientes con anovulación persistente tienen niveles aumentados de LH y normales o ligeramente disminuidos de FSH. En primer lugar esto puede ser explicado por una mayor sensibilidad de la hipófisis a la estimulación por GnRH, secundaria al aumento de estrógenos.
Esto se traduce en un aumento en la frecuencia y amplitud de los pulsos de LH; además, la actividad biológica de esta gonadotropina es mayor en presencia de estrógenos. La mayor sensibilidad no solo se presenta en la hipófisis, sino que el hipotálamo también aumenta la frecuencia de secreción de GnRH. La disminución en la FSH es consecuencia de la retroalimentación negativa que producen los estrógenos.
La mayor sensibilidad del hipotálamo y de la hipófisis podría ser atribuida a los niveles aumentados de estrona.
Pero tal vez es más importante la disminución de la SHBG que permite una concentración elevada de estradiol libre.
La producción de FSH no es suprimida totalmente lo cual permite que el crecimiento folicular sea estimulado constantemente, pero no hasta su madurez completa. La vida de estos folículos puede durar varios meses en forma de pequeños quistes, rodeados por células hiperplásicas de la teca, en ocasiones luteinizadas en respuesta a los altos niveles de LH.
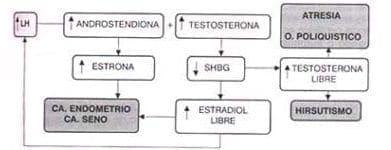
Algunos folículos van hacia la atresia y entran a ser parte del componente estromal del ovario; conservan su capacidad de esteroidogénesis contribuyendo en forma importante a la síntesis de andrógenos. Se cierra así el círculo vicioso, ya que los andrógenos liberados a la circulación disminuyen la SHBG y aumentan el estradiol y la testosterona libres. En el ovario los andrógenos bloquean el crecimiento adecuado, llevando los folículos a la atresia.
En resumen se pude decir que no existe alguna alteración específica en un órgano, sino que el síndrome de anovulación crónica es el resultado del aumento de andrógenos por cualquier causa.
 Figura 5.1 “Círculo vicioso” de la anovulación crónica
Figura 5.1 “Círculo vicioso” de la anovulación crónica
Al examinar el líquido folicular se observan cambios similares a los de los folículos atrésicos: mayores niveles de las proteínas fijadoras de IGFs, especialmente la tipo 1. Esto se traduce en una disminución de la actividad de la IGF-I e IGF-II, disminuyendo la capacidad de aromatización y permitiendo la acumulación de andrógenos. Las células de la granulosa en el ovario poliquístico son diferentes, puesto que son muy sensibles a la FSH.
El tratamiento lógico consiste en alterar la relación de FSH/andrógenos, lo cual se puede lograr de dos maneras: aumentando la FSH con inductores de la ovulación como el citrato de clomifeno o la FSH purificada o, disminuyendo los andrógenos con la resección en cuña o la punción múltiple por vía laparoscópica.
Resistencia a la insulina
Achard en 1921 fue la primera persona en reconocer la asociación entre la intolerancia a la glucosa y el hiperandrogenismo al hacer una descripción de una “paciente diabética barbuda”. Actualmente es una asociación perfectamente reconocida.
Con frecuencia, además de estas dos alteraciones se puede encontrar la presencia de acantosis nigricans, pigmentación color café de la piel, ocasionalmente con apariencia verrugosa y que es más frecuente en el cuello, axilas e ingles. La presencia de la acantosis nigricans está directamente relacionada con la severidad de la hiperinsulinemia.
La resistencia a la insulina es un trastorno relativamente frecuente.
La hiperinsulinemia aparece como un fenómeno secundario, para tratar de compensar la deficiencia de insulina en los órganos blanco. Si en los tejidos la cantidad de insulina no es suficiente para suprimir los ácidos grasos libres, el hígado responde aumentado la producción de glucosa conduciendo finalmente a la hiperglicemia.
Hay varios mecanismos que pueden llevar a la resistencia a la insulina: resistencia periférica en los órganos blanco, disminución de su metabolismo en el hígado o aumento en la sensibilidad pancreática. En las mujeres con hiperandrogenismo se ha demostrado que es secundario a la resistencia periférica y disminución del metabolismo hepático de la insulina.
La presentación clínica varía de acuerdo a la posibilidad que tiene el páncreas de responder ante la deficiencia en los tejidos. La respuesta compensadora, la hiperinsulinemia, lleva a hipertensión, aumento de triglicéridos y disminución de HDL.
La resistencia periférica observada en estas mujeres puede ser secundaria a una mutación en el gene que codifica el receptor, a la presencia de anticuerpos dirigidos contra el receptor o, posiblemente, a algún factor que altere le actividad post-receptor.
Hay estudios que indican que los andrógenos pueden inducir hiperinsulinemia, pero la mayoría de datos muestra lo contrario: la hiperinsulinemia es el factor primario. Hay varios factores que apoyan este concepto. Se sabe que la administración de insulina a pacientes con ovario poliquístico aumenta los niveles de andrógenos circulantes, mientras que al administrar glucosa a mujeres hiperandrogénicas se aumentan tanto los niveles de insulina como los de andrógenos.
(Lea También: Evaluación Clínica de Síndrome de Anovulación Crónica)
Por el contrario, la reducción de peso disminuye la insulina y los andrógenos.
Los cultivos de células tecales en presencia de insulina producen mayor cantidad de andrógenos.
Tratamientos experimentales han demostrado que al reducir los niveles de insulina en mujeres con ovario poliquístico, se disminuye la producción de andrógenos; por otro lado, al suprimir la función ovárica con análogos de GnRH la respuesta de la insulina al administrar glucosa sigue siendo igual.
La insulina tiene la capacidad de unirse al receptor para el IGF-I. Este factor de crecimiento actúa en el ovario aumentando la producción de andrógenos en la teca en respuesta a la LH. Si la insulina se encuentra aumentada, ocupa estos receptores y aumenta la síntesis androgénica.
Además, la hiperinsulinemia en el hígado reduce la síntesis de SHBG y de la proteína transportadora de IGF-I. (IGFBP-1). Esto permite que haya una mayor cantidad de IGF-I en los tejidos periféricos, factor que puede influir en el crecimiento endometrial, aumentando el riesgo de cáncer en estas pacientes.
Tanto el IGF-I como el IGF-II tienen la posibilidad de actuar sobre las células de la granulosa; a su vez, estas células son productoras de las proteínas fijadoras. El IGF-I tiene la capacidad de aumentar la inducción de receptores para LH por la FSH, la síntesis de progesterona, la actividad de la aromatasa y la síntesis de inhibina.
Estas acciones en el ovario son similares a las de la insulina y se traducen en una mayor producción de andrógenos en las células de la teca, estimuladas por la LH. En condiciones normales forman un asa de retroalimentación que busca una concentración adecuada de andrógenos para la conversión a estrógenos en el folículo en crecimiento.
Consecuencias clínicas de la anovulación
La mayoría de las pacientes presentan manifestaciones clínicas que hacen sencillo el diagnóstico. Aproximadamente 50% de las mujeres presentan amenorrea y un 30% adicional trastornos del ciclo, especialmente sangrados abundantes e irregulares. Más o menos 70% de ellas consultan por algún grado de hirsutismo.
Aunque con frecuencia se observa un aumento en la LH con disminución de FSH llevando a una relación LH/FSH superior a 2, en la mayoría de los casos la historia clínica es lo suficientemente clara como para hacer el diag.ðstico. Además se ha demostrado que hasta 40% de las mujeres con síndrome de anovulación crónica tienen una relación normal. Por estos motivos se considera que no es necesario medir en forma rutinaria la relación LH/FSH.
Además de la infertilidad, los trastornos del ciclo y el hirsutismo, la anovulación crónica puede tener efectos importantes a largo plazo. La secreción continua y no opuesta de estrógenos puede conducir al cáncer de endometrio y de seno. Cuando hay hiperinsulinemia acompañando la anovulación aumenta el riesgo de enfermedades cardiovasculares y de presentar una diabetes mellitus.
Se puede concluir que una paciente sin tratamiento puede tener consecuencias graves. Por lo tanto, siempre que se hace el diagnóstico de anovulación se debe hacer un manejo terapéutico adecuado.