Capítulo III
Dr. Germán Barón Castañeda, M.D.
Para poder entender los trastornos del ciclo menstrual debemos inicialmente comprender algunos aspectos básicos de su fisiología.
Los folículos empiezan su desarrollo desde la sexta a séptima semana de vida intrauterina; aumentan en número hasta la semana 20 alcanzando un máximo variable entre 6 y 7 millones, a partir de ese momento una gran proporción de ellos está condenada a sufrir el proceso de atresia.
En el momento del nacimiento quedan reducidos a 300.000; estos folículos son los destinados a crecer o involucionar a lo largo de la vida reproductiva de la mujer. Solo 300 o 400 de ellos alcanzan su madurez completa llegando a la ovulación.
La mayoría sufren el proceso de crecimiento inicial y luego van hacia la atresia; estas modificaciones ocurren continuamente hasta la menopausia sin parar incluso en el embarazo o los períodos anovulatorios.
Para su estudio el ciclo menstrual ha sido dividido en 3 fases: folicular, de ovulación y lútea.
1. Fase Folicular
Durante la fase folicular hay una serie de eventos ordenados que hacen que el número apropiado de folículos esté listo para la ovulación. Generalmente la consecuencia es la supervivencia de un folículo maduro.
Dura 10 a 14 días gracias a la acción secuencial de una serie de hormonas y péptidos paracrinos y autocrinos. En ella deben analizarse los siguientes elementos.
Folículo primordial
El comienzo del ciclo está marcado por el crecimiento inicial de un folículo primordial, el cual consiste de un oocito detenido en estado de diplotene de la profase meiótica y una capa única de células de la granulosa, rodeados por un lámina basal.
El número de folículos que crece en cada ciclo parece ser dependiente del tamaño del “pool” residual de folículos inactivos. El folículo destinado a crecer se cree que es seleccionado desde los primeros días del ciclo; hay autores que opinan que es derivado de una cohorte que ha crecido en ciclos previos en la fase lútea.
El primer signo visible de selección es el aumento de tamaño del oocito, seguido de la transformación de las células de la granulosa a cuboidales, convirtiéndose de tal manera en folículo primario. En respuesta a la FSH se forman puentes de unión entre las células de la granulosa y el oocito, que permiten el paso de nutrientes.
La iniciación del crecimiento folicular parece ser independiente de la estimulación de gonadotropinas y en la mayoría de los casos es seguido de atresia. El evento hormonal más importante de esta fase es el aumento de la FSH.
La disminución de la esteroidogénesis y de secreción de inhibina en la fase lútea lleva a este aumento de FSH, lo cual permite rescatar algunos folículos de la atresia.
Folículo preantral
El folículo progresa al estado preantral cuando el oocito se agranda y es rodeado por una membrana: la zona pelúcida. La capa granulosa prolifera a varias capas de células y la teca se organiza formando el estroma.
Al aparecer el compartimiento tecal, el folículo adquiere vascularización. Este folículo es el denominado secundario por otros autores. El crecimiento es dependiente de hormonas y está correlacionado con aumento en la producción de estrógenos.
Las células de la granulosa tienen la capacidad de sintetizar las tres clases de esteroides sexuales, pero es mayor la producción de estrógenos. La actividad de la aromatasa (P450arom) se encarga de la conversión de andrógenos a estrógenos y parece ser un factor limitante en la producción ovárica de estrógenos.
La aromatización es inducida por la acción de la FSH.
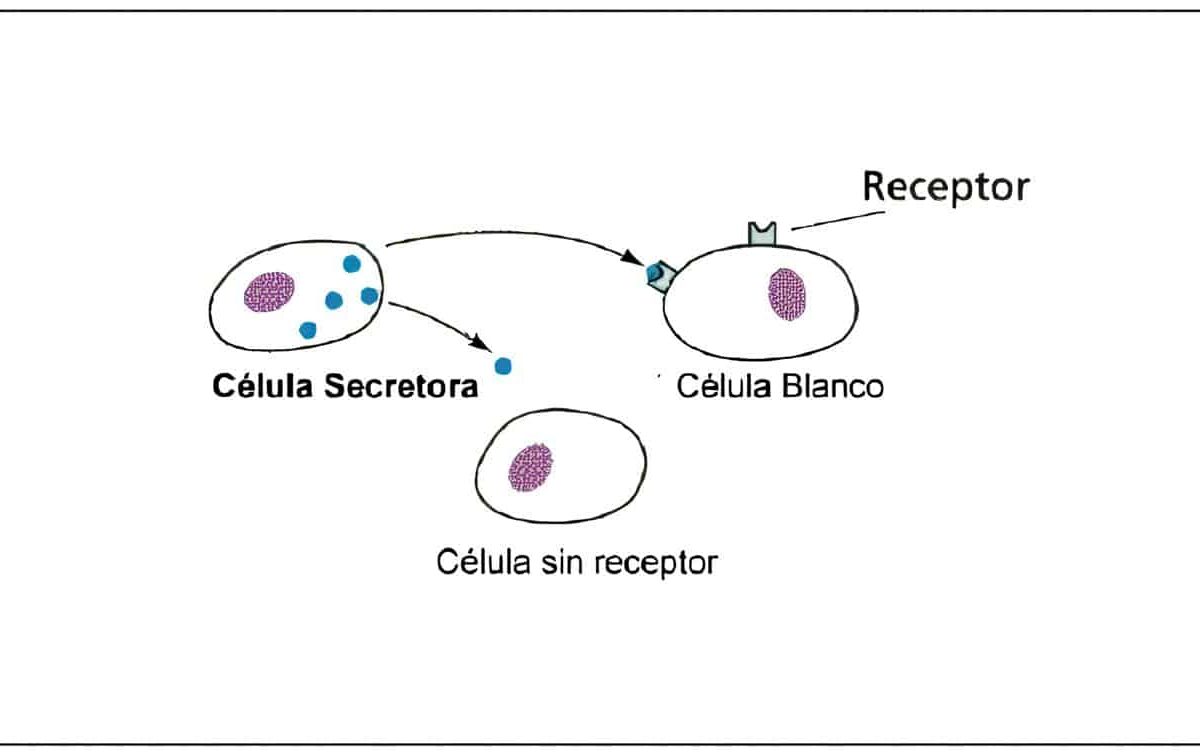
En la granulosa se encuentran receptores para FSH y su número también es un factor limitante en la producción hormonal. Una de las principales acciones de la FSH en esta etapa del ciclo es aumentar el número de sus propios receptores en el folículo. Además, en conjunto con los estrógenos, ejerce un efecto mitogénico sobre las células de la granulosa.
La FSH no solo interviene en iniciar la síntesis de estrógenos; también estimula el crecimiento de las células de la granulosa. Esta acción es mediada por el sistema de la adenil-ciclasa en conjunto con factores de crecimiento, prostaglandinas y péptidos. A medida que las células crecen, hay un grado de diferenciación entre ellas, posiblemente relacionado con su cercanía al oocito.
Las células de la granulosa tienen también receptores específicos para andrógenos, los cuales no solo sirven como substrato para la aromatización inducida por FSH, sino que en concentraciones bajas pueden estimular la acción de la aromatasa.
Cuando el folículo preantral es expuesto a un medio rico en andrógenos se favorece la conversión de androstendiona a compuestos 5-a reducidos, que no pueden ser transformados a estrógenos e inhiben la aromatasa. Inhiben también la inducción de receptores para LH por FSH lo cual conduce a la atresia del folículo.
Folículo antral
Bajo la acción sinérgica de estrógenos y FSH hay un aumento en la producción de líquido folicular que se acumula en los espacios intercelulares de la granulosa, eventualmente uniéndose para formar una cavidad, razón por la cual en este momento el folículo adquiere el nombre de antral o terciario.
Esta acumulación de líquido tiene como fin proveer de un medio endocrino especial al oocito y las células de la granulosa.
El líquido folicular está compuesto por proteínas plasmáticas, mucopolisacáridos, electrolitos, gonadotropinas y esteroides sexuales. Los mucopolisacáridos son secretados por las células de la granulosa por influencia de la FSH.
Los electrolitos y proteínas pasan por trasudación de los vasos tecales. Las concentraciones de gonadotropinas son variables de acuerdo al tamaño folicular; los folículos mayores son ricos en estrógenos, mientras que los que van hacia la atresia tienen mayor contenido de andrógenos.
En presencia de FSH los estrógenos son la sustancia dominante en el líquido folicular, mientras que en ausencia de ella predominan los andrógenos. La LH normalmente no está presente hasta la mitad del ciclo; si se eleva prematuramente, la actividad mitótica de la granulosa disminuye y el folículo va hacia la atresia. La concentración de esteroides en el líquido folicular es mucho mayor que la plasmática.
Aunque tanto la teca como la granulosa tienen habilidad para producir progestágenos, estrógenos y andrógenos, la actividad de la aromatasa en la granulosa excede a la observada en la teca.
Las células tecales en respuesta a LH producen andrógenos que son captados por las células de la granulosa:
Por acción de la enzima aromatasa son convertidos a estrógenos. Esto confirma la teoría de las dos células/dos gonadotropinas expuesta por Ryan y Petro. Posiblemente el primer estrógeno producido es la estrona que rápidamente es convertido a estradiol gracias a la 17-b-hidroxiesteroide deshidrogenasa.
A medida que el folículo se desarrolla, las células de la teca empiezan a expresar los genes para receptores de LH, el sistema citocromo P450 y la 3-b-hidroxiesteroide deshidrogenasa.
El factor de crecimiento similar a la insulina I (IGF-I) actúa en forma sinérgica con la LH, aumentando la transcripción de genes; no interviene directamente en el proceso de esteroidogénesis. La entrada de colesterol a las mitocondrias está regulada directamente por la LH.

Figura 3.1 Teoría de las dos células/dos gonadotropinas
La selección adecuada del folículo dominante ocurre hacia los días 5 a 7 del ciclo y depende de dos acciones estrogénicas: interacción local entre estrógenos y FSH en el folículo y efecto de los estrógenos en la secreción hipofisiaria de FSH.
Mientras que los estrógenos ejercen un efecto positivo sobre el folículo que madura, su retroalimentación negativa sobre la hipófisis le quita soporte gonadotrópico al resto de folículos; esto disminuye la actividad de aromatasa, permitiendo que en ellos prime un ambiente androgénico. El folículo dominante debe escapar a esta supresión de FSH; tiene la ventaja de poseer un mayor número de receptores.
La atresia de los folículos ciertamente no solo es la expresión de la supresión de las gonadotropinas. Intervienen factores paracrinos y autocrinos que llevan a un proceso conocido con el término de apoptosis o muerte celular programada.
La acumulación de una mayor masa de células de la granulosa se acompaña de un aumento del desarrollo vascular de la teca. Esto puede ayudar al ingreso preferencial de gonadotropinas a este folículo. Para poder responder al pico ovulatorio, las células de la granulosa deben adquirir receptores para LH. En los grandes folículos antrales la FSH induce el desarrollo de receptores para LH.
A medida que aumenta la concentración de estrógenos en el folículo, la FSH cambia su foco de acción, de su propio receptor hacia el receptor de LH. La LH puede inducir la producción de sus propios receptores en células previamente estimuladas por FSH. Para la aparición de receptores de LH es indispensable la presencia de los estrógenos.
El folículo dominante logra controlar la secreción de gonadotropinas a través de la producción de estrógenos y péptidos y, de esta manera, el crecimiento de los otros folículos, a través de mecanismos de retroalimentación que actúan sobre el hipotálamo y la hipófisis.
Los estrógenos ejercen su retroalimentación positiva sobre la hipófisis, aumentando la concentración de receptores para GnRH y sobre el hipotálamo, incrementando la secreción de GnRH. Su retroalimentación negativa también se produce sobre hipotálamo e hipófisis, a través de mecanismos no esclarecidos totalmente. La progesterona también actúa en dos sitios, ejerciendo su efecto inhibitorio sobre el hipotálamo y el positivo sobre la hipófisis.
La secreción de FSH es muy sensible a los efectos inhibitorios de los estrógenos, incluso con niveles muy bajos. Con niveles mayores, los estrógenos en conjunto con la inhibina producen una supresión sostenida.
El efecto de los estrógenos sobre la secreción de LH es dosis-dependiente; con niveles bajos se produce retroalimentación negativa, mientras que con niveles mayores hay un efecto estimulador. Para lograr la retroalimentación positiva sobre la LH se requiere una concentración de por lo menos 200 pg/ml de estradiol sostenido por un lapso de 50 horas.
Existe una familia de péptidos sintetizados por la granulosa en respuesta a la FSH y secretados hacia el líquido folicular: Inhibina – Activina – Folistatina. La inhibina es un potente supresor de la secreción de FSH. La activina aumenta la secreción de FSH en la hipófisis y aumenta su acción en el ovario. La folistatina suprime la actividad de FSH, probablemente uniéndose a la activina.
En el folículo, la FSH estimula las células de la granulosa para inducir la secreción de inhibina, proteína de 32 kD constituida por dos subunidades. Esta estimulación es disminuida por la GnRH y el Factor de crecimiento epidérmico, mientras que es aumentada por IGF-I.
La secreción de inhibina aumenta en forma sostenida durante la fase folicular, alcanzando un pico simultáneo con el de LH; esto ayuda a frenar la secreción de FSH y asegurar la dominancia del folículo. Después de la ovulación la cantidad de inhibina secretada es mayor que en la fase folicular. En el ovario suprime la síntesis de andrógenos dependiente de gonadotropinas.
La activina es un péptido similar a la inhibina pero con acción opuesta. Su acción en el folículo consiste en aumentar la unión de FSH a las células de la granulosa e incrementar el estímulo para la aromatización y secreción de inhibina. Existe evidencia que tanto la inhibina como la activina actúan sobre las células de la teca, regulando la síntesis de andrógenos.
La inhibina aumenta el poder estimulador de LH y IGF-I, mientras que la activina lo suprime. Antes de la ovulación la activina suprime la producción de progesterona en la granulosa, impidiendo una luteinización precoz. También incrementa la acción de la FSH para inducir los receptores de LH en la granulosa.
La producción de inhibina y activina no es sólo folicular. En la hipófisis la inhibina disminuye la secreción de FSH y la activina induce la formación de receptores para GnRH. En la placenta también se encuentran estos péptidos, donde la activina induce la producción de progesterona, acción bloqueada por la inhibina.
La folistatina tiene una estructura diferente, siendo semejante al factor de crecimiento epidérmico. Modifica la acción de la FSH ligando la activina. Posee una débil acción similar a la inhibina, frenando la liberación de FSH hipofisiaria.
Se ha encontrado también un factor inhibidor del pico de gonadotropinas (GnSIF), cuya función es inhibir la secreción en picos tanto de FSH como de LH.
En el microambiente del folículo existen varios Factores de crecimiento. Son polipéptidos que modulan la proliferación y diferenciación celular, uniéndose a receptores específicos de membrana. En el ovario uno de los más importantes es el IGF-I, actúa como mediador del crecimiento, promoviendo las acciones de la hormona de crecimiento. Existen seis péptidos que funcionan como proteínas transportadoras de IGF.
Existen diversos receptores de membrana para los IGF. El tipo I se une preferencialmente al IGF-I, aunque también puede ligar insulina. El tipo II puede unirse a IGF-II y débilmente al IGF-I, pero no a la insulina.
Se ha demostrado que el IGF-I en el ovario actúa sobre la teca y la granulosa estimulando la síntesis de DNA, esteroidogénesis, actividad de la aromatasa, síntesis de receptores para LH y secreción de inhibina.
Su principal actividad es amplificar la acción de las gonadotropinas. En la teca puede actuar participando en la comunicación entre compartimientos, favoreciendo el desarrollo folicular coordinado. El IGF-II estimula la mitosis en la granulosa. Cuando han aparecido receptores para LH, el IGF-I promueve la síntesis de progesterona.
El Factor de crecimiento epidérmico es un mitógeno al cual responden las células de la granulosa y su acción es potenciada por otros factores de crecimiento. Las células de la granulosa responden a la secreción de este factor por las células de la teca.
Factor de crecimiento de transformación: Existe el a que es similar al anterior y ocupa sus mismos receptores y el b que usa un receptor distinto. La inhibina es derivada de esta misma familia de genes. El b estimula la inducción de receptores de LH por FSH.
El Factor de crecimiento fibroblástico es mitogénico para una variedad de células y está presente en todos los tejidos productores de esteroides. En el folículo estimula la mitosis de la granulosa, la angiogénesis, estimula el activador de plasminógeno, inhibe la regulación de FSH sobre su propio receptor e inhibe la formación de receptores de LH inducida por FSH.
El Factor de crecimiento plaquetario modifica las vías del AMPc que responden a FSH, especialmente las de diferenciación de la granulosa. Puede actuar sobre la producción de prostaglandinas.
Los Factores de crecimiento angiogénicos estimulan la vascularización. El sistema de Interleuquina-1 posiblemente juega un papel en la ovulación, mediando la síntesis de prostaglandinas.
La interleuquina-1 (IL-1) suprime la luteinización de las células de la granulosa. Esto puede explicarse porque la producción de progesterona parece depender de la expresión del gen de IL-1.
El factor de necrosis tumoral-alfa (TNF-a) puede ser producido por los macrófagos ováricos. Aunque no se ha podido establecer su papel en el ciclo ovárico, probablemente tiene algo que ver con los fenómenos de luteolisis y de atresia folicular.
Varios experimentos animales han demostrado la presencia de tractos nerviosos catecolaminérgicos dentro del ovario. Actúan activando la secuencia de AMPc, induciendo la síntesis de progesterona. Su efecto no se presenta sobre las células de la granulosa sino en las tecales.
Existen también varias sustancias en el líquido folicular que ayudan a la sincronización de toda esta serie de eventos. Se encuentra la prorrenina, cuya síntesis es estimulada por LH. Se cree que estimula la esteroidogénesis para formación de andrógenos, regula el metabolismo del calcio y las prostaglandinas y estimula la angiogénesis.
Hay varios péptidos de la familia de la proopiomelanocortina, especialmente la b-endorfina, cuyo nivel aumenta antes de la ovulación; su función aún no está claramente establecida.
La hormona anti-mülleriana es producida por las células de la granulosa y puede jugar un papel en la maduración del oocito y el desarrollo folicular. Inhibe la proliferación de células de la granulosa y de la teca, así como el crecimiento inducido por el factor de crecimiento epidérmico.
El Inhibidor de la maduración de oocitos (OMI) previene que la reanudación de la meiosis hasta el pico preovulatorio de LH. Al parecer es producido por las células de la granulosa.
Se encuentran otras proteínas tales como la Proteína plasmática A asociada al embarazo que puede inhibir la actividad proteolítica en el folículo antes de la ovulación. La endotelina-1 inhibe la producción de progesterona mediada por LH. La oxitocina también está presente, pero se desconoce su acción.
Folículo Preovulatorio
El folículo continúa su crecimiento después de ser seleccionado como dominante y entra en el estado preovulatorio, conocido también como folículo de De Graaf. Las células de la granulosa aumentan y adquieren inclusiones lipídicas, mientras que la teca se vuelve vacuolada y altamente vascularizada, con lo cual el folículo adquiere un aspecto hiperémico.
A medida que llega a su madurez, aumenta la secreción de estrógenos, llegando a producir un pico 24 a 36 horas antes de la ovulación. Este pico estrogénico induce la aparición del pico de LH.
A través de la acción sobre sus propios receptores, la LH induce la luteinización de la granulosa, aumentando la producción de progesterona. Este efecto es estimulado por el IGF-I. En este periodo se pueden detectar receptores para progesterona en las células de la granulosa del folículo dominante; esta expresión de receptores es inducida por la LH y tiene como fin inhibir las mitosis en la granulosa.
La progesterona afecta la retroalimentación positiva a los estrógenos, actuando directamente sobre la hipófisis y ayudando a la aparición del pico de LH. Para que este efecto pueda ser observado se requiere previamente una adecuada concentración de estrógenos; si este aumento se hace en forma precoz se bloquea el pico de LH. Además, la progesterona facilita el pico de FSH.
El oocito reasume la meiosis.
Llegando a la madurez es mayor la cantidad de estrógenos producida. Al iniciarse el pico de LH, los demás folículos son conducidos a la atresia por su menor contenido de estrógenos y FSH, por lo cual se vuelven androgénicos.
Cuando los folículos menores no alcanzan su madurez y sufren atresia, las células de la teca retornan a su origen como componentes del estroma; retienen su habilidad para producir esteroides en respuesta a LH; esto hace que aumenten los niveles de andrógenos a mitad del ciclo. Este aumento tiene dos funciones: en el ovario favorecen la atresia y también aumentan la libido.