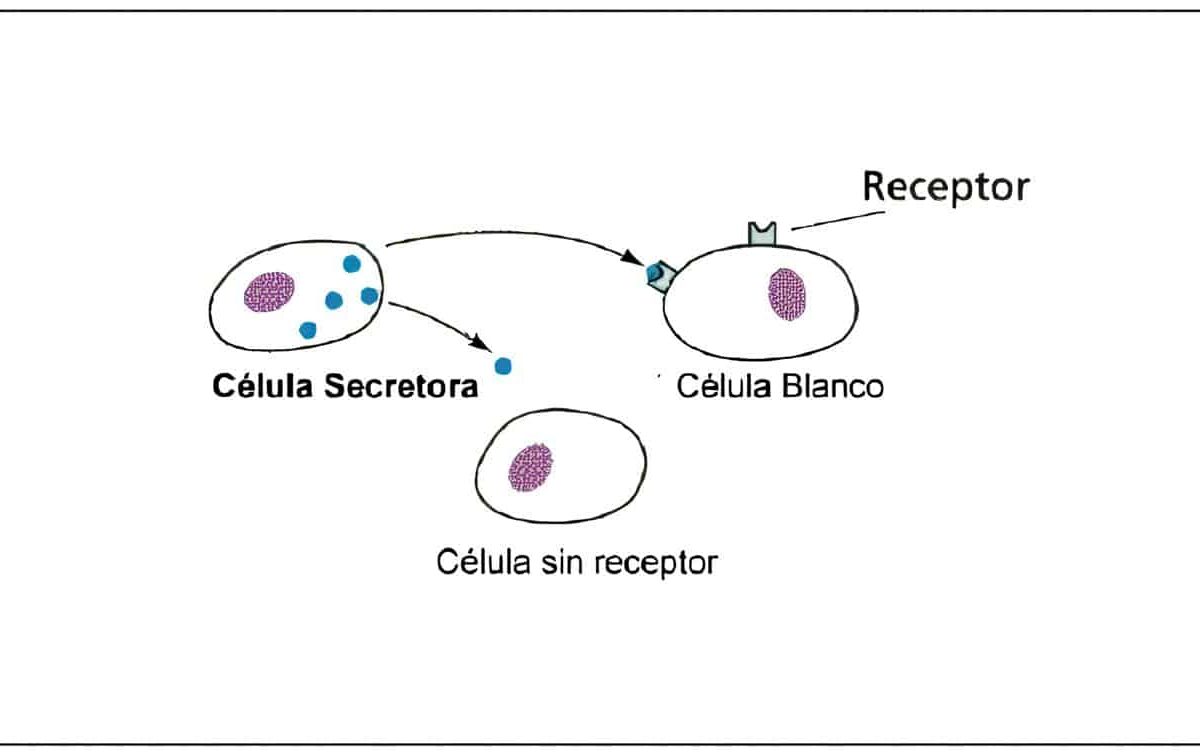
Dr. Germán Barón Castañeda, M.D.
La ovulación sucede más o menos 10 a12 horas después del pico de LH y 24 a 36 horas después de que se logran niveles pico de estradiol. La iniciación del pico de LH parece ser el indicador más confiable de una próxima ovulación, apareciendo 24 a 36 horas antes de la ruptura folicular. Se debe mantener una concentración elevada de LH por 14 a 27 horas para completar la maduración del oocito.
El aumento de LH hace que se reasuma la meiosis en el oocito, lo cual lleva a la expulsión del primer cuerpo polar; además induce la luteinización de la granulosa, la expansión del cúmulo y la síntesis de prostaglandinas y otros eicosanoides indispensables para la ruptura del folículo. La actividad inducida por LH del AMPc es superior a la del inhibidor de la maduración del oocito. Los niveles de progesterona siguen aumentando hasta que se produce la ovulación, lo cual puede frenar el aumento de LH por retroalimentación negativa.
La progesterona aumenta la distensibilidad de las paredes del folículo y en conjunto con la LH estimulan la actividad de las enzimas proteolíticas que digieren el colágeno en la pared del folículo. La granulosa y la teca producen activador de plasminógeno en respuesta a las gonadotropinas. Esto aumenta la concentración intrafolicular de plasmina, que junto con otras proteasas provoca la actividad de colagenasa. A pesar de la acumulación de líquido, la presión intrafolicular no aumenta.
Las prostaglandinas E y F y otros eicosanoides aumentan en el líquido folicular alcanzando un pico en el momento ovulatorio. Pueden actuar liberando sustancias proteolíticas y permitiendo la contracción del músculo liso, ayudando de esta manera a la expulsión del oocito.
(Lea También: Efectos de las Hormonas sobre el Útero)
Los niveles de estradiol disminuyen a medida que la LH alcanza su pico.
Esto puede ser la consecuencia de la regulación hacia abajo de la LH sobre sus receptores en el folículo, acción mediada por la concentración creciente de progesterona producida en la granulosa. Puede ser secundario a la disminución en los niveles de andrógenos. Todos estos eventos encadenados conducen a la ruptura de la pared folicular y a la expulsión del óvulo.
Las células de la granulosa unidas a la membrana basal cierran el folículo y se convierten en células luteínicas; las que están unidas al cúmulo se unen al oocito.
El pico de FSH tiene varias funciones, entre ellas la estimulación del activador de plasminógeno. Tiene importancia en asegurar un número adecuado de receptores para LH. La dispersión de las células del cúmulo permite que el oocito quede flotando en el líquido antral previo a su expulsión lo cual requiere la formación de una matriz de ácido hialurónico, efecto posiblemente mediado por la FSH.
El mecanismo que frena el aumento de LH es desconocido; se cree que puede contribuir la retroalimentación negativa de progesterona o la pérdida de estímulo al disminuir los estrógenos. Puede ser producido por freno del hipotálamo o por depleción de LH en la hipófisis.
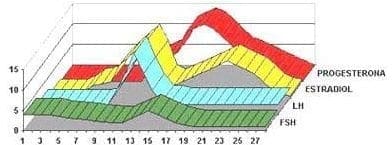
Figura 3.2 Cambios hormonales durante el ciclo ovárico
Fase Lútea
Después de liberado el óvulo, las células de la granulosa aumentan de tamaño y adquieren apariencia vacuolada y un pigmento amarillo, luteina. Durante los primeros tres días de la fase lútea las células de la granulosa continúan su crecimiento. Capilares penetran hacia esta zona gracias a la acción de factores que estimulan la angiogénesis secretados por células tecales y de la granulosa.
La adecuada función del cuerpo lúteo depende de un desarrollo preovulatorio adecuado, así como de una buena vascularización. La capacidad de esteroidogénesis es dependiente del transporte de colesterol por las LDL, por lo cual la irrigación sanguínea es indispensable y de la secreción tónica continua de la LH. La LH es la responsable de que las células de la granulosa adquieran receptores para LDL.
El cuerpo lúteo no es homogéneo. Además de las células luteínicas tiene células endoteliales, macrófagos, pericitos y fibroblastos. Existen dos tipos de células luteínicas, unas pequeñas y otras grandes. Las grandes producen relaxina y oxitocina y tienen mayor capacidad de esteroidogénesis y producción de progesterona. Posiblemente a medida que el cuerpo lúteo va perdiendo función las células grandes se van convirtiendo en pequeñas.
La progesterona se empieza a producir en forma rápida después de la ovulación, alcanzando un pico aproximadamente 8 días después. Actúa en forma local y central, evitando el crecimiento de nuevos folículos. Este crecimiento es inhibido también por la baja concentración de gonadotropinas por retroalimentación negativa de estrógenos, progesterona e inhibina. Durante esta fase la secreción de inhibina es elevada; es controlada por la LH, permitiendo la caída de FSH necesaria para el comienzo del próximo ciclo.
En el ciclo normal el tiempo entre el aumento de LH y la menstruación es de 14 días.
El cuerpo lúteo empieza a perder función 9 a 11 días después de la ovulación. El mecanismo de regresión es desconocido, pero se cree que tanto los estrógenos como las prostaglandinas pueden jugar papel a medida que aumentan en esta fase. Para que el cuerpo lúteo permanezca activo se requiere la presencia de HCG.
La FSH es indispensable para los cambios descritos en las células de la granulosa. Debido a la disminución en la producción de esteroides e inhibina y al cambio en el patrón pulsátil de secreción de GnRH, la FSH empieza a elevarse dos días antes de aparecer la menstruación.
Las células de la línea blanca posiblemente juegan un papel paracrino en la involución del cuerpo lúteo. Se ha observado un marcado aumento de los macrófagos en el momento en que empiezan los cambios involutivos. Pueden intervenir en la luteolisis mediando la síntesis de prostaglandinas.
Referencias
- Adashi EY. Ciclo ovárico. En Yen SSC., Jaffe RB. Endocrinología de la reproducción. Ed. Panamericana (3a). 1993: 204-260.
- Adashi EY. Cytokine-mediated regulation of ovarian function: encounters of a third kind. Endocrinology. 1989; 124: 2043-2045.
- Adashi EY., Resnick CE., Hurwitz A., et al. Ovarian granulosa cell-derived insuline-like growth factor binding proteins: modulatory role of follicle-stimulating hormone. Endocrinology. 1991; 128: 754.
- Bergh C., Carlsson B., Olsson JH., et al. Regulation of androgen production in cultured human thecal cells by insulin-like growth factor I and insulin. Fertil Steril. 1993; 59: 323.
- Bicsak TA., Tucker EM., Cappel S., et al. Hormonal regulation of granulosa cell inhibin byosynthesis. Endocrinology. 1986; 131: 1009.
- Braden TD., Conn PM. Activin-A stimulates the synthesis of gonadotropin-releasing hormone receptors. Endocrinology. 1992; 130: 2101
- Brailly S., Gourgeon A., Milgrome E., er al. Androgens and progestins in human ovarian follicle. Differences in the evolution of preovulatory, healthy nonovulatory and atretic follicles. J Clin Endocrinol Metab. 1981; 53: 128.
- Buckler HM., Healy DL., Burger HG. Purified FSH stimulates inhibin production from the human ovary. J Endocrinol. 1989; 122: 279.
- Burger HG., Findlay JK. Potential relevance of inhibin to ovarian physiology. Endocrinol. 1989; 7: 69.
- Carr BR. Disorders of the ovary and female reproductive tract. En Wislon JD., Foster DW. Williams textbook of endocrinology. W.B.Saunders Co. (8a). 1992: 733-798.
- Carr, BR. The ovary. En Carr BR., Blackwell RE. Textbook of reproductive medicine. Appleton & Lange (1a). 1993: 183-207.
- Carr BR. The normal menstrual cycle: the coordinated events of the hypothalamic-pituitary-ovarian axis and the female reproductive tract. En Carr BR., Blackwell RE. Textbook of reproductive medicine. Appleton & Lange (1a). 1993: 209-220.
- Castelbaum A., Doyle M., DeCherney AH. Past, present and future of steroid hormones. Infertil Reprod Clin NA. 1992; 3: 1: 1-6.
- Couzinet B., Brailly S., Bouchard P., et al. Progesterone stimulates luteinizing hormone secretion by acting directly on the pituitary. J Clin Endocrinol Metab. 1992; 74 :374.
- Chaffkin LM., Luciano AA., Peluso JJ. Progesterone as an autocrine/paracrine regulator of human granulosa cell proliferation. J Clin Endocrinol Metab. 1992; 75: 1404.
- Chikasawa K., Araki S., Tameda T. Morphological and endocrinological studies on follicular development during the human menstrual cycle. J Clin Endocrinol Metab. 1986; 62: 305.
- Cook ID. The corpus luteum. Human Reprod. 1988; 3: 153.
- DiZerega GS., Marrs RP., Roche PL., et al. Identification of protein(s) in pooled human follicular fluid which supress follicular response to gonadotropins. J Clin Endocrinol Metab. 1983; 56: 35.
- Dodson WC., Schomberg DW. The effecto of transforming growth factor-b on follicle-stimulating hormone-induced differentiation of cultured rat granulosa cells. Endocrinology. 1987; 120: 512.
- El-Roeiy A., Chen X., Roberts VJ., et al. Expression of insulin-like growth factor-I (IGF-I) and IGF-II and the IGF-I, IGF-II, and insulin receptor genes and localization of the gene products in the human ovary. J Clin Endocrinol Metab. 1993; 77: 1411.
- Erickson GF. An analysis of follicle development and ovum maturation. Seminars Reprod Endocrinol. 1986; 4: 233.
- Erickson GF., Macgoffin DA., Dyer CA., et al. The ovarian androgen producing cells: a review of structure/function relationships. Endocr Rev. 1985; 6: 371.
- Esch FS., Shimasaki S., Mercado M., et al. Structural characterization of follistatin: a novel follicle-stimulating hormone release-inhibiting polypeptide from the gonad. Mol Endocrinol. 1987; 1: 849.
- Filicori M., Santoro M., Merriam GL., et al. Characterization of the physiologycal pattern of episodic gonadotropin secretion throughout the human menstrual cycle. J Clin Endocrinol Metab. 1986; 62: 1136.
- Findlay J. The nature of inhibin and ists use in the regulation of fertility and diagnosis of infertility. Fertil Steril. 1986; 46: 770.
- Fritz MA., Speroff L. The endocrinology of the menstrual cycle, the interaction of folliculogenesis and neuroendocrine mechanisms. Fertil Steril. 1983; 38: 509.
- Giudice LC. Insulin-like growth factors and ovarian follicular development. Endocr Rev. 1992; 13: 641.
- Gougeon A. Dynamics of follicular growth in the human: a model from preliminary results. Hum Reprod. 1986; 1: 81.
- Gougeon A., Chainy GBN. Morphometric studies of small follicles in ovaries of women at different ages. J Reprod Fertil. 1987; 81: 433.
- Hall JE., Schoenfeld DA., Martin KA., et al. Hypothalamic gonadotropin-releasing hormone secretion and follicle-stimulating hormone dynamics during the luteal-follicular transition. J Clin Endocrinol Metab. 1992; 74: 600.
- Hernandez ER., Hurwitz A., Vera A., et al. Expression of the genes encoding the insulin-like growth factors and their receptors in the human ovary. J Clin Endocrinol Metab. 1992; 74: 419.
- Hild-Petito S., West NB., Brenner RM., et al, Localization of androgen receptor in the follicle and corpus luteum of the primate ovary during the menstrual cycle. Biol Reprod. 1991; 44: 561.
- Hillier SG. Paracrine control of follicular estrogen synthesis. Seminars Reprod Endocrinol. 1991; 9: 332.
- Hillier SG., Reichert LE., van Hall EV. Control of preovulatory follicular estrogen biosynthesis in the human ovary. J Clin Endocrinol Metab. 1981; 52: 847.
- Hillier SG., Van Den Boogard AMJ., Reichert LE., et al. Intraovarian sex steroid hormone interactions and the regulation of follicular maturation: aromatization of androgens by human granulosa cells in vitro. J Clin Endocrinol Metab. 1980; 50: 640.
- Hodgen GD. The dominant ovarian follicle. Fertil Steril. 1982; 38: 381.
- Jones PBC., Vernon MW., Muse KN., et al. Plasminogen activator inhibitor in human preovulatory follicular fluid. J Clin Endocrinol Metab. 1989; 68: 1039.
- Judd S., Terry A., Petrucco M., et al. The source of pulsatile secretion of progesterone during the human follicular phase. J Clin Endocrinol Metab. 1992; 74: 299.
- Kessel B., Liu YX., Jia XC., et al. Autocrine role of estrogens in the augmentation of luteinizing hormone receptor formation in cultured rat granulosa cells. Biol Reprod. 1985; 32: 1038.
- Keyes PL., Wiltbank MC. Endocrine regulation of the corpus luteum. Annu Rev Physiol. 1988; 50: 465.
- Knecht M., Brodie AMH., Catt KJ. Aromatase inhibitors prevent granulosa cell differentiation: an obligatory role for estrogens in luteinizing hormone receptor expression. Endocrinology. 1985; 117: 1156.
- Kobayashi M., Nakano R., Ooshima A. Immunohistochemical localization of pituitary gonadotropins and gonadal steroids confirms the two cells two gonadotropins hypothesis of steroidogenesis in the human ovary. j Endocrinol. 1990; 126: 483.
- Koss RD. {Potential relevance of angiogenic factors to ovarian physiology. Sem Rep Endocrinol. 1989; 7: 29.
- Krishna A., Beesley K., Terranova PF. Histamine, mastcells and ovarian function. J Endocrinol. 1988; 120: 363.
- Laatikainen T., Raisanen I., Tulenheimo A., et al. Plasma b-endorphin and the menstrual cycle. Fertil Steril. 1985; 44: 206.
- Le Nestour E., Marraoui J., Lahlou N., et al. Role of estradiol in the rise in follicle-stimulating hormone levels during the luteal-follicular transition. J Clin Endocrinol Metab. 1993; 74: 439.
- Lumsden MA., Kelly RW., Templeton AA., et al. Changes in the concentrations of prostaglandins in preovulatory human follicles after administration of HCG. J Reprod Fertil. 1986; 77: 119.
- Magoffin DA. Regulation of differentiated functions in ovarian theca cells. Seminars Reprod Endocrinol. 1991; 9: 321.
- Mais V., Kazer RR., Cetel NS., et al. The dependency of folliculogenesis and corpus luteum function on pulsatile gonadotropin secretion in cycling women using a gonadotropin-releasing hormone antagonsit as a probe. J Clin Endocrinol Metab. 1986; 62: 1250.
- Maruncic M., Casper RF. The effect of luteal phase estrogen antagonism on luteinizing hormone pulsatility and luteal function in women. J Clin Endocrinol Metab. 1987; 64: 148.
- Marut EL., Huang SC., Hodgen GD. Distinguishing the steroidogenic roles of granulosa and theca cells of the dominant ovarian follicle and corpus luteum. J Clin Endocrinol Metab. 1983; 57: 925.
- Mason AJ., Niall HD., Seeburg PH. Structure of two human ovarian inhibins. Biochem Biophys Res Commun. 1986; 135: 957.
- McNatty KP., Markris A., DeGrazia C., et al. Steroidogenesis by recombined follicular cells from the human ovary in vitro. J Clin Endocrinol Metab. 1980; 51: 1286.
- McNatty KP., Smith DM., Makris A., et al. The microenvironment of the human antral follicle; inter-relationships among the steorid levels in antral fluid, the population of granulosa cells, and the status of the oocyte in vivo and in vitro. J Clin Endocrinol Metab. 1979; 49: 851.
- Miro F., Hillier SG. Relative effects of activin and inhibin on steroid hormone synthesis in primate granulosa cells. J Clin Endocrinol Metab. 1992; 75: 1556.
- Nulsen JC., Peluso JJ. Regulation of ovarian steroid production. Infertil Reprod Clin NA. 1992; 3: 1: 43-58.
- Peters H., Byskov AG., Himelstein-Graw R., et al. Follicular growth: the basic event in the mouse and human ovary. J Reprod Fertil. 1975; 45: 559.
- Petraglia F., Di Meo G., Storchi R., et al. Proopiomelanocortin-related peptides and methionine enkephalin in human follicular fluid: changes during the menstrual cycle. Am J Obstet Gynecol. 1987; 157: 142.
- Priddy AR., Killick SR., Elstein M., et al. The effect of prostaglandin synthetase inhibitors on human preovulatory follicular fluid prostaglandin, thromboxane, and leukotriene concentrations. J Clin Endocrinol Metab. 1990; 71: 235.
- Rabinovici J., Spencer SJ., Doldi N., et al. Activin-A as an intraovarian modulator: actions, localization and regulation of the intact dimer in human ovarian cells. J Clin Invest. 1992; 89: 1528.
- Reddi K., Wickings EJ., McNeilly AS., et al. Circulating bioactive follicle stimulating hormone and immunoreactive inhibin during the human menstrual cycle. Clin Endocrinol. 1990; 33: 547.
- Richards JS., Jahnsen T., Hedin L., et al. Ovarian follicular development: from physiology to molecular biology. Recent Prog Horm Res. 1987; 43: 231.
- Rossmanith WG., Laughlin GA., Mortola JF., et al. Pulsatile cosecretion of estradiol and progesterone by the midluteal phase corpus luteum: temporal link to luteinizing hormone pulses. J Clin Endocrinol Metab. 1990; 70: 990.
- Sasano H., Okamoto M., Mason J., et al. Immunolocalization of aromatase, 17-a hidroxilase and side-chain-cleavage cytochromes P-450 in the human ovary. J Reprod Fert. 1989; 85: 163.
- Speroff L., Glass RH., Kase NG. Regulation of the menstrual cycle. En Speroff L., Glass RH., Kase NG. Clinical Gynecologic Endocrinology and Infertility. Ed. Williams & Wilkins (5a), 1994; 183-250.
- Tilly JL., Kowalsky KI., Schomberg DW., et al. Apoptosis in atretic ovarian follicles is associated with selective decreases in messenger ribonucleic acid transcripts for gonadotropin receptors and cytochrome P450 aromatase. Endocrinology. 1992; 131: 1670.
- Tsang BK., Armstrong DT., Whitfield JF. Steroid biosynthesis by isolated human ovarian follicular cells in vitro. J Clin Endocrinol Metab. 1980; 51: 1407.
- Tsonis CG., Sharpe RM. Dual gonadal control of follicle-stimulating hormone. Nature. 1986; 321: 724.
- Uilenbrock JTJ., Woutersen PJA., Van der Schoot P. Atresia in preovulatoru follicles: gonadotropin binding in steroidogenic activity. Biol Reprod. 1989; 23: 219.
- Vermesh M., Kletsky OA. Longitudinal evaluation of the luteal phase and its transition into the follicular phase. J Clin Endocrinol Metab. 1987; 65: 653.
- Yamamoto M., Shima K., Nakano R. Gonadotropin receptors in human ovarian follicles and corpora lutea throughout the menstrual cycle. Horm Res. 1992; 37 (Suppl 1): 5.
- Ying SY. Inhibins, activins, and follistatins: gonadal proteins modulating the secretion of follicle-stimulating hormone. Endocr Rev. 1988; 9: 267.
- Yong EL., Baird DT, Hillier SG. Mediation of gonadotropin-stimulated growth and differentiation of human granulosa cells by adenosine-3′,5’monophosphate: one molecule, two messages. Clin Endocrinol. 1992; 37: 51.